氯诺昔康超前镇痛对下肢骨折患者术后疼痛介质及血糖波动的影响
王 飞,陈秀卿,曹 煜,叶军青
0 引言
下肢骨折是骨科多发性疾病,主要是因直接或者间接暴力所致,局部肿胀、疼痛及畸形较为明显。临床多需通过外科手术达到解剖复位,但手术创伤较大,能够引起神经内分泌改变,刺激疼痛介质的释放,影响术后患者恢复[1]。同时术后疼痛又可刺激机体多种激素级联释放,形成高代谢状态,导致血糖波动,增加术后并发症[2]。术后疼痛的管理在麻醉学及外科学领域中备受关注,有报道,积极有效的术后镇痛能够减轻机体不良应激反应,减少围手术期并发症[3-4]。超前镇痛为围手术期镇痛的新理念,是在伤害性刺激发生前采取干预措施,避免中枢及外周神经敏化,起到消除或者减少伤害性刺激所致疼痛的作用[5-7]。氯诺昔康是昔康类非甾体抗炎镇痛药[8],主要通过抑制环氧化酶(COX)的活性抑制前列腺类物质的合成起到镇痛作用,由于其对COX-2的控制作用更强,因此不良反应较小[7]。本研究旨在分析氯诺昔康超前镇痛对下肢骨折患者术后疼痛介质及血糖波动的影响,为骨折患者围手术期的疼痛处理提供可靠依据。
1 资料与方法
1.1 一般资料 选择我院2017年1月至2018年6月收治的151例下肢骨折患者。
纳入标准[9]:肢体伴疼痛、畸形、骨擦音和功能障碍,并经X线检查确诊为下肢骨折;明确外伤史;既往无骨折史;凝血功能无异常;无药物使用禁忌证;ASA分级为Ⅰ~Ⅱ级。排除标准:开放性或者多发性骨折;大血管及神经明显受损;糖尿病和其他内分泌疾病;长期服用镇痛药史或者慢性疼痛病史;心、肝、肾等器官显著病变;中重度骨质疏松。按随机数字表法分为对照组和研究组,两组一般资料比较差异无统计学意义(P>0.05),见表1。本研究家属及患者均签署知情同意书,经过医院伦理委员会许可。
1.2 方法 两组患者入室后均持续监测心率、无创血压、心电图、呼吸频率、血氧饱和度,给予1~2 L/min低流量面罩吸氧,建议上肢静脉通路。研究组在手术切皮前30 min静脉注射8 mg氯诺昔康(生产厂家:湖北邦盛化工有限公司,规格:8 mg/瓶,批号:20160518),对照组在手术切皮前30 min注射同等剂量的生理盐水。所有患者均接受腰硬联合麻醉,于L2~3或者L3~4间隙穿刺成功后,在蛛网膜下腔注入2.5~3.0 ml 0.5%罗哌卡因重比重液,硬膜外置管3~4 cm,术中根据患者实际情况(出现疼痛、躁动)适当追加0.75%罗哌卡因(生产厂家:常州凯乔生物科技有限公司,规格:10 ml,批号:20160410),术中均保持患者生命体征平稳、心率及血压波动低于基础值20%,必要时加用血管活性药物维持。术后均采用静脉自控镇痛,药物配比:0.15 mg/kg托烷司琼(生产厂家:瑞阳制药有限公司,规格:5 ml∶5 mg,批号:20160814)+0.25 mg/kg地佐辛(生产厂家:扬子江药业集团有限公司,规格:1 ml∶5 mg,批号:20160319)+2 μg/kg舒芬太尼(生产厂家:宜昌人福药业有限责任公司,规格:1 ml∶50 μg,批号:20160520),背景量为1.5~2.0 ml/h,自控量为1.5~2.0 ml/h,自控间隔时间为10~15 min。记录患者术毕至苏醒时间、拔管时间、意识恢复时间,以及术后不良反应发生情况。
1.3 观察指标
1.3.1 血液指标 于术前及术后24 h抽取患者外周静脉血2 ml,常规处理后保存待检。以酶联免疫法测定血清前列腺素E2(PGE2)、P物质(SP)、β-内啡肽(β-EP)水平。采用血糖仪测定患者术前及术后24 h血糖水平,计算血糖水平平均值(MBG)。
1.3.2 视觉模拟评分(VAS) 于术前及术后24 h进行评分,总分为10分,分数越高提示疼痛程度越明显。

2 结果
2.1 两组苏醒时间、拔管时间、意识恢复时间比较 两组苏醒时间、拔管时间、意识恢复时间比较差异无统计学意义(P>0.05),见表2。
表1 两组患者一般资料比较(例,%)
2.2 两组手术前后血糖变化情况比较 术前,两组血糖值比较差异无统计学意义(P>0.05);术后,两组血糖值均上升,且研究组低于对照组(P<0.05),见表3。
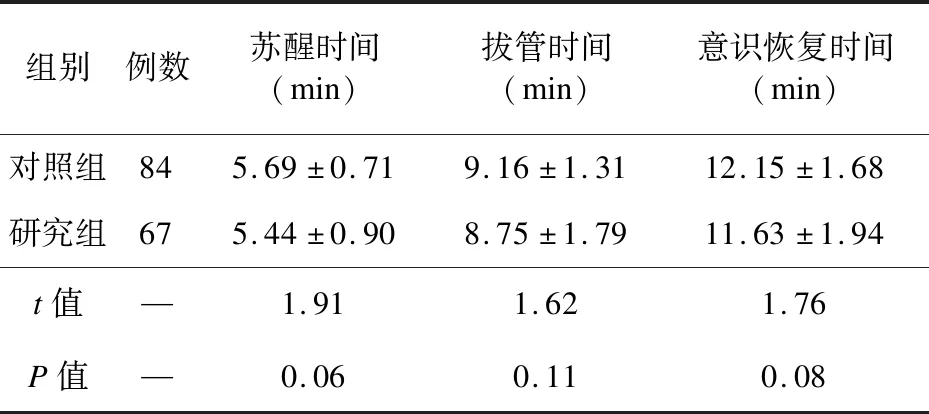
表2 两组患者苏醒时间、拔管时间、意识恢复时间比较
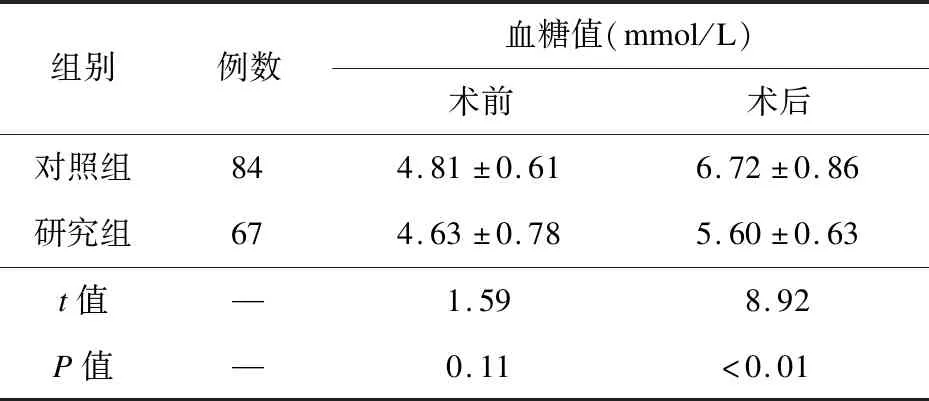
表3 两组患者手术前后血糖变化情况比较
2.3 两组疼痛介质及VAS比较 术前,两组疼痛介质及VAS比较差异无统计学意义(P>0.05);术后,研究组PGE2、SP及VAS低于对照组(P<0.05),β-EP高于对照组(P<0.05),见表4。
2.4 两组不良反应比较 两组均有头晕、恶心呕吐及瘙痒发生,组间不良反应发生率比较差异无统计学意义(P>0.05),见表5。
3 讨论
下肢骨折为骨折的常见类型,近年来其发生率呈上升趋势,常规保守治疗需长时间制动,可影响局部组织肿胀的消退,降低骨折愈合能力,引起畸形愈合,影响肢体功能。切开复位内固定是下肢骨折的主要治疗方式,可恢复骨折端的解剖关系,但疼痛较为强烈。超前镇痛可起到痛觉传导通路的超前保护作用,可有效减轻术后急性疼痛,减少术后镇痛药物的需求,预防慢性疼痛的产生[10-12]。阿片类药物为既往超前镇痛首选药物,具有起效快、镇痛时间长等特点,但其大剂量应用可出现多种不良反应,甚至导致药物依赖[13]。
非甾体抗炎镇痛药在治疗疼痛剂量范围内无欣快感,不影响脑部觉醒机制及视觉,目前已广泛应用于围手术期疼痛治疗中。氯诺昔康作为一种非甾体抗炎镇痛药,通过降低外周环氧合酶及前列腺素合成酶活性,抑制内源性炎性因子对痛觉神经的刺激,减少外周敏感化,起到镇痛作用[14-15]。氯诺昔康能够激活内源性阿片神经内啡肽系统,发挥中枢性镇痛效应,且可避免出现阿片类药物的镇静、呼吸抑制、依赖性等不良反应[16]。尽管氯诺昔康静脉给药后可起到稳定快速的镇痛作用,但其起效前有一定潜伏期,无法拮抗已产生的前列腺素样致痛物质,因此对于即时镇痛的效果较弱[17]。手术刺激前给予氯诺昔康可减轻手术刺激的剧烈反应,降低中枢神经元兴奋性,起到超前镇痛作用[18]。本研究结果显示,两组苏醒时间、拔管时间及意识恢复时间相似,说明其未影响患者苏醒期质量。
骨折创伤及手术刺激能够诱导多种疼痛介质的释放,增加痛觉感受器敏感性,降低神经末梢痛阈,形成创伤后疼痛的高敏状态[19]。PGE2是介导疼痛的重要物质,可诱导炎症,促进局部血管扩张,增加毛细血管通透性,引起红肿热痛等表现[20]。其含量增加能够直接导致疼痛或者增加神经根对缓激肽等物质的敏感性,降低神经根痛阈,从而导致疼痛[21]。PGE2可引起血管痉挛及组织水肿,刺激SP释放。SP通过多种途径参与疼痛及痛觉过敏的生成,是评估疼痛程度的客观依据[22]。SP可刺激组胺及5-羟色胺释放,促进神经纤维末梢释放更多的SP,启动恶性循环;SP又可扩张血管,增加血管通透性,产生强烈持久的通透反应及组织损伤。β-EP作为一种类阿片肽神经递质,多来源于肾上腺、垂体、丘脑等组织,能够调节伤害性感受器,其镇痛作用较强,可抑制疼痛传递,避免PGE2、SP等疼痛介质的释放[23]。本研究发现,术前两组PGE2、SP及β-EP比较差异无统计学意义,术后患者PGE2、SP均上升,β-EP均下降,说明其发生了明显的应激反应,但研究组变化幅度较小,分析原因可能为氯诺昔康可抑制COX-2表达,从而改善感觉神经纤维所致的伤害性刺激,减轻应激反应,起到抗炎镇痛作用。
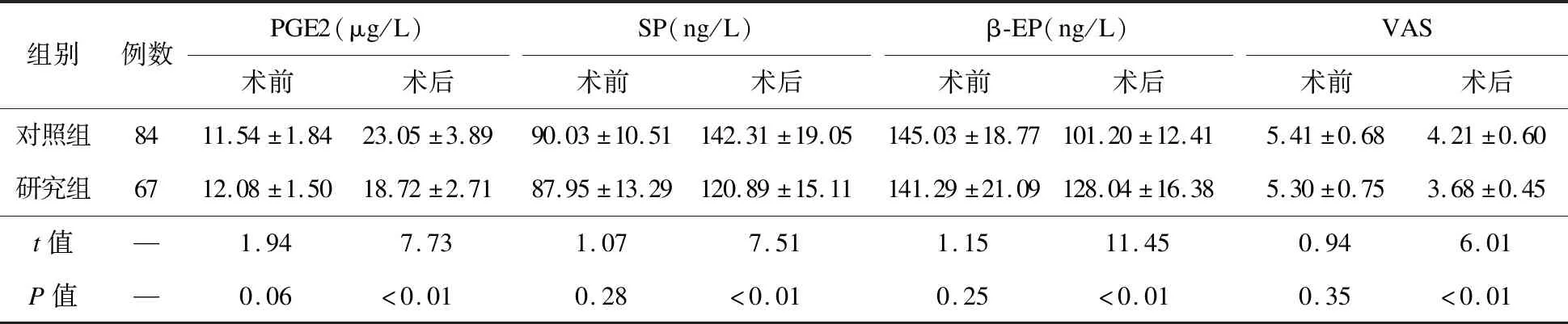
表4 两组患者手术前后疼痛介质及VAS比较
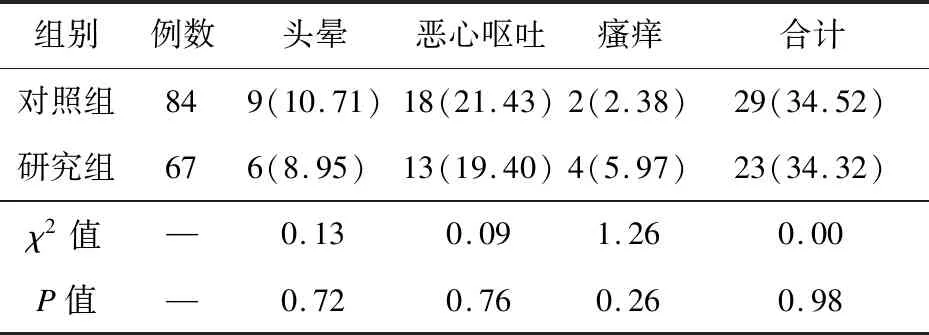
表5 两组患者不良反应比较(例,%)
创伤后,机体应激反应可促进生长激素及胰高血糖素分泌,导致胰岛素分泌相对不足,增加糖异生,加大糖生成量,另一方面,胰岛素作用又可出现胰岛素抵抗,引起糖利用受损,从而形成高血糖[24]。机体血糖波动明显时可加速细胞功能及形态的损伤,影响创伤修复。本研究结果显示,术后两组血糖均上升,但研究组血糖波动较小,可能因为氯诺昔康的镇痛效果较好,降低了机体血糖波动幅度。头晕、恶心呕吐、皮肤瘙痒为临床麻醉的常见不良反应,本结果显示,两组不良反应发生率比较差异无统计学意义,说明氯诺昔康超前镇痛的安全性较高,未增加术后不良反应。
综上所述,氯诺昔康超前镇痛是一种安全有效的镇痛方式,可降低术后疼痛介质及血糖的变化幅度,减轻下肢骨折患者术后疼痛。

