二陈汤加沙参、麦冬对Lewis肺癌小鼠免疫功能及肿瘤血管生成的影响
王子卿 李燕 王芬 江洋 张弘 屈直 李志明 杜倩倩 黄璐璐


摘要:目的 观察二陈汤加沙参、麦冬对Lewis肺癌小鼠免疫功能及肿瘤血管生成的影响,探讨其抗肿瘤的可能作用机制。方法 30只C57BL/6小鼠腋窝皮下注射Lewis肺癌细胞造模。随机分为模型组、中药组和顺铂组,每组10只。模型组予0.4 mL/20 g生理盐水灌胃,中药组予0.4 mL/20 g二陈汤加沙参、麦冬药液灌胃,顺铂组予3 mg/kg顺铂溶液200 μL/20 g腹腔注射,每日1次,连续3 d,并予0.4 mL/20 g生理盐水灌胃,每日1次,连续14 d。称定小鼠体质量、瘤质量、胸腺质量和脾质量,计算抑瘤率、胸腺指數和脾指数;流式细胞术检测脾脏淋巴细胞亚群水平;Western blot检测肿瘤组织血管内皮细胞生长因子受体(VEGFR)-1、VEGFR-2、p-p38、p-JNK的表达。结果 与模型组比较,各给药组小鼠瘤质量显著降低(P<0.01),组间差异无统计学意义(P>0.05),中药组和顺铂组抑瘤率分别为33.64%、46.53%,中药组胸腺指数、CD3+、CD4+、CD8+、CD4+/CD8+、B细胞水平均显著升高,VEGFR-2、p-JNK表达明显降低,顺铂组CD8+明显升高(P<0.05,P<0.01);与顺铂组比较,中药组胸腺指数、CD3+、CD4+、CD8+均显著升高,VEGFR-2、p-p38、p-JNK表达显著降低(P<0.05,P<0.01)。结论 二陈汤加沙参、麦冬可提高Lewis肺癌小鼠免疫功能,同时抑制肿瘤血管生成,其抗肿瘤作用机制可能与抑制VEGFR-2表达、降低p-JNK活性相关。
关键词:二陈汤;沙参;麦冬;Lewis肺癌小鼠;免疫功能;肿瘤血管生成;JNK通路;p38通路
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)08-0040-06
DOI:10.3969/j.issn.1005-5304.2019.08.009 开放科学(资源服务)标识码(OSID):
Abstract: Objective To investigate the effect of Erchen Decoction combined with Adenophora Stricta and Ophiopogonis Radix on immune function and tumor angiogenesis in Lewis lung cancer mice and to explore the possible mechanism of its anti-tumor action. Methods Totally thirty C57BL/6 mice were used to establish Lewis lung cancer model. They were randomly divided into model group, TCM group, and cisplatin group, with 10 mice in each group. The model group was given 0.4 mL/20 g normal saline by gastric lavage; TCM group was given 0.4 mL/20 g TCM solution by gastric lavage; the cisplatin group was given 3mg/kg cisplatin solution 200 μL/20 g byintraperitoneal injection once a day for 3 days, and 0.4 mL/20 g normal saline by gastric lavage once a day for 14 consecutive days. The weight of mice, tumor, thymus and spleen were measured, and the tumor inhibition rate, thymus index and spleen index were calculated. The level of lymphocyte subsets in spleen of mice was measured by flow cytometry. The protein expressions of VEGFR-1, VEGFR-2, p-p38 and p-JNK in tumor tissue were detected by Western blot method. Results Compared with the model group, the tumor weight of TCM group and cisplatin group decreased significantly (P<0.01), and there was no statistical significance between the two groups (P>0.05). The anti-tumor rates of TCM group and cisplatin group were 33.64% and 46.53%, respectively. The thymus index, CD3+ cells, CD4+ cells, CD8+ cells, CD4+/CD8+, and B cells in TCM group increased significantly (P<0.05, P<0.01), the expression of VEGFR-2 and p-JNK protein decreased significantly, and the level of CD8+ cells in the cisplatin group increased (P<0.05). Compared with the cisplatin group, the thymus index, CD3+ cells, CD4+ cells and CD8+ cells in TCM group increased significantly, and the expressions of VEGFR-2, p-p38 and p-JNK decreased significantly (P<0.05, P<0.01). Conclusion Erchen Decoction combined with Adenophora Stricta and Ophiopogonis Radix can improve the immune function of Lewis lung cancer mice and inhibit tumor angiogenesis. Its possible anti-tumor mechanism is to inhibit the expression of VEGFR-2 and reduce the activity of p-JNK.
Keywords: Erchen Decoction; Adenophora Stricta; Ophiopogonis Radix; Lewis lung cancer mice; immune function; tumor angiogenesis; JNK pathway; p38 pathway
肺癌是目前发病率和病死率最高的恶性肿瘤,中国每年新发病例约78.1万[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌發病的80%~85%,约57%的NSCLC患者最初诊断时已为进展期肺癌,已失去手术治愈的机会,尽管当今治疗手段多样,但进展期肺癌总生存期目前仍然较短[2]。二陈汤出自《太平惠民和剂局方》,是化痰的经典方剂,可显著提高NSCLC痰证患者的生活质量及T淋巴细胞亚群水平[3-4]。前期研究显示,二陈汤可降低肺癌A549细胞膜表面细胞黏附分子-1(intercellular adhesion molecular-1,ICAM-1)表达及p38活性,表明二陈汤可能是通过抑制p38通路而实现对ICAM-1表达的调控,从而抑制NSCLC细胞转移[5-6]。北京中医药大学东方医院王沛教授根据“肺为娇脏,喜润恶燥”的特点,主张针对肺癌应注重养阴润肺生津,其治疗肺癌80%以上处方加沙参、麦冬[7]。本实验在前期研究的基础上,以二陈汤加沙参、麦冬干预Lewis肺癌小鼠,观察其对Lewis肺癌小鼠免疫调节的影响,探讨其抗肿瘤的可能作用机制。
1 实验材料
1.1 动物及瘤株
SPF级C57BL/6小鼠30只,雄性,4~6周龄,体质量18~20 g,购自北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2014-0004。饲养于北京协和医学院药物研究所SPF级动物实验室,温度(23±2)℃,相对湿度(55±10)%,光照12 h,噪音<60 dB,自由摄食饮水。Lewis肺癌瘤株,中国医学科学院药物研究所提供。
1.2 药物
按照《太平惠民和剂局方》二陈汤的配伍比例及临床用药量确定组方(法半夏15 g,陈皮15 g,茯苓9 g,炙甘草6 g,生姜7 g,乌梅8 g,沙参20 g,麦冬15 g),饮片均为免煎颗粒,北京中医药大学东方医院颗粒药房配制,并根据人与动物给药剂量公式换算小鼠所需剂量[8],将各组颗粒剂按所需溶媒量溶解于去离子水中,制备溶液;注射用顺铂,10 mg/瓶,齐鲁制药(海南)有限公司,批号AA1A7030B。
1.3 主要试剂与仪器
RPMI1640培养液和小牛血清,美国 Gibco公司;RIPA组织/细胞裂解液、BCA蛋白浓度测定试剂盒、Tween-20,北京索莱宝科技有限公司;十二烷基磺酸钠(SDS)、过硫酸铵、聚丙烯酰胺、焦碳酸二乙酯、甘氨酸,美国Sigma公司;ECL超敏显色剂,北京普利莱公司;抗体,美国BD公司;辣根过氧化物酶标记山羊抗兔和山羊抗鼠二抗,中杉金桥生物技术有限公司。洁净工作台(HDLApparatus),CO2培养箱(美国Shellab公司),倒置显微镜(日本Olympus公司),FACSCalibur流式细胞仪(美国BD公司),5810R离心机(德国Eppendorf公司),光谱扫描多功能酶标仪(美国Pro-mega公司),电泳仪(美国BIO RAD公司)。
1.4 分组、造模及给药
取C57BL/6小鼠30只,另取对数生长期Lewis肺癌细胞,调整细胞浓度为1×107/mL,接种于C57BL/6小鼠右侧腋窝皮下,0.2 mL/只[9]。接种后第2日,将30只小鼠按随机数字表法分为模型组、中药组和顺铂组,每组10只。于接种造模后第2日开始给药,模型组给予0.4 mL/20 g生理盐水灌胃,每日1次,连续14 d;中药组给予0.4 mL/20 g药液灌胃,每日1次,连续14 d;顺铂组给予3 mg/kg顺铂溶液200 μL/20 g腹腔注射,每日1次,连续3 d,同时给予0.4 mL/20 g生理盐水灌胃,每日1次,连续14 d。接种后第5日,在小鼠右侧腋窝皮下可触及黄豆大小肿块,标志造模成功。
2 实验方法
2.1 一般观察
观察小鼠毛发、聚集、反应、进食量及死亡等情况,评价小鼠生存质量。
2.2 抑瘤率、胸腺指数和脾指数测定
第14日灌胃结束2 h后,脱颈处死小鼠。称定小鼠质量,完整剥离小鼠胸腺及肿瘤组织并称重,无菌条件剥离小鼠脾脏并称重。分别计算抑瘤率、胸腺指数和脾指数。抑瘤率(%)=(模型组平均瘤质量-给药组平均瘤质量)÷模型组平均瘤质量×100%,胸腺指数(mg/g)=胸腺质量(mg)÷体质量(g),脾指数(mg/g)=脾质量(mg)÷体质量(g)。
2.3 流式细胞术检测小鼠脾脏淋巴细胞亚群
小鼠脾淋巴细胞悬液制备:无菌取脾,用无菌注射器针头将脾脏划碎,转移至70 μm细胞筛网中,浸泡在含5%FBS RPMI1640中,用注射器塞轻轻研磨,直至组织全部通过筛网过滤,收集细胞至离心管中,300×g离心5 min,弃上清液,沿离心管壁缓慢加入3倍体积红细胞裂解液,冰上裂解5~10 min,300×g离心5 min,弃上清液,加含5%FBS RPMI1640重悬沉淀脾淋巴细胞,经培养基洗涤,300×g离心5 min,重复2次,最后用含5%FBS RPMI1640培养液重悬脾淋巴细胞,并将细胞浓度调至1×107/mL备用。吸取上述脾细胞悬液100 μL至流式管底,向流式管中加入FITC标记抗小鼠CD3单抗、PE标记抗小鼠CD8a单抗、PerCP-Cy5.5标记抗小鼠CD45单抗、APC标记抗小鼠CD4单抗、FITC标记抗小鼠CD19单抗、APC标记抗小鼠CD49b单抗,与细胞轻轻混匀,室温避光孵育20 min,加2 mL含1%FBS PBS,300×g离心5 min,弃上清液,再加入0.5 mL含1%FBS PBS重悬细胞,用FACS Calibur流式细胞仪,Cell Quest Pro软件获取细胞分析检测。
2.4 Western blot检测肿瘤组织血管内皮细胞生长因子受体-1、2和p-p38、p-JNK蛋白表达
常规匀浆、裂解、离心提取总蛋白,用BCA蛋白定量试剂盒测定蛋白量,并用组织裂解液将各样品调至相同浓度。进行SDS-PAGE电泳,将分离后的蛋白电转移到PVDF膜上,封闭液室温封闭2 h,分别加入1∶1000稀释的一抗,4 ℃孵育过夜。用TBST液洗膜3次,加辣根过氧化物酶标记的二抗室温孵育1 h。TBST液洗膜3次,加入化学发光底物反应液,ECL曝光成像。用Image J软件进行蛋白灰度分析。
3 统计学方法
采用SPSS21.0统计软件进行分析。计量资料以—x±s表示,组间比较采用方差分析或非參数检验,组间两两比较用LSD法。P<0.05表示差异有统计学意义。
4 结果
4.1 小鼠一般状况
接种第5日,小鼠右侧腋窝皮下触及黄豆粒大小肿块,第7日瘤体生长明显加快。随着瘤体的生长,各组均逐渐出现不同程度的毛发脱落、毛发缺少光泽、聚集、反应迟缓和进食量减少等现象。与模型组、顺铂组比较,中药组小鼠更具活力,一般状况优于模型组和顺铂组,生存质量相对较好。中药组于第5日1只小鼠死亡,考虑为灌胃不当,误入肺部导致窒息而死。
4.2 二陈汤加沙参、麦冬对模型小鼠抑瘤率的影响
与模型组比较,中药组和顺铂组小鼠瘤质量均显著降低(P<0.05,P<0.01);顺铂组与中药组比较小鼠瘤质量差异无统计学意义(P>0.05)。中药组和顺铂组抑瘤率分别为33.64%、46.53 %。结果见表1。
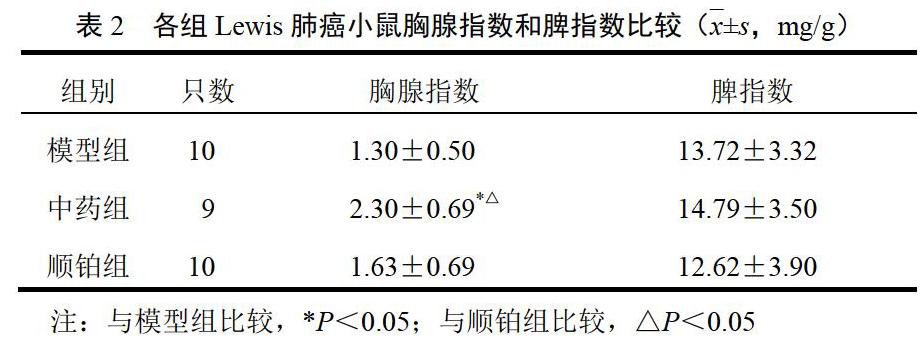
4.3 二陈汤加沙参、麦冬对模型小鼠胸腺指数、脾指数的影响
与模型组比较,中药组小鼠胸腺指数显著升高(P<0.05),脾指数差异无统计学意义(P>0.05);与顺铂组比较,中药组小鼠胸腺指数显著升高(P<0.05),脾指数差异无统计学意义(P>0.05)。结果见表2。
4.4 二陈汤加沙参、麦冬对模型小鼠脾脏淋巴细胞亚群的影响
与模型组比较,中药组小鼠CD3+细胞、CD4+细胞、CD8+细胞、CD4+/CD8+、B细胞水平均显著升高(P<0.05,P<0.01),NK细胞水平差异无统计学意义(P>0.05),顺铂组小鼠CD8+细胞水平升高(P<0.05);与顺铂组比较,中药组小鼠CD3+细胞、CD4+细胞、CD8+细胞水平均显著升高(P<0.05,P<0.01),CD4+/CD8+、B细胞及NK细胞水平差异无统计学意义(P>0.05)。结果见表3。
4.5 二陈汤加沙参、麦冬对模型小鼠血管内皮细胞生长因子受体-1、2和p-p38、p-JNK蛋白表达的影响
与模型组比较,中药组小鼠血管内皮细胞生长因子受体(VEGFR)-2、p-JNK蛋白表达显著降低(P<0.05),VEGFR-1、p-p38蛋白表达无明显变化(P>0.05);与顺铂组比较,中药组小鼠VEGFR-2、p-p38、p-JNK蛋白表达显著降低(P<0.05,P<0.01),VEGFR-1蛋白表达表达无明显变化(P>0.05)。结果见图1、图2。
5 讨论
二陈汤君以半夏,燥湿化痰、降逆和胃;臣以橘红,理气健脾;佐以茯苓入脾经,健脾渗湿;生姜助君臣降逆化痰和胃,佐制半夏之毒;乌梅敛肺气、止久嗽,使痰祛而正不伤;使以甘草调和诸药,健脾益气和中。沙参和麦冬是王沛教授临床常应用于肺癌治疗的两味中药,有养阴润肺生津功效。现代药理研究表明,沙参不但在免疫调节方面发挥着重要的作用,同时还在抗肿瘤方面疗效显著[10];麦冬有增强免疫功能、抗炎、抗肿瘤等作用[11]。
免疫功能低下或失调是恶性肿瘤发生的基础因素。脾脏和胸腺是人体重要的免疫器官,是T淋巴细胞成熟、增殖和分化的主要部位,其脏器指数可作为衡量机体非特异性免疫功能的指标之一[12]。细胞免疫是由T淋巴细胞介导的,T淋巴细胞亚群分析对判断机体免疫功能具有重要作用。CD3+T细胞代表总T细胞水平,反映机体总的细胞免疫状态。根据其表面标志物,T淋巴细胞通常分为CD4+T和CD8+T淋巴细胞亚群[13]。一般认为,CD4+T淋巴细胞可提高免疫,CD8+T淋巴细胞则有抑制作用。CD4+T与CD8+T淋巴细胞数量相互调整以维持动态平衡,免疫功能处于稳定状态,当其下降甚至倒置时,机体免疫功能处于抑制状态[14]。体液免疫由B淋巴细胞介导,在机体受到抗原刺激后,B细胞可分化为浆细胞,合成和分泌抗体,在体液免疫中发挥作用。Sorrentino等[15]研究发现,与对照组比较,在缺乏B细胞的肺癌鼠模型中,肿瘤生长速度加快。NK细胞又称自然杀伤细胞,不需要预先接触抗原,不依赖胸腺、抗体或补体,可直接发挥抗肿瘤效应,是抵抗肿瘤生长的第一道防线。赵辉等[16]研究发现,NSCLC患者外周血中NK细胞含量显著降低,且造成癌细胞增殖活力增强、血清中肿瘤标志物含量升高。
肿瘤血管生成是肿瘤快速生长、转移的关键环节,其病理过程受多方面因素影响。血管内皮生长因子(VEGF)是目前研究发现的肿瘤血管新生过程的主要驱动因子。VEGFR是VEGF发挥生物学作用的门户,VEGFR-1和VEGFR-2主要表达于血管内皮细胞,是VEGF家族成员主要结合的两种受体[17]。研究表明,VEGFR-1和VEGFR-2表达降低代表肿瘤新生血管受到抑制[18-20]。近年研究表明,多种细胞因子均参与了NSCLC的发生、发展[21-22]。MAPK通路是真核生物信号传递网络中的重要途径之一,在肿瘤的发生发展中具有重要的作用。JNK与p38是MAPK通路的两大主要成员[23],在受到细胞因子等多种刺激因素刺激后,JNK被激活磷酸化进而增强c-Jun的转录活性,从而调节下游凋亡相关靶基因的转录和凋亡蛋白的表达发挥相应的生物学效应[24]。p38是丝氨酸/苏氨酸激酶高度相关的蛋白激酶超家族,是细胞内重要的信号转导系统之一,存在于大多数细胞内[25]。p38与JNK一样,均属应激活化蛋白激酶。据报道,在多种肿瘤中观察到JNK与p38活性升高[21,26-28],而抑制JNK与p38通路可抑制肿瘤生长、促进肿瘤细胞凋亡,提示JNK与p38通路激活可能与肿瘤发生与增殖、转移有关[29-31]。有文献报道,蜂毒穴位注射对肿瘤血管的抑制作用可能是通过抑制JNK信号通路的表达实现的[32],芹菜素抑制血管生成的作用可能与下调p-p38蛋白有关[33]。
本研究结果显示,中药组Lewis肺癌小鼠生存质量优于模型组和顺铂组,且二陈汤加沙参、麦冬可提高Lewis肺癌小鼠胸腺指数、CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、CD4+/CD8+及B细胞水平,提示二陈汤加沙参、麦冬能提高小鼠免疫功能。但本研究用药时间较短,而免疫治疗的优势在长期用药过程中更能体现,若能增加用药时间,可能会取得更好的疗效。与顺铂组比较,中药组胸腺指数及T淋巴细胞亚群水平均显著升高,但抑瘤率低于顺铂组,提示其较传统化疗药物在提高Lewis肺癌小鼠免疫功能方面更有优势,但在降低瘤体质量方面不及顺铂。在下一阶段实验中,我们将对肿瘤体积和瘤体质量变化进行动态观察,以完善抗肿瘤研究的观察指标。综合来看,二陈汤加沙参、麦冬可提高Lewis肺癌小鼠免疫功能,从而增强自身抗肿瘤能力,发挥抗肿瘤作用。本研究发现二陈汤加沙参、麦冬可降低肿瘤组织VEGFR-2蛋白的表达,说明其对肿瘤血管生成有一定的抑制作用,且在抑制VEGFR-2的同时可显著降低肿瘤组织p-JNK蛋白表达,提示其可能是通过抑制JNK磷酸化这一途径发挥抗肿瘤血管生成作用的;同时,其p-p38蛋白表达有下降趋势,且较顺铂组差异有统计学意义,提示二陈汤加沙参、麦冬可能对p38通路也有一定的作用,但有待在扩大样本量和重复次数的基础上进一步深入研究。本研究未设置二陈汤加沙参、麦冬不同剂量组及二陈汤原方组,未能探讨其抗肿瘤作用是否具有量效关系及其与二陈汤原方抗肿瘤作用的差异,这是我们今后研究的重点之一。
综上,二陈汤加沙参、麦冬具有提高Lewis肺癌小鼠免疫功能和抗肿瘤血管生成作用,抑制VEGFR-2表达、降低p-JNK活性可能是其抗肿瘤作用的机制。
参考文献:
[1] 陈万青,孙可欣,郑荣寿,等.2014年中国分地区恶性肿瘤发病和死亡分析[J].中国肿瘤,2018,27(1):1-14.
[2] SIEGEL R L,MILLER K D, JEMAL A. Cancer ststistics,2016[J]. CA Cancer J Clin,2016,66(1):7-30.
[3] 张海燕,王芬,曹阳,等.二陈汤对晚期非小细胞肺癌痰证患者生活质量的影响[J].中国中医基础医学杂志,2015,21(6):700-701.
[4] 张海燕,王芬,李金泽,等.二陈汤对晚期非小细胞肺癌痰证患者免疫功能的影响[C]//海峡两岸医药卫生交流协会,首届两岸四地中医药循证高峰论坛论文集,北京,2015:194-199.
[5] 王芬,胡凯文,肖俐,等.二陈汤对CAM-1高表达肺癌A549细胞的影响[J].中国中医基础医学杂志,2010,16(12):1126-1127.
[6] 王芬,胡凱文,左明焕,等.二陈汤对肺癌A549细胞中黏附分子-1和 p38表达的影响[J].中国中医药信息杂志,2012,19(8):41-43.
[7] 胡凯文,左明焕,肖俐,等.王沛治疗肺癌用药经验[J].中国中医基础医学杂志,2010,16(9):783-784,786.
[8] 温瑞兴,肖向茜.药理学实验教程[M].北京:北京工业大学出版社, 2014:396-397.
[9] 李斐斐,吴皓,陈露,等.益肺清化颗粒对Lewis肺癌小鼠血管内皮细胞生长因子及其受体的影响[J].中国中医药信息杂志,2013,20(12):29- 31.
[10] 李蒙,陈燕平,韩笑,等.北沙参研究进展[J].食品与药品,2018, 20(3):247-252.
[11] 彭婉,马骁,王建,等.麦冬化学成分及药理作用研究进展[J].中草药,2018,49(2):477-488.
[12] GONG Y, WU J, LI S T. Immuno-enhancement effects of Lycium ruthenicum Murr. polysaccharide on cyclophosphamide-induced immunosuppression in mice[J]. Int J Clin Exp Med,2015,8(11): 20631-20637.
[13] 王慧娟,王永杰,王湘雨.CD4+/CD8+、NK细胞、TNF-α、IL-1β及IL-6水平对职业性尘肺病中医辨证分型的影响[J].中医学报,2018,33(5): 725-728.
[14] 周建光,杨梅,曹海涛,等.淋巴细胞亚群的检测在临床的应用[J].东南国防医药,2015,17(3):298-300,321.
[15] SORRENTINO R, MORELLO S, FORTE G, et al. B cells contribute to the antitumor activity of CpG-oligodeoxynucleotide in a mouse model of metastatic lung carcinoma[J]. Am J Respir Crit Care Med, 2011,183:1369-1379.
[16] 赵辉,李晓松,陈殿君,等.非小细胞肺癌患者外周血NK细胞含量与肿瘤标志物含量、增殖分子表达量的相关性研究[J].海南医学院学报, 2017,23(8):1099-1101,1105.
[17] BRY M, KIVEL? R, LEPP?NEN V M, et al. Vascular endothelial growth factor-B in physiology and diease[J]. Physiol Rev,2014, 94(3):779-794.
[18] 金彤,陈莉媚,宁春桃,等.加味四君子汤对H22荷瘤小鼠移植瘤血管生成的影响[J].中国实验方剂学杂志,2019,25(10):1-7.
[19] 闫春燕,刘辉,朱荣芹,等.茶氨酸衍生物茶溴香酰胺脂质体对人肺癌细胞生长和迁移的抑制作用[J].安徽农业大学学报,2018,45(1):15-24.
[20] 钱晓涛,赵腊梅,范俊求,等.晚期非小细胞肺癌VEGF/VEGFR通路抗血管生成治疗的研究进展[J].中国癌症防治杂志,2017,9(6):506-511.
[21] 李洋,于奇.RAGE、P-P38在非小细胞肺癌中的表达及相关性研究[J].临床肺科杂志,2016,21(5):862-865.
[22] 赵华,陈莹蓉,宋鹏涛,等.miR-4286与AEG-1在非小细胞肺癌组织中的表达及临床意义[J].浙江医学,2018,40(22):2427-2430,2401.
[23] JI R R, GEREAU R W, MALCANGIO M, et al. MAP Kinase and pain[J]. Brain Res Rev,2009,60(1):135-148.
[24] WANG J, TAI G X. Role of C-Jun N-terminalkinase in hepatocellular carcinoma deveploment[J]. Targeted Oncology, 2016,11(6):723-738.
[25] OBATA T, BROWN G E, YAFFE M B. MAP kinase pathways activated by stress:the p38 MAPK pathway[J]. Crit Care Med,2000,28(4):67-77.
[26] 杜昌国,王健,孙茂坤,等.P38与JNK在肾透明细胞癌中的表达及其临床意义[J].现代医药卫生,2011,27(16):2405-2407.
[27] 赵杰,陈振栋.ERK和JNK在胃癌中的表达[J].黑龙江医药科学, 2018,41(1):35-38.
[28] 王明晖,王绍清,赵凤姿,等.非小细胞肺癌中JNK的表达及意义[J].中国卫生产业,2012,9(28):140.
[29] VASUDHA S, PRAHLAD T R. Network motifs in JNK signaling, Genes[J]. Cancer,2013,4(9/10):409-413.
[30] 黄川,袁铿.JNK、p38MAPK信号通路与肿瘤细胞凋亡[J].实验与检验医学,2012,30(5):447-452.
[31] LIU Y Z, YANG C M, CHEN J Y, et al. Alpha-carotene inhibits metastasis in Lewis lung carcinoma in vitro, and suppresses lung metastasis and tumor growth in combination with taxol in tumor xenografted C57BL/6 mice[J]. J Nutr Biochem,2015,26(6):607-615.
[32] 容國义,王淑美.基于JNK信号通路的蜂毒穴位注射抑制Lewis小鼠肺癌肿瘤血管生成[J].中药材,2016,39(12):2850-2854.
[33] 徐红涛,韩中保,张慧丽,等.芹菜素对A375黑色素瘤生长、迁移和血管生成的影响及其作用机制[J].中国现代医学杂志,2016,26(1):46- 51.
(收稿日期:2019-01-26)
(修回日期:2019-02-27;编辑:华强)

