磁共振成像在评价肝癌射频消融术疗效中的应用及其相应影像学特征分析
李齐云,马东东,张珍珍
1.上海国际医学中心影像中心(上海200210);2.安徽省亳州市人民医院影像中心(亳州236800)
一直以来,肝癌(HCC)发病率及死亡率位居恶性肿瘤前5位,每年约有60万人死于肝癌[1-2]。肝癌射频消融治疗术(Radiofrequency ablation,RFA)为临床局部治疗靶区癌变组织的最有效方法,因具有微创、安全性好、副作用少等优点目前已成为临床首选治疗方式。其主要借助超声、CT或MRI等影像学方法进行引导,通过物理消融方法,利用10kHz以上的高频电流使活体组织中组织离子随电流方向的变化产生物理震动,进而通过产生的热量引起组织凝固性坏死,其5年生存率与开腹手术相近[3],但由于技术条件受限其常会由于不完全消融导致肿瘤无法完全消除,仍有局部进展的可能。因此进行RFA治疗后,临床CT或MRI动态增强进行随访仍有重要的意义。
资料与方法
1 一般资料 收集2013年1月至2017年12月于本院及安徽省亳州市人民医院收治的行射频消融治疗患者75例,男41例,女34例,年龄55~72岁,平均(59.1±6.9)岁;Eggel分型为:巨块型35例,结节型21例,弥漫型19例。上腹部闷痛、黄疸、乏力或食欲减退等临床症状发现患病52例,常规体检发现23例。实验室检查HBsAg升高患者75例,AFP升高患者73例,CEA升高患者21例。原发性肝癌52例,转移性肝癌23例(乳腺癌转移10例,结肠癌转移9例,直肠癌转移4例)。患者于首次进行射频消融术前2 d进行MRI检查,术后1、3、6、12个月随访复查。
2 治疗方法 射频消融治疗根据肿瘤大小采用相应规格的射频针(RITA 1500×多级射频),通过CT(西门子双源螺旋CT)定位穿刺的角度及深度后,采用静脉镇静(或长时间手术采用全身麻醉)结合穿刺点2%利多卡因局部麻醉后经皮经肝穿刺。穿刺进针后重复CT扫描,观察穿刺针与肝脏之间的位置关系,避开大血管、肝胆管及重要脏器,继续进针至瘤体内部近侧,再次复查CT,射频针定位后由大至小逐步展针,超出肿瘤范围1 cm左右正常肝组织,退针时消融。
3 仪器与检查方法 消融术后,采用西门子3.0T超导型MRI进行平扫及动态增强扫描。患者检查前常规禁食禁水6 h。扫描前对患者进行呼吸训练,扫描过程中指导检查者闭气。平扫序列为横断位T1WI(SE序列,TR109ms,TE4.76ms,矩阵384×512,FOV263×350 mm)及T2WI(快速自旋回波序列,TR1500ms,TE100ms,矩阵480×640,FOV263×350 mm;轴位脂肪移植序列,TR1500ms,TE100ms,矩阵480×640,FOV263×350mm),DWI(扩散加权成像)。增强扫描采用高压注射器经肘部静脉注入对比剂(钆喷酸葡胺注射液2ml/s,0.15mmol/kg);三维容积内插快速扰相GRE T1WI(VIBE)行三期动态扫描,在22 s、55 s、3 min行动脉期、门静脉期和平衡期动态扫描,层厚3~5 mm,无间隔。
4 研究方法 所有影响资料依托Syngo工作站展开,选取2名有10年以上独立阅片经验的诊断医师对所有MR平扫及增强扫描图像、DWI序列图及ADC值进行独立分析,对各影像学资料中的组织显影信号进行判读。避开坏死区域选择病灶实质信号均匀一致的地方作为ROI(兴趣区)进行测量,相同部位连续层面选取3层ROI,其平均值即作为病灶实质ADC值;避开坏死区、周围血管及肝、胆管结构,相同部位连续层面选取3层ROI,其平均值记为过渡区ADC值;除去周围血管、肝胆管,相同部位连续选取3层,测定平均值为正常肝脏ADC值。
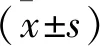
结 果
1 MRI表现 术后扫描RFA区域可见完整环形T1WI高信号改变,术后96.23%病灶较术前增大,术后12个月90.57%的病灶缩小。复发患者表现为T1、T2长改变,DWI信号为高强度信号,增强扫描发现为结节样增强。见表1(图1)。
2 术后12个月复发情况 术后1个月T1WI高信号环完整共100个病灶,术后12个月15个病灶复发,复发率为15%;高信号环不完整共6个病灶,复发率为66.67%,两者比较差异有统计学意义(P<0.05)。见表2(图1)。

表175例患者106个病灶变化情况(病灶数)

表2术后1个月T1WI高信号环完整情况(病灶数)
3 治疗后ADC值变化 治疗前病灶区ADC平均值最小,正常区ADC值最大,三个位置ADC值比较差异均有统计学意义(P<0.05),治疗后,三个位置ADC值略有差异,但差异无统计学意义(P>0.05),见表3。对于边缘残留及复发病灶与完全消融过渡区、正常肝脏组织、消融坏死病灶的ADC值比较发现,边缘残留及复发病灶ADC值均有下降,差异有统计学意义(P<0.05),见表4(图1)。

表3射频消融前后不同部位ADC值比较(×10-6/mm2)

表4边缘复发病例的ADC值比较(×10-6/mm2)
讨 论
射频消融技术作为医学常用非手术治疗手段,从20世纪初开始应用于临床,一直以来在小肝癌治疗方面效果显著,同时能够提高患者5年生存率,并延长患者存活时间。RFA主要通过一定频率的电磁波产生局部高温,在超声或CT引导下,通过插入瘤体内的电极发热,凝固瘤体及周围临近组织。由于RFA具有良好的靶向性,能够直接作用于肿瘤细胞,针对中晚期肿瘤患者具有一定的治疗意义。特别对于小肝癌的治疗有较好的效果,有报道称,直径在3 cm以下的小肝癌通过RFA完全消融率可达93%。
MRI技术具有无创伤、无辐射等副作用,对人体组织分辨率高[4],能够通过T1WI、T2WI、动态增强及扩散加权成像(DWI)等方式作为肝癌的确定性诊断及术后随访的有效手段,目前普通影像学技术难以对术后再生结节与复发肝癌进行有效鉴别诊断,但MRI技术的应用对肝癌的早期诊断及预后检测有着重要的应用价值,其组织分辨能力及敏感度可达90%以上。肝癌的MRI表现为T2WI部分或全部高信号、T1WI低信号,但不具有特异性,临床上加扫DW序列及动态增强扫描进行鉴别诊断。在进行动态增强扫描影像学表现与肿瘤的血供方式密切相关,其时间-信号曲线表现为速升速降型,易与肝内占位性良性病变进行鉴别,针对不同分型的肝癌血供型均具有特殊的信号表现,肝癌的具体分型能够通过MRI动态增强扫描进行确定。因此,在肝癌的治疗后疗效确诊方面,动态增强扫描具有一定的临床意义,同时能够对残留瘤体及复发肿瘤进行有效诊断。
动态增强扫描虽然能够有效进行肝癌病灶确定性诊断,但对于过敏体质和肾功能不全的患者有一定局限性。而DWI技术受血供的影响较小,在肝癌检查中具有较高的敏感性;利用测定表观弥散系数(ADC)值,可在不使用对比剂的情况下定性或定量评估组织细胞中的水分子扩散信息,从而寻找出发生病变的组织细胞。DWI则是通过自旋转回波T2加权序列中施加一对梯度脉冲,进而通过不同的梯度敏感因子获得DWI序列信号值,从而计算组织ADC。而恶性肿瘤细胞生长较为活跃,细胞繁殖能力强,相对正常组织而言,细胞密度总体偏高,肿瘤内部水分子运动较为局限,扩散作用不明显,因此随着肿瘤恶性程度的增加ADC值显著降低。通过DWI影像结合ADC值能够从微观对肝脏肿瘤进行描述,同时不同位置及恶性程度的不同ADC值也有差别,临床上已逐步通过病变组织的ADC值对肝脏占位性病变进行确定性诊断[5-6]。同时在RFA术后进行随访过程中,通过DWI观察消融灶形态,计算ADC值定量确定消融灶组织成分,消融后病灶的组织T2WI信号与ADC值随b值的增加而减少,消融性坏死组织信号最低、ADC值最小,肝脏正常组织信号最高,新生肉芽组织ADC值最大,因此,RFA治疗后ADC值、DWI信号越高证明治疗效果越显著。
研究在RFA术后1、3、6、12个月分别进行随访并收集影像学资料可以看出,术后1个月由于消融区范围超过病灶本身周围0.5 cm左右,102个病灶显示较术前增大,因高温损伤细胞致脱水、凝固坏死,其MRI表现为病灶周边环形T1WI高信号,病灶区增强扫描DWI并无高信号改变,并且由于病灶内液化、坏死、出血等情况存在[7],信号呈现复杂样。 12个月随访时,96个病灶缩小,病灶周边血管炎症反应及肉芽组织增生[8-9],动态增强扫描可看出病灶部位环形薄层强化。
研究结果表明,RFA治疗随访中,T1WI高信号环不完整的6个复发病灶中,复发部分存在于T1WI高信号环缺失处,肿瘤复发与T1WI高信号环的完整程度呈正相关,此时由于高信号缺失处肿瘤细胞仍有残留,MRI表现RFA术后边缘不规则结节样,长T1/T2信号改变,DWI高信号,动脉期显著强化,对于RFA术后残留或复发病灶,通过12个月随访复查及影像学资料分析,肿瘤残留或复发多数位于原病灶的边缘部分,即为T1WI高信号环不完整区域,其 T1WI 信号低于消融坏死灶,尤其在 RFA 术后的边缘出现稍长 T2信号往往提示复发,门静脉期和延迟期相对低信号,动态增强扫描可见“快进快出”,随着随访时间延长复发病灶范围会增大,复发时间多为术后5个月;而射频消融术导致的炎症反应表现为逐渐强化,长期随访逐渐消散。虽然研究中100个T1WI高信号环完整的病灶中仍有15个复发,可能由于周围组织再生性恶变结节累及,并非原病灶RFA施术不彻底。与明韦迪[10]相关研究结果一致。因此T1WI高信号环完整与否与患者RFA术后复发情况呈正相关,表明MRI在肝癌RFA术后随访的应用意义。也有学者认为复发灶的“快进慢出”型表现与典型肝癌的影像学表现略有不同,研究证实与患者肝静脉受损回流受阻有直接关系,主要由于大血管血流流速较快,毗邻区病灶消融针温度降低,可能在RFA时造成病灶消融不彻底, RFA术后“热沉降”效应[11],研究中5个复发灶动态增强扫描表现为持续强化。
通过全面分析所有纳入研究病例病理学资料,结合影像学表现,RFA术前的病灶T1WI低信号,T2WI稍高信号,部分病灶液化坏死区域为较高信号;其中病灶位于肝动脉供血区域的动脉期结节状强化,门静脉期信号下降,平衡期表现相对其余肝组织为低信号;另由于门静脉参加供血,5个病灶门静脉期强化。
研究发现,RFA术前病灶细胞密集或核浆比率高、自由水活动受限,DWI序列均呈现高信号,ADC图显示低信号区,治疗前病灶及边缘部位、病灶以远肝脏组织的ADC值逐渐增加,且差异有统计学意义;术后,由于消融灶成分复杂,部分病灶液化坏死灶或炎性反应,DWI 信号仍呈现高信号,因此单纯的 DWI 图像对于鉴别残留或复发带来困难。但是通过ADC值发现,完全消融灶、过渡部位、正常肝脏组织三部位的 ADC 值虽略有差异,但相比较差异无统计学意义;而在治疗前后消融灶及其过渡部位的 ADC 值与治疗前相比差异均有统计学意义;边缘残留及复发病灶的 ADC 值与复发前相应区域、坏死区、正常肝脏组织相比均有下降结果与DSA影像学提示相符。因此,ADC 值的定量有助于射频消融术后疗效的评估。
本研究样本量较为单一。DWI图像上信号变化的判断仍需年资较长的影像学医师进行辨认,可能存在一定的误差。由于 ADC 图病灶的边缘部分清晰度欠佳,选择 ROI 时有可能不够准确,ADC值计算可能产生误差。RFA术后患者很少进行有创伤的病理检查,因此无法证实肝脏组织成分是否与研究相符,只能通过 DSA或长期随访观察病灶的信号及范围。
综上所述,核磁共振技术组织分辨率高,多序列、多方位成像,获得的诊断信息丰富。MRI结合DWI及ADC值的测量能够更加准确定性原发性肝癌,辨别残留、复发的肿瘤组织,为临床治疗提供有效支持。

