长链非编码RNA-ATB在胶质瘤中的表达水平和临床意义
罗国强,秦彦昌,张百平,于庆伟
空军军医大学第二附属医院神经外科(西安710038 )
神经胶质瘤是由星形胶质细胞或星形胶质前体细胞引起的一种中枢神经系统最常见的原发性脑瘤,每年的发病率约为4.5/10万[1]。近年来,尽管随着研究发展,针对胶质瘤发生发展的生物学和分子基础已经进行了大量验证,肿瘤诊断和治疗方面也取得了巨大进展,但胶质瘤患者的预后仍然不佳。其中低级别胶质瘤患者5年生存率为30%~70%,而恶性程度最高的胶质母细胞瘤患者的中位生存时间仅为9~12个月,5年存活率低于3%。因此,应进一步研究胶质瘤的临床诊疗方法,探索新的危险因素和分子标志物、开发新的治疗靶点,已改善是神经胶质瘤患者的临床预后。长链非编码RNA (Long non-coding RNA,lncRNA)曾经被认为是一类碱基长度大于200 bp而无编码蛋白质功能的RNA,但新的研究发现,lncRNA通过其可以调节基因表达、调控染色质重组的特点,在多种类型的恶性肿瘤发生发展过程中发挥致癌或抑癌的作用[2]。特别是许多lncRNA的异常表达可能在神经胶质瘤中发挥重要作用,如XIST在神经胶质瘤组织的表达水平显著升高,可作为预测患者预后的独立危险因素[3];MEG3可降低胶质瘤细胞的活力并促进其凋亡[4]。lncRNA-ATB是首个发现能被转化生长因子激活的lncRNA,其在肝癌[5]、肺腺癌[6]、结肠癌[7]等多种肿瘤中表达水平异常。然而,目前尚无探究ATB与神经胶质瘤患者预后之间关系的报道。因此,本研究的目的是研究ATB在胶质瘤和正常脑组织中的表达,分析ATB与脑胶质瘤患者预后的关系。
对象与方法
1 研究对象 收集2007-2013年在空军军医大学唐都医院神经外科62例手术切除且术后确诊的胶质瘤组织样品进行qRT- PCR检测。将切除的组织标本分为两部分:一部分用于组织病理学诊断,另一部分保存在液氮中,用于RNA提取。本研究共纳入男性患者36例和女性患者26例,年龄34~75岁,中位年龄51岁。以上肿瘤组织标本中WHO I级8例,WHO II级14例,WHO III级18例,WHO IV级22例。所有患者术前均未接受化疗或放疗等抗肿瘤治疗,且具有完整的临床随访。此外,自因脑损伤和脑出血而进行手术的患者中取16份正常脑组织标本作为对照,其中男11例,女5例,年龄29~47岁,中位年龄36岁。
2 实验方法 采用TRIzol试剂(Invitrogen,CA,USA)按说明书从胶质瘤组织及正常脑组织中提取总RNA。采紫外分光光度计检测所有RNA样品的浓度和纯度,OD 260/280在1.9~2.0范围内为合格。应用qRT-PCR法配置逆转录反应体系。然后采用2-△△Ct法分析qRT-PCR所得结数据,计算神经胶质瘤组织和正常脑组织中ATB的表达水平,所有实验至少重复3次。
结 果
1 ATB在胶质瘤组织中的表达水平 使用qRT-PCR检测了所有胶质瘤组织和正常脑组织中ATB的表达(图1)。与正常脑组织相比,肿瘤组织ATB的表达水平明显升高[正常脑组织(0.88±0.26)、胶质瘤组织(2.84±0.28)P<0.01]。此外ATB在恶性程度高的胶质瘤中的表达水平中显著高于恶性程度低的胶质瘤组织,这提示ATB的表达与胶质瘤恶性程度呈正相关[WHO I~II(2.17±0.29) 、WHO III~IV(3.51±0.30)P<0.01]。
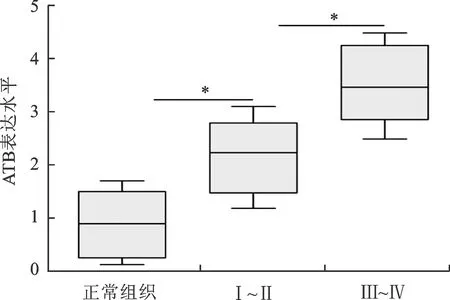
图1 lncRNA-ATB在癌旁正常脑组织和胶质瘤I~II期、III~IV期中的表达水平
2 ATB表达水平与胶质瘤患者临床预后的关系 我们回顾了62例胶质瘤患者的详细临床资料,采用Kaplan-Meier法和Log-rank检验评价低表达组和高表达组患者术后5年生存率的差异。生存分析的结果显示:神经胶质瘤患者ATB高表达组患者预后较差,5年生存率明显低于ATB低表达组(图2),差异具有统计学意义(P=0.002)。
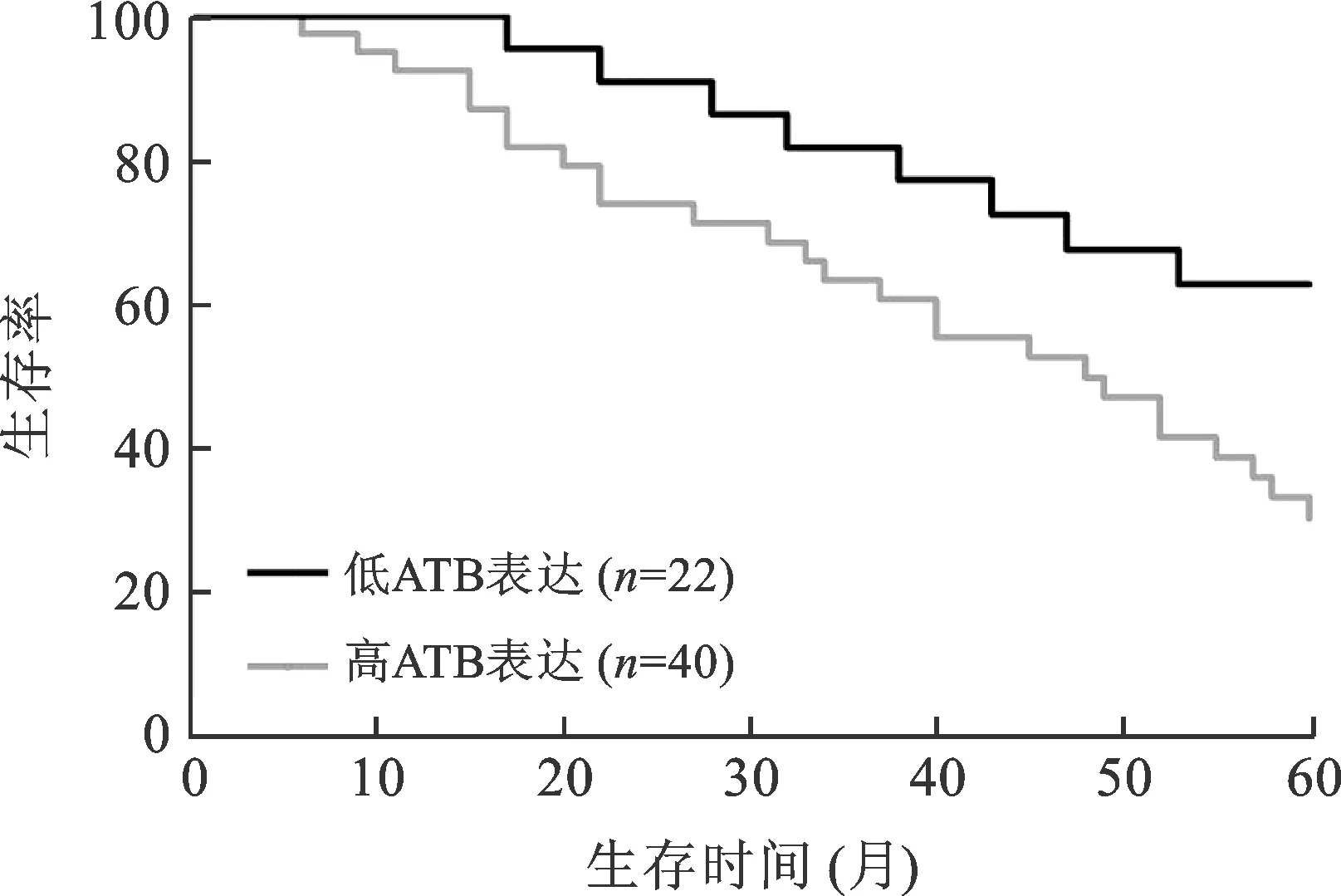
图2 lncRNA-ATB高表达组和低表达组患者术后生存率比较
3 胶质瘤患者不同临床病理指标单因素和多因素分析 见表1。采用单因素和多因素COX比例风险回归分析评价ATB的表达水平和各种临床病理特征是否为胶质瘤患者的独立预后危险因素。多因素分析结果显示,高ATB表达水平(P<0.01)、高WHO分级(P<0.01)、淋巴结转移(P<0.01)、KPS评分<80分(P<0.01)均为影响胶质瘤患者预后的独立危险因素。
讨 论
胶质瘤,尤其是胶质母细胞瘤,是人类最具破坏性的神经系统肿瘤[8]。尽管近年来肿瘤的诊断和治疗取得了巨大的进展,但由于胶质瘤细胞增殖迅速,仅靠手术切除难以根治,患者术后极易复发,导致胶质瘤患者的临床预后仍较差[9]。因此,探索可早期诊断胶质瘤并准确预测胶质瘤预后,确定神经胶质瘤的潜在治疗靶点和预后指标具有重要临床意义。为此越来越多的研究者把目光放在了非编码RNA上。
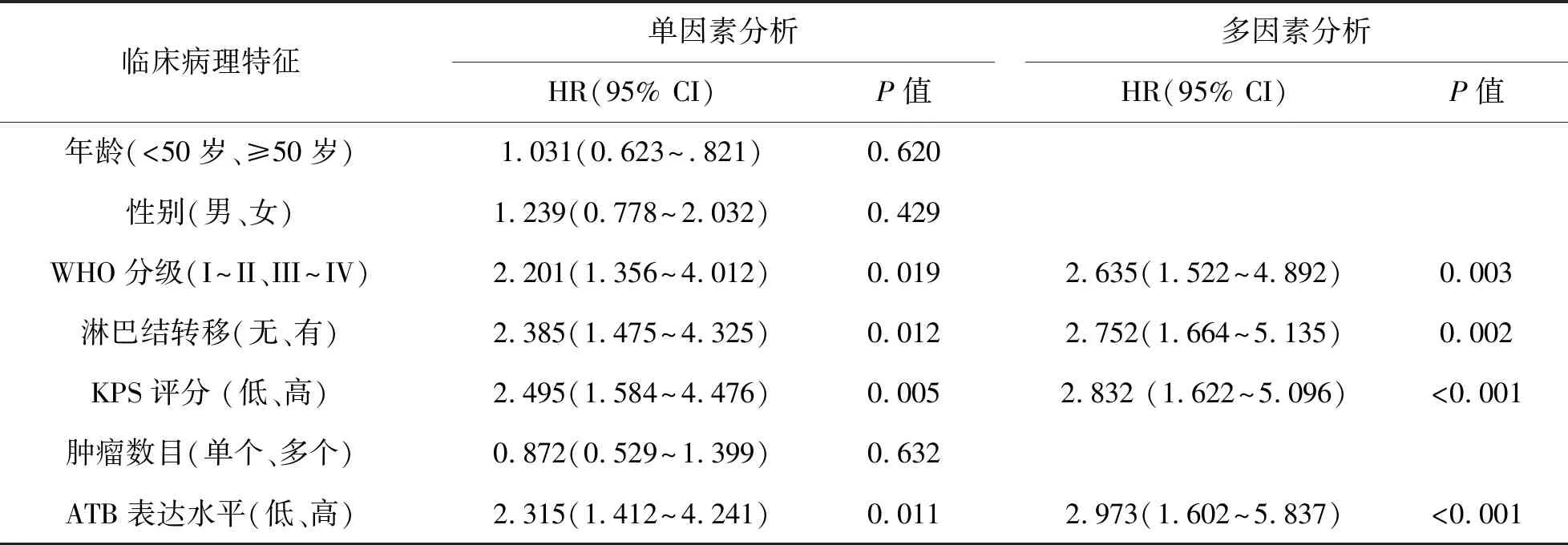
表1胶质瘤患者不同临床病理指标单因素和多因素分析
注:KPS,卡氏行为状态评分;HR,风险比;CI,置信区间
lncRNA已经被证实具有多种信号转导调控功能,以此影响肿瘤的发生发展中的多个环节[10],例如:非小细胞肺癌患者血清中lncRNA H19的表达水平增高,lncRNA H19可能参与了非小细胞肺癌的病理过程[11];UCA1在膀胱癌中的表达水平明显著提升,并且负向调节miRNA-99b的表达发挥作用[12]。同样在神经胶质瘤中,研究发现也存在多种lncRNA表达异常,例如:PVT1在神经胶质瘤中表达量高于正常脑组织,高PVT1提示胶质瘤患者的不良预后[13];UCA1的表达水平在胶质瘤组织中显著增高,且与胶质瘤患者的WHO分级明显相关[14]。
本研究中,我们通过qRT-PCR检测了不同WHO分级的胶质瘤组织中lncRNA-ATB的表达,判断其表达量与胶质瘤患者预后关系。ATB作为一种新发现的非编码RNA明星分子,受到研究者的广泛关注。先前的研究表明,ATB在多种肿瘤中表达异常并且发挥着重要的调节作用,例如:ATB在膀胱癌中呈高表达状态,可以作为预测患者预后的独立危险因素[15];宫颈癌患者的ATB表达明显上调,并且高表达的ATB可以促进宫颈癌侵袭转移[16];肾细胞癌中,ATB高表达的患者5年生存率明显下降,暗示高ATB表达预示肾细胞癌患者预后不良[17]。Chun等[18]还研究发现ATB在胶质瘤中的作用机制:在胶质瘤组织中表达水平上调的ATB通过抑制mir-200a进而促进TGF-β2表达,从而促进神经胶质瘤发生发展。本研究是首次探讨ATB在胶质瘤中的临床预后价值。
研究发现:ATB在胶质瘤组织中表达水平显著上调,且高级别胶质瘤组织(III级和IV级)的ATB表达水平远高于低级别胶质瘤组织(I~II级),提示ATB的表达水平与胶质瘤的恶性程度呈正相关。然后,我们进一步探讨了ATB表达与胶质瘤患者预后的关系。根据Kaplan-Meier分析结果,我们发现ATB高表达的胶质瘤患者五年生存率显著于低ATB低表达者,这表明ATB表达水平和胶质瘤患者预后具有相关性。最后进行单因素和多因素分析,结果表明,高ATB表达、高WHO分级、低KPS评分和淋巴结转移是影响神经胶质瘤患者预后独立危险因素,暗示ATB的表达能够成为胶质瘤患者预后诊断的独立指标。
综上所述,高表达的ATB在神经胶质瘤组织中高表达,并且和不良预后显著相关。ATB有望成为评价胶质瘤预后以及指导早期诊疗的新型标记物。

