H9N2亚型禽流感病毒冷适应株的培育及SPF鸡胚感染后的免疫应答分析
马鑫鑫,崔 宁,历成海,黄庆华,梁立生,杨少华,赵孝民,许传田*
(1.山东农业大学动物科技学院,山东泰安 271018;2.山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室,山东济南250100;3.山东日照东港区南湖镇畜牧兽医站,山东日照276817)
H9N2亚型禽流感病毒(Avian influenza virus,AIV)属于低致病性,但能引起家禽较为严重的疫病,特别是混合感染会导致较高的死亡率。H9N2 AIV又能作为其它亚型流感病毒的供体,形成新的重组病毒[1-2]。目前国内防控H9N2 AIV主要措施是接种疫苗,由于没有活疫苗,仅仅接种H9N2 AIV灭活疫苗的家禽临床保护效果不理想,因此研制一种高效的H9N2禽流感疫苗显得尤为重要[3]。
冷适应是一种较为安全的致弱方法,既保留良好的抗原性,又刺激机体产生粘膜免疫、细胞免疫和体液免疫[4],但是关于冷适应疫苗的免疫保护机制尚不明确。本研究以一株H9N2 AIV为母本病毒,培育了一株冷适应病毒株,研究其生物学特性,并评价其对SPF鸡的免疫效力,进一步通过荧光定量RT-qPCR分析冷适应株在SPF鸡胚中复制能力,以及6种细胞因子的转录水平,初步评价了H9N2 AIV冷适应株的免疫应答反应。
1 材料与方法
1.1 主要实验材料 H9N2 AIV分离株A/Chicken/Shandong/903/2013(CK/903/2013)和A/Chicken/Shandong/1167/2015(CK/1167/2015),由山东省农业科学院畜牧兽医研究所禽病室保存,两株病毒均属于H9 4.2.5.1分支。10日龄SPF鸡胚购自山东省农业科学院家禽研究所SPF鸡场。
反转录试剂盒购自Genstar公司;去基因组反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)、RNAiso Plus、TB GreenTMPremix ExTaqTM试剂均购自TaKaRa公司。
1.2 引物的设计与合成 根据GenBank登录的IL-1β、IL-6、IL-12、IL-8、MDA5、OAS、β-actin、H9N2 AIV HA基因的序列,利用Primer 6.0软件设计特异引物,由上海生工生物工程技术服务有限公司合成(表 1)。
1.3 冷适应株培育 CK/903/2013作为冷适应传代毒株,在SPF鸡胚连续传代,鸡胚培养温度由37℃逐渐降低到27℃,每降1℃,传代3次,27℃~25℃,每降0.5℃,传代5次,最后用有限稀释法在25℃将鸡胚纯化30代,使其能够稳定复制,即获得冷适应株,命名Ca30。
1.4 冷适应株基因稳定性突变分析 利用RNAiso Plus试剂分别提取CK/903/2013病毒、纯化后的10代、20代和30代Ca30株病毒RNA,反转录后以其为模板,利用特异性引物分别扩增HA基因。PCR反应条件为 95℃ 5 min;95℃ 30 s、53℃ 30 s、72℃1 min 30 s,72℃10 min,30个循环。电泳分析扩增结果后胶回收目的条带,连接至pMD18-T载体,由上海生工生物工程技术服务有限公司测序,分析冷适应株的氨基酸稳定性突变。
1.5 冷适应株病毒的冷适应性检测 将冷适应病毒Ca30和CK/903/2013株用含双抗的PBS稀释,取10-4、10-5、10-6、10-7、10-8、10-9、10-107 个 稀 释 度 ,分别接种于10日龄SPF鸡胚,每个稀释度0.2 mL/胚,各接种5个SPF鸡胚,分别于不同温度(25℃、31℃、35℃、37℃)孵育,弃去24 h内死亡的鸡胚,接种72 h后检测鸡胚尿囊液HA血凝效价,根据Reed-Muench法计算病毒的鸡胚半数感染量(Egg infectious dose,EID50),评价冷适应株病毒的冷适应性。
1.6 冷适应株动物感染实验 将CK/903/2013和Ca30病毒株的尿囊液经PBS稀释,以0.2 mL(106EID50/0.2 mL)的剂量经鼻腔接种1周龄SPF鸡[5],感染后1 d、3 d、5 d、7 d采集其口腔棉拭子、泄殖腔棉拭子,以及肺脏、喉气管等内脏器官,将采集的棉拭子和内脏器官经常规处理后分别接种于10日龄SPF鸡胚检测排毒载毒情况。Ca30组接种后1周、2周、3周、4周、5周采血,分离血清,分别用Ca30、母本CK/903/2013病毒株和异源CK/1167/2015病毒株的尿囊液配制4单位抗原,通过血凝抑制试验(HI)测定血清转阳的情况。
1.7 qPCR检测冷适应株Ca30在鸡胚中的复制情况 用106EID50/200 μL的Ca30接种10日龄鸡胚30枚,200 μL/胚,PBS接种60枚10日龄鸡胚作为空白对照[6]。将鸡胚置于25℃培养,弃去24 h内死亡的鸡胚,分别于接种病毒后8 h、12 h、24 h、36 h、48 h、60 h、72 h各收集3枚鸡胚的尿囊液、心脏、肝脏、肺脏和脑组织,利用RNAiso Plus提取RNA,取1 μg RNA经去基因组反转录合成cDNA,以其为模板,采用文献[6]方法,利用qPCR检测各内脏器官病毒复制水平。鸡胚尿囊液病毒拷贝数通过外部基因荧光素酶基因(Luciferase)和M基因进行相对定量的校正。
1.8 qPCR检测冷适应株Ca30接种鸡胚后的各脏器细胞因子转录水平 收集1.7中各时间点脏器组织研磨,按RNAiso Plus试剂说明书提取病毒RNA,取1 μg RNA经反转录合成cDNA,以其cDNA为模板,利用表1中引物,qPCR[6]检测各脏器的6种细胞因子的转录水平。各基因的转录水平以β-actin为内参基因,利用公式2-△△CT对各细胞因子mRNA转录水平进行计算,计算每个时间点3枚鸡胚(n=3)的平均值和标准差。

表1 扩增细胞因子及HA基因的引物序列Table 1 Primer sequence for amplification of cytokines and HA gene
2 结果
2.1 H9N2 AIV冷适应株Ca30 HA基因序列分析为了测定冷适应株Ca30的适应性突变特征,通过测序获得CK/903/2013原代、纯化后的10代、20代和30代冷适应株的HA基因全序列,并分析HA基因编码的氨基酸突变情况,结果显示,冷适应株从第10代开始已经获得大部分的稳定氨基酸突变,其中第164位氨基酸由母本病毒株的Q突变为第10代的R,至第20代获得稳定突变L。至此,20代与30代的氨基酸突变位点全部一致(表2)。表明冷适应病毒株Ca30获得稳定的氨基酸突变。
2.2 H9N2 AIV冷适应株Ca30获得冷适应特性的检测结果 将不同稀释度的冷适应病毒Ca30和CK/903/2013病毒株分别接种SPF鸡胚后分别置于不同的温度进行病毒增殖,HA血凝效价检测结果显示:冷适应病毒在25℃病毒效价为9 log2,EID50值为10-8.25/0.2 mL,随着温度的升高病毒HA效价逐渐降低,37℃时冷适应病毒失去复制能力,而CK/903/2013病毒在37℃的EID50值为109.75/0.2 mL,随着温度的降低,该病毒HA效价逐渐降低,25℃时CK/903/2013病毒失去复制能力(表3)。表明冷适应病毒具备在低温下复制的能力。
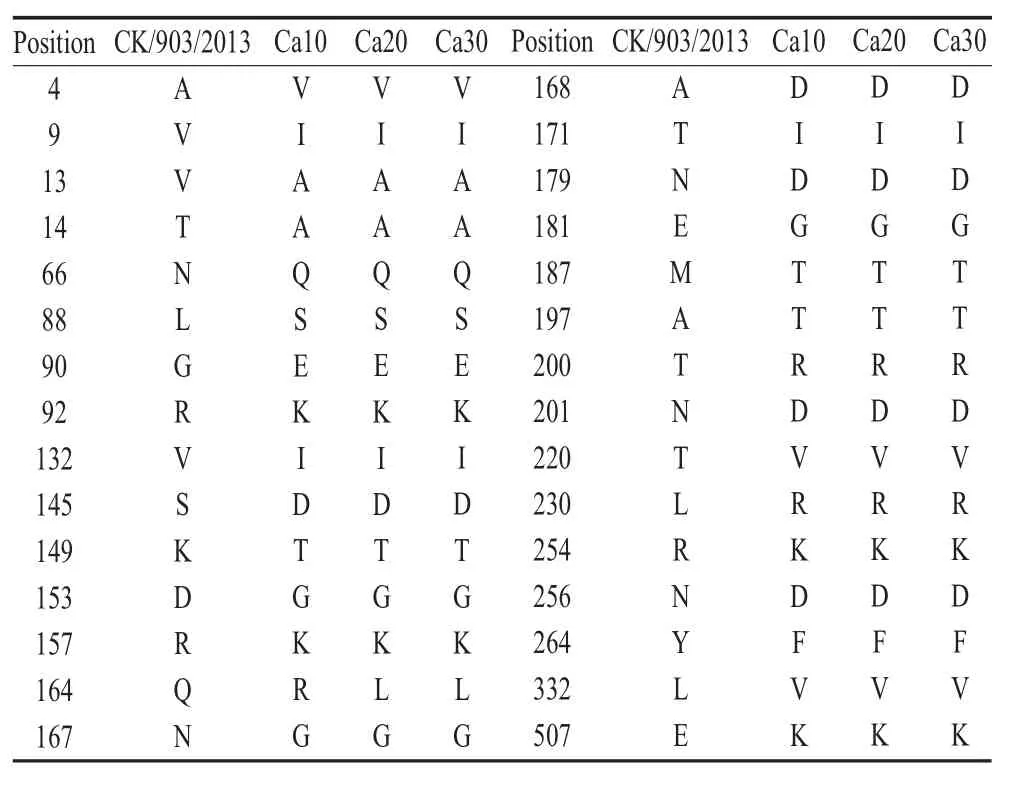
表2 H9N2 AIV冷适应株Ca30的氨基酸稳定性突变结果Table 2 Amino acid mutation of cold-adapted HPN2 strain Ca30

表3 H9N2 AIV CK/903/2013及其冷适应株Ca30在不同温度下的HA效价和EID50测定结果Table 3 HA titer and EID50of H9N2 AIV CK/903/2013 and the Ca30 cultured at different temperatures
2.3 H9N2 AIV冷适应株Ca30动物感染实验结果检测结果 将CK/903/2013和Ca30株病毒经鼻腔接种1周龄SPF鸡,进行排毒、脏器载毒量以及血清转阳情况的测定。结果显示,Ca30组SPF鸡仅在病毒感染3 d后的口腔棉拭子和喉气管中检测到排毒,而CK/903/2013组SPF鸡在病毒感染1 d后就能在喉气管和口腔棉拭子中检测到病毒,且持续时间较长。CK/903/2013仅在1 d后的肺脏中复制,而Ca30病毒株不能在肺脏中复制(表4)。血清HI抗体检测显示,Ca30病毒株接种后3周针对母本病毒和异源病毒CK/1167/2015的HI效价达到最大值,分别为8 log2和5.2 log2,接种后4周针对母本病毒的HI效价达到峰值7.2 log2(图1)。表明相比于 CK/903/2013,Ca30病毒排毒较少,病毒在喉气管中低水平复制,并且冷适应病毒能够激发机体产生较好的免疫应答,具有良好的免疫原性。
2.4 Ca30株病毒在鸡胚尿囊液和各内脏器官中的增殖情况 将Ca30株接种SPF鸡胚,利用qPCR检测不同时间点病毒在尿囊液和内脏器官中的增殖情况,结果显示SPF鸡胚接种Ca30株36 h后开始在鸡胚尿囊液中复制,在60 h达到复制高峰。在心脏和肺脏中,病毒于接种后36 h开始复制,72 h达到复制高峰;但在肝脏中,病毒于接种后60 h才开始复制,72 h达到复制高峰;而在脑组织中,病毒在接种之后一直持续低水平复制(图2)。表明各内脏器官中,Ca30株病毒在鸡胚肺脏中的增殖量最多,其次为心脏、肝脏,但脑中仅呈一过性增殖。
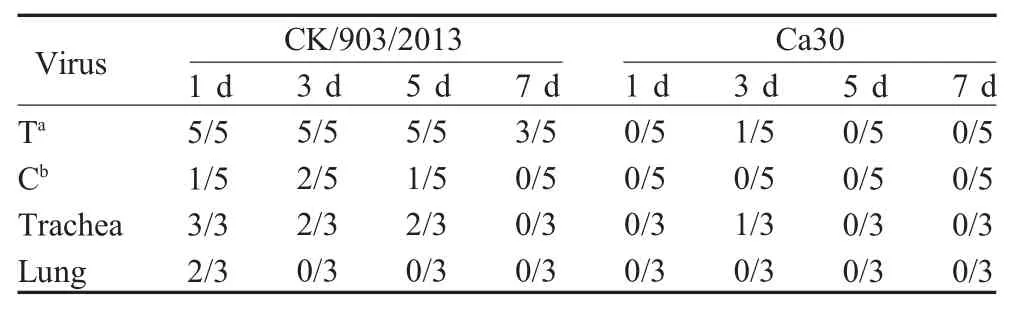
表4 冷适应病毒对鸡的免疫效力结果Table 4 Immune efficacy results of cold-adapted virus in chickens
图1 免疫后SPF鸡HI抗体测定结果Fig.1 The results of HI antibody titers post vaccination
2.5 Ca30株病毒感染SPF鸡胚后的细胞因子转录水平的检测结果 Ca30感染SPF鸡胚,采集不同时间点鸡胚肺脏,利用qPCR检测肺脏中各类细胞因子的转录水平。结果显示,在肺脏组织中,IL-1β、IL-6、IL-12、IL-8和OAS的转录水平均在病毒接种72 h后达到峰值,分别上调8.27、7.8、7.9、16.47和4.35倍;MDA5在接种后48 h时转录水平上调至峰值(4.18倍),其中IL-12、OAS和MDA5的转录水平在组内差异显著(p<0.05)(图3)。表明Ca30能够上调鸡胚肺脏各类细胞因子的转录水平,激发细胞免疫的功能,降低了冷适应病毒对宿主肺脏组织的进一步伤害。
Ca30病毒接种SPF鸡胚,采集不同时间点鸡胚心脏,利用qPCR检测心脏中各类细胞因子的转录水平。结果显示,在心脏组织中,IL-1β、IL-6、IL-12、IL-8、MDA5和OAS的转录水平均在病毒感染8 h有上调趋势,其中IL-12、IL-8和MDA5的转录水平均在72 h再次上调(图4)。表明病毒在接种之后迅速侵入鸡胚心脏,引起各类免疫因子转录水平上调,继而降低了病毒的增殖速度。
图2 Ca30冷适应病毒接种SPF鸡胚后不同时间点尿囊液和内脏器官的病毒含量测定Fig.2 Ca30 cold-adapted virus contents at various time points after viral inoculation in SPF chickens embryos

图3 Ca30病毒感染SPF鸡胚肺脏中各细胞因子在不同时间点mRNA转录水平变化Fig.3 Changes of mRNA transcription levels of various cytokines at different time points in lung of SPF chickens embryos infected with Ca30 virus
图4 Ca30病毒感染SPF鸡胚心脏中各细胞因子在不同时间点mRNA转录水平变化Fig.4 Changes of mRNA transcription levels of various cytokines at different time points in heart of SPF chickens embryos infected with Ca30 virus
Ca30病毒接种SPF鸡胚,采集不同时间点鸡胚肝脏,利用qPCR检测肝脏中各类细胞因子的转录水平。结果显示,病毒感染肝脏72 h时IL-1β、IL-8和OAS的转录水平上调至峰值,分别上调4.28、5.25和4.81倍;IL-6在12 h和24 h下调,72 h则上调6.53倍;IL-12转录水平下调,60 h表达下调量最低15.06倍;MDA5转录水平变化不显著(图5)。结果表明,冷适应病毒感染SPF鸡胚肝脏前期不能激发其的免疫应答,而感染后期则能够引起部分免疫因子的转录水平上调,这可能与感染前期肝脏中病毒复制量较少有关。
Ca30病毒接种SPF鸡胚,采集不同时间点鸡胚脑组织,利用qPCR检测脑组织中各类细胞因子的转录水平。结果显示,脑组织中各细胞因子的转录水平变化均不明显(图6),进一步证实前述实验结果:冷适应病毒在SPF鸡胚的脑组织中复制能力较低,所以激起的免疫应答也不足。
图5 Ca 30病毒感染SPF鸡胚肝脏中各细胞因子在不同时间点mRNA转录水平变化Fig.5 Changes of mRNA transcription levels of various cytokines at different time points in liver of SPF chickens embryos infected with Ca30 virus
图6 Ca30病毒感染SPF鸡胚脑组织中各细胞因子在不同时间点mRNA转录水平变化Fig.6 Changes of mRNA transcription levels of various cytokines at different time points in brain of SPF chickens embryos infected with Ca30 virus
3 讨论
本研究制备的H9N2 AIV冷适应病毒株在25℃的复制能力与其母本病毒在33℃的复制能力相当,其在37℃已经失去了复制能力,具有冷适应性和温度敏感性,如果作为疫苗株使用,疫苗毒的扩增也必须在25℃条件下培养。本研究中冷适应株病毒Ca30在25℃传代至20代次已获得稳定的氨基酸突变。动物实验结果显示,相比于母本CK/903/2013病毒,Ca30病毒排毒较少,病毒仅在喉气管部低水平复制,鸡的正常体温在40.5~42℃,冷适应病毒无法复制,可能是上呼吸道与外界环境相通,温度有所降低,冷适应病毒可能会少量复制。以上结果表明冷适应株病毒是有限复制,仅能在上呼吸道增殖,不能在下呼吸道增殖,对鸡并无致病性,但可以诱导机体产生粘膜免疫和体液免疫。有研究表明,减毒活疫苗通过滴鼻免疫可以刺激黏膜免疫产生分泌型的sIgA,sIgA是外分泌液中的主要抗体类型,参与黏膜局部免疫,通过与流感病毒结合,阻止病毒黏附到细胞表面,从而在局部抗感染中发挥重要作用[7]。魏延迪等研究显示,H9N2亚型AIV冷适应病毒株接种SPF鸡后,仅在感染后2 d的气管中检测到病毒,与本研究结果一致,该研究对病毒在鸡体内的传播能力进行了评价,发现冷适应病毒不会造成接触性传播[8]。血清HI抗体检测显示,Ca30病毒与同源和异源的H9N2毒株均有很好的交叉血凝抑制反应,具有良好的免疫原性。以上结果表明,Ca30病毒株可以作为H9N2 AIV冷适应疫苗候选株。
先天免疫是机体抵抗病毒侵入的第一道防线,病毒侵入后,首先被固有免疫细胞中的模式识别受体识别,进而激活先天性免疫细胞产生白介素等细胞因子,并诱导和调控宿主的适应性免疫应答[9]。然而,过度的先天性免疫反应往往加重疾病,例如季节性流感感染引发的肺部病理损伤[10]。所以能否引起宿主适度的先天性保护免疫反应是AIV弱毒疫苗研制的关键。本研究获得的H9N2 AIV CK/903/2013株冷适应病毒Ca30感染鸡胚后,在不同的器官中各类细胞因子的转录水平变化呈现不同的趋势。各内脏器官中,病毒在肺脏中的增殖量最多,并能引起细胞免疫应答,表明流感病毒冷适应株对肺脏组织的亲和力最强。在心脏中部分细胞因子在病毒感染初期转录水平上调,之后转录水平上调量降低甚至下调;而在心脏中,病毒感染36 h左右病毒开始复制,到72 h时复制达到高峰,却未激发各类细胞因子的免疫应答,并且心脏中病毒的复制量明显低于肺脏的复制量,说明感染初期各类细胞因子的转录抑制了心脏中病毒的复制速度,病毒量并不能造成机体的损伤。肝脏中各种细胞因子在多数时间点转录水平下调,而部分免疫因子的转录水平上调量在72 h达到峰值,并且病毒在肝脏中72 h时复制达到高峰,说明病毒初期可以在肝脏中低水平复制,但后期(60 h)病毒复制水平提高,引发部分细胞因子转录水平上调;而在脑组织中,免疫反应很弱,可能与病毒在脑组织中低水平复制有关。
IL既具有致炎作用又有抗炎作用,是机体创伤和修复过程中一种重要的急性期反应介质[11]。其中IL-12在机体免疫应答中尤其是在抗肿瘤免疫和抗病毒免疫中发挥极其重要的作用[12]。促炎因子IL-1β由活化的巨噬细胞产生,刺激T细胞和B细胞增殖、触发急性期反应和活化血管内皮细胞等,促进炎症反应,进而清除病毒和修复受损的组织[13-14]。本研究中,鸡胚感染冷适应株病毒8 h后IL-1β即在其肺脏中转录水平上调,感染后期再次转录水平上调,并且在病毒的复制高峰达到最大转录水平,证实IL-1β可能通过直接和间接的方式介导鸡胚对流感病毒的免疫应答。IL-1β转录水平上调进一步诱导炎性因子IL-6、IL-8等的释放。IL-6在流感病毒感染过程中具有双面作用,IL-6表达水平适当的升高有助于病毒的清除,过度的IL-6释放引起免疫病理损伤,IL-6是机体参与免疫应答调节和体现机体炎症性疾病严重程度的指标之一[15-16]。IL-8具有抗感染、抗肿瘤以及免疫反应调节的作用,IL-8的表达水平可以作为炎症疾病的诊断、鉴定依据之一[17]。本研究中,这些细胞因子在肺脏和肝脏中的转录水平与病毒复制滴度密切相关,均在感染后72 h达到高峰。结果表明,冷适应病毒感染鸡胚后,肺脏和肝脏中能够表达一定量的促炎因子,促进机体清除病毒,这与机体保护性免疫有关,但IL-6和IL-8转录水平也上调,说明冷适应株可能仍然会引起肺脏和肝脏的炎性反应。黑色素瘤分化相关基因5(MDA5)属于RIG-I样受体信号分子,在胞质内识别负链RNA病毒如AIV等,进一步通过MAVS激活IRF-3和NF-κB,引起宿主的抗病毒信号[18-19]。本研究制备的冷适应株激发宿主肺脏、心脏和肝脏的MDA5表达,并且在48 h达到表达高峰,说明该冷适应株可通过MDA5通路激发宿主的免疫保护效应。同时,MDA5和2'-5'寡聚腺苷合成酶(OAS)也是机体重要的抗病毒蛋白,在抗病毒过程中发挥重要作用[20]。研究表明,OAS在流感病毒侵入时,能够增强宿主的抗病毒效应,具有良好的抗病毒活性[21]。在心脏中,冷适应病毒诱导MDA5表达量上调,MDA5在抗病毒感染中发挥重要作用,而在肺脏中,MDA5和OAS在抗病毒感染中发挥协同作用,促进病毒的清除。
综上所述,制备的H9N2亚型AIV冷适应株对鸡体具备免疫保护力。该病毒在37℃不复制,但能够在25℃条件下,在鸡胚肺脏、肝脏和心脏中复制,但并未激发强烈的宿主免疫应答,这应该与冷适应株的保护性有关。本研究从先天性免疫角度初步阐明冷适应弱毒疫苗的免疫应答机制。

