禽腺病毒血清4型纳米PCR检测方法的建立与初步应用
王利丽,郑 丽,李富强,李秀丽,任卫科,路 超,张 莉,董志民,鄢明华 *
(1.天津市畜牧兽医研究所,天津300381;2.农业部兽用药物与诊断技术天津科学观测实验站,天津300381;3.天津市畜禽健康养殖技术工程中心,天津300381)
禽腺病毒血清4型(Fowl aviadenovirus serotype 4,FAdV-4)属于腺病毒科禽腺病毒属禽腺病毒C种成员,主要感染3周龄~5周龄的肉鸡、种鸡及蛋鸡,主要引起心包积液综合症(Hydropericardium syndrome,HPS)和包涵体肝炎(Avian inclusion body hepatitis,IBH)。该病病程可持续7 d~15 d,具有高度传染性,发病初期的鸡表现为精神沉郁,羽毛蓬乱采食量迅速下降或废绝,拉淡黄绿色稀便,解剖可见肝脏肿大出血、心包积液,肾脏肿大,肺脏出血,胸腺充血肿大等症状,死淘率10%~80%。该病毒可通过鸡胚垂直传播,也可经粪便、气管和鼻腔粘膜水平传播[1]。
早在2013年国内就报导过HPS,随后该病的临床病例数量明显增加,特别是2015年3月以后,以山东、河南、江苏等省区为中心点,呈辐射状向周边养禽省份和区域快速蔓延,现已遍布全国各地,呈地方性流行。从高发病地区血清型分析来看,主要为C种(血清4型)和E种(血清8a、8b型)。FAdV的12种血清型均可以引起IBH,但目前以FAdV-8a/b为主,除此之外还有FAdV-10、FAdV-2等[2]。HPS主要由FAdV-4感染所致。
目前已报导的禽腺病毒检测方法包括病毒分离与鉴定、ELISA、病毒中和试验等[3]。夏梦圆[4]、唐熠[5]、袁万哲[6]等根据hexon基因设计引物,建立了FAdV的SYBR GreenⅠ荧光定量PCR检测方法、PCR-RFLP方法、LAMP检测方法及PCR检测方法,并已在动物传染病诊断上得到应用。本研究选择FAdV保守的核苷酸序列作为扩增区域,设计了一对检测FAdV-4 penton基因的PCR引物,通过条件优化建立了Nano PCR方法,以期为FAdV的流行病学调查及临床检测等提供一种有效的技术支撑。
1 材料与方法
1.1 样品及病毒株 87份肠道、肝、气管及心包液等临床样品来自天津、河北地区送检的临床疑似发病鸡,置-80℃保存。新城疫病毒(NDV La Sota株)、鸡传染性支气管炎病毒(IBV H120株)、鸡传染性法氏囊病毒(IBDV B87株)、鸡毒支原体(MG F36株)、鸡马立克病病毒(MDV 814株)、鸡传染性喉气管炎病毒(ILTV K317株)、鸭瘟病毒(DPV CVCC AV1222株)为市售疫苗;禽呼肠孤病毒(ARV S1133株cDNA)为中国农业科学院哈尔滨兽医研究所惠赠 ;FAdV 标 准 株(FAdV-1、FAdV-2、FAdV-4、FAdV-8a、FAdV-8b和FAdV-11)核酸为中国兽医药品监察所惠赠;鸡减蛋综合征病毒(EDSV 76株)购自中国兽医药品监察所;禽流感病毒(AIV H9亚型)和鸡大肠杆菌(WW1株,O2血清型)为本实验室分离鉴定保存。
1.2 主要试剂 rTaqDNA聚合酶、DL2000 DNA Marker等试剂购自宝生物工程(大连)有限公司;核酸提取试剂盒购自金瑞鸿捷生物科技有限公司;纳米颗粒试剂盒购自上海沪峥生物科技有限公司;DNA纯化试剂盒购自北京博迈德基因技术有限公司。
1.3 引物的设计与合成 根据GenBank中登录的FAdV-4 penton基因序列,选择保守区域核苷酸序列,设计一对PCR引物,由金唯智生物科技有限公司合成,其引物序列为:F-primer:5'-ACAGCCGT GCGCACCAACTGCCCGAAC-3'/R-primer:5'-CTGCA GATCCTCGTAGGTAATAAC-3',预期扩增产物片段为498 bp。
1.4 Nano PCR反应体系与条件的优化 建立Nano PCR 20 μL 反应体系:2×Nano Buffer 10 μL,F-primer(10 μmol/L)1 μL, R-primer(10 μmol/L)1 μL,模板 2 μL,rTaq(5 U/μL)0.5 μL,ddH2O 5.5 μL。以FAdV-4标准株的DNA为模板,利用方阵法对退火温度(50℃~60℃)和引物浓度(0.2 μL~2.0 μL)进行优化,同时设立空白对照。PCR产物经琼脂糖凝胶电泳检测。
1.5 特异性试验 利用核酸提取试剂盒提取ILTV、IBV、IBDV、MG、 MDV、EDSV、E.coil、DPV、NDV、AIV(H9)、ARV的核酸(RNA逆转录为cDNA)及 FAdV-1、FAdV-2、FAdV-8a、FAdV-8b和 FAdV-11标准株DNA,以ddH2O作为阴性对照,FAdV-4标准株DNA作为阳性对照,应用已建立的Nano PCR方法进行检测,以验证该方法的特异性。
1.6 敏感性试验 利用NanoDrop测定FAdV-4标准株DNA浓度,将其换算为拷贝数后,以ddH2O进行 10倍系列稀释(5.4×105拷贝 /μL~5.4拷贝/μL),应用 Nano PCR与本实验室前期建立的FAdV-4常规PCR分别进行检测,以验证该方法的敏感性。
1.7 临床样本检测 取87份来自天津、河北等省市的临床疑似发病鸡肠道、肝、气管及心包液等病料样品,充分剪碎后,加入生理盐水并匀浆处理,转移至离心管,6 000 r/min离心10 min,取上清液,按照核酸提取试剂盒说明书提取RNA,逆转录为cDNA,以其为模板,利用本研究建立的方法进行检测,同时将采集的所有样本接种LMH细胞进行病毒分离[5],比较二者的符合率。
2 结果
2.1 禽腺病毒血清4型Nano PCR检测方法优化结果 通过对退火温度等进行的优化,确定最佳反应条件为:94℃5 min,94℃30 s,60℃30 s,72℃30 s,30个循环,72℃7 min。结果显示,仅扩增出一条约500 bp的条带,与预期结果一致(图1)。表明本研究设计的引物能特异性的扩增目的片段。
2.2 特异性试验 利用本研究建立的Nano PCR方法对 ILTV、IBV、IBDV、MG、MDV、EDSV、E.coil、DPV、NDV、AIV、ARV的 DNA和 cDNA及 FAdV-1、FAdV-2、FAdV-4、FAdV-8a、FAdV-8b和FAdV-11标准株DNA进行扩增,结果显示其能够特异性地扩增FAdV-4的目的片段,但其它病原均不能扩增目的片段(图2)。表明本研究建立的方法特异性强。
2.3 敏感性试验 NanoDrop测定FAdV-4 DNA浓度为5.4×105拷贝/μL,以ddH2O进行10倍系列稀释(5.4×105拷贝 /μL~5.4 拷贝 /μL)后作为模板,进行Nano PCR扩增。结果显示该方法检测下限为54.0拷贝/μL,而普通PCR检测下限为5.4×102拷贝/μL(图3),Nano PCR方法较常规PCR方法敏感性高10倍。表明本方法敏感性较高。

图2 Nano PCR方法特异性试验Fig.2 Specificity reaction of Nano PCR method
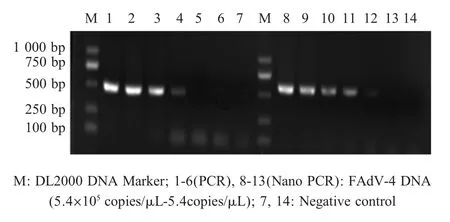
图3 FAdV-4 PCR与Nano PCR敏感性比较试验Fig.3 Sensitivity tests Comparison between PCR and Nano PCR
2.4 临床样本检测 利用本试验建立的Nano PCR方法对来自天津、河北等省市的87份临床样品进行检测,同时将采集的样品进行病毒分离鉴定,结果两种方法均检出阳性样品14份,阳性检出率为16.09%,二者阳性符合率100%。同时结果显示肝脏、气管及心包液样品检出率较高,肺脏样品中偶有检出。表明该Nano PCR方法可用于禽腺病毒临床样品检测。
3 讨论
FAdV-4感染后易继发禽流感、大肠杆菌感染等疾病,通过临床观察与现场剖检很难确诊,需要采用实验室检测手段进行诊断。传统的病毒分离鉴定方法是诊断该病的金标准,但费时费力。PCR由于快速、特异性好、灵敏性高等优点,在动物疫病检测领域被广泛应用。目前,国内对FAdV的PCR检测主要以六邻体为目的基因[4-5],这些方法可特异性检测FAdV,但无法区别FAdV的不同血清型。唐熠等应用PCR-RFLP方法,实现了对FAdV的12个血清型进行分型鉴定,但该方法多了一步酶切过程,增加了检测时间及成本[5]。袁万哲根据FAdV-4六邻体蛋白的Hexon基因核苷酸序列,设计用于扩增FAdV-4的PCR引物,建立了FAdV-4 PCR检测方法,对FAdV-4的最低核酸检出量为12.9 pg,该方法可区分FAdV-4和FAdV-11,但没有对其它FAdV血清型进行鉴别[6]。研究表明,五邻体由基底和伸出表面的一根末端有顶球的纤维组成,有助于病毒黏附于细胞表面,还可与细胞表面的病毒受体结合,在病毒感染细胞过程中起着非常重要的作用,且该蛋白保守性较好,能刺激机体产生中和抗体[7]。因此,五邻体蛋白在FAdV的致病性、诊断、预防与控制等方面均具有重要意义。本研究针对FAdV-4五邻体基因设计1对引物并建立了Nano PCR检测方法,该方法敏感性高,对核酸的最低检测浓度为54.0拷贝/μL。特异性试验结果显示,该方法对NDV、AIV(H9)、ILTV、EDSV、ARV、IBDV和IBV等12种家禽病原均不能扩增出目的片段,说明该方法可特异性地检出FAdV-4,可用于该病的临床鉴别诊断和疫情监测。
FAdV包括12个血清型,基于交叉中和试验和限制性内切酶消化分析,又分为A(血清1型)、B(血清 5 型)、C(血清 4、10 型)、D(血清 2、3、9、11型)、E(血清 6、7、8a、8b型)5个种。研究表明,不同血清型的FAdV致病性有较大差异[9],因此,鉴别不同血清型的FAdV,对于临床疾病的诊断也非常重要。本研究应用建立的Nano PCR方法对 国 内 已 报 导 的 FAdV-1、FAdV-2、FAdV-8a、FAdV-8b、FAdV-11等5个血清型进行检测,结果均为阴性,表明该方法可以很好地鉴别FAdV-4和国内流行的其它禽腺病毒流行株。
纳米粒子PCR方法具有能提高扩增特异性,增加扩增灵敏度以及加快反应速度等优点[9]。本研究建立的Nano PCR方法的敏感性比应用相同引物的普通PCR方法高10倍。这一结果与范锦戴等[10]报导一致,而杨金兴等建立的FAdV-4的特异性实时荧光PCR方法检测样品最小量为100拷贝/μL[11],说明本研究建立的Nano PCR方法可与荧光PCR方法媲美,具有很好的应用前景。但与白云等[12]的Nano PCR方法的敏感性是普通PCR的100倍结果不一致。推测与不同厂家的纳米PCR试剂、PCR反应体系以及引物自身的敏感性等因素有关,具体原因有待进一步分析。
应用本研究建立的Nano PCR方法针对临床送检样本进行检测,其结果与病毒分离鉴定方法结果一致。不同样品中,肝脏、气管及心包液样品检出率较高,肺脏样品中偶有检出。该方法的建立为FAdV-4的流行病学调查、快速诊断及防治等提供了有效的技术支持。

