辣椒C. baccatum×C. frutescens种间杂种的获得与鉴定
张 凯,刁卫平,郭广君,潘宝贵,戈 伟,刘金兵,王述彬1,*
(1.南京农业大学 园艺学院,江苏 南京 210095;2.江苏省农业科学院 蔬菜研究所/江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
辣椒(Capsium)起源于美洲热带地区,属茄科(Solanaceac),茄亚族(SolaninaeDunal),辣椒属(Capsicumspp.),一年生或多年生草本植物,灌木,半灌木,多分枝,是一种世界性的蔬菜作物。Hunziker(1956)将辣椒属划分为22个野生种和5个栽培种(C.annuum、C.chinense、C.frutescens、C.baccatum和C.pubescens)[1-2],其中一年生辣椒C.annuum是全世界种植最为广泛的栽培种[3],但由于长期较高的人工选择压力,其遗传基础已渐趋狭窄[4-5]。育种上可以利用别的栽培种与一年生辣椒C.annuum进行杂交,进而实现优异种内基因的转移,拓宽一年生辣椒C.annuum的遗传基础,增强其对环境的适应性。
浆果状辣椒C.baccatum起源于秘鲁,主要分布于拉丁美洲[1],有很多优良抗性性状,如抗烟草花叶病毒(TMV),抗黄瓜花叶病毒(CMV),抗疫病[6]等。灌木辣椒(C.frutescens)以植株高大著称,植株灌木状、多年生,限于热带和亚热带进行栽培或野生[7]。灌木辣椒常被作为调味品种植,果实多用于制干、腌渍和提炼辣椒油[8],具有抗曲顶病毒病[9]、卷叶病毒病[10]、白粉病[11]、疫病和黄萎病[12]等多种有利抗病性状。
有研究表明,一年生辣椒C.annuum与C.frutescens部分亲和,两者相互杂交能得到F1,与C.baccatum完全不亲和[13],两者相互杂交不能得到F1,最后利用胚拯救的技术获得C.annuum和C.baccatum的杂种F1[14]。所以如何实现一年生辣椒C.annuum和栽培种C.baccatum之间基因的直接转移也显得尤为迫切。下一步可以利用C.frutescens作为基因桥获得C.annuum×(C.baccatum×C.frutescens)三元杂种,实现一年生辣椒C.annuum和栽培种C.baccatum的杂交,进而有效改良一年生C.annuum栽培种,提高其产量,改善其品质,以及增强其对环境的适应性和对病虫害的抗性。Egawa[15]和程志芳[6]等曾经进行C.baccatum与C.frutescens杂交,正反交均未获得F1。目前国内暂无C.baccatum和C.frutescens杂交成功的报道。本文成功实现了C.baccatum与C.frutescens杂交并获得F1,为后续辣椒育种奠定了基础。
1 材料与方法
1.1 材料
试验材料为具有多种抗性性状的浆果状辣椒C.baccatumPI441570和灌木辣椒C.frutescensPI634826。两者均引自美国国家种质资源试验室,经多代自交纯化,上述材料均由江苏省农业科学院蔬菜研究所提供。
1.2 试验方法
1.2.1 种间杂交方法 杂交试验在江苏省农业科学院蔬菜所试验场的塑料大棚内进行。2017年3月9日定植。在开花盛期,5月25~7月15期间,以C.baccatum为母本,C.frutescens为父本,选择早上8:00~11:00和下午15:30~17:00进行杂交试验,使用镊子去雄杂交、挂牌,授粉后55 d左右收获成熟果实。为保证父本花粉的纯度,在杂交前1 d下午将父本次日要开放的花蕾用医用胶布粘住,杂交时再取下这些花收集新鲜花粉。尽量选择健壮的母本植株,以提高坐果率。
1.2.2 形态学观察 2017年7月30日将P1、F1和P2分批播种于江苏省农业科学院蔬菜所试验场的大棚内,2017年9月5日定植。随机选取F1及双亲各8株进行形态学观察鉴定,包括株高、株幅、叶纵径、叶横径、叶形指数、叶色、始花节位、花色、花药色泽、每节花数、花径、花萼生长状态、果纵径、果横径、果形指数、主茎色、果实朝向、幼果色、成熟果色,成熟果重共20个指标。其中叶形指数=叶纵径/叶横径,果形指数=果纵径/果横径,具体参照陈学军等[16]的方法进行。
1.2.3 花粉育性观察 盛花期时对辣椒杂种植株进行花粉可染率(1%醋酸洋红染色)的观察。随机选取盛开的亲本和杂交F1花3朵,置于载玻片上,滴一小滴醋酸洋红溶液,轻轻挤压花药,置于载玻片上,盖上盖玻片,片刻后在显微镜下观察,有活力的花粉被染成红色,用OLYMPUSBX-51显微镜在物镜40×的标准下观察拍照,每朵花镜检5个视野,每视野至少观察50个花粉粒,最后取平均值。
1.2.4 分子标记分析 辣椒DNA提取:本文采用改良的CTAB法[17]提取父母本及F1新鲜幼嫩叶片基因组DNA,用1%的琼脂糖凝胶电泳检测DNA质量,-20 ℃下保存备用。
EST-SSR标记分析:利用Ince等[17]用于辣椒种间杂种鉴定的45对SSR引物对P1、F1和P2进行SSR分析。SSR引物由生工公司合成。PCR总反应体积10 μL,其中正、反引物各1μL、DNA 1 μL、Mix 5 μL、ddH2O2μL。Mix、Marker均购自TaKara公司,PCR的扩增程序为:94 ℃、4 min;94 ℃、30 min,55 ℃、30 min,72 ℃、50min,30个循环;72 ℃、7 min,4 ℃保存。PCR产物采用6%聚丙烯酰胺凝胶电泳,电泳缓冲液为0.5×TBE,220 V恒定电压,跑胶2 h,改良的Charters银染方法检测。
2 结果与分析
2.1 种间杂种的获得
在江苏南京生态条件下,春季大棚里C.baccatum和C.frutescens均能正常开花结果,经人工去雄杂交,杂交30朵花,授粉后55 d左右,成功获得4个C.baccatum和C.frutescen种间杂交成熟果实,杂交率达到13.3%。每个杂交果含有8~10粒种子,种子饱满不一,F1发芽率在35%以上。
2.2 形态学观察
对亲本和杂种F1在生长期间对其进行田间农艺性状调查与比较。根据植物学性状差异,可以将其分为5种类型,如表1所示:(1)杂种优势型:株高,株幅,每节花数,花径表现超双亲的特性。(2)特异型:果实重量,果横径,果纵径,果形指数却不如双亲。(3)中间型:叶纵径,叶横径,叶形指数,叶色,主茎色,始花节位,花色,果纵径,果实朝向,青果色泽,熟果色泽都介于双亲之间。(4)偏母型:株高,株幅,叶横径,花色,花药色泽,花径,青果色泽,花萼明显程度,偏向母本。(5)偏父型:叶纵径,叶形指数,始花节位,每节花数,果重,果横径,果纵径,果形指数,偏向父本。杂种F1的花形、花瓣的长宽度、花瓣所带C.baccatum种特有的嫩黄色具有显著的中间型特征,表明其杂种的真实性(图1、图2)。

表1 亲本及 F1 表型性状

图1 P1(C.baccatum PI441570)、P2(C.frutescens PI634826)及其杂种F1花的形态特征
2.3 花粉育性观察
利用醋酸洋红对亲本C.baccatum、C.frutescens以及杂交F1的花粉育性进行观察,如果花粉粒呈现深红色则说明具有活力,呈现淡红色则表明花粉粒具有部分活力,而无色空瘪、畸形的花粉粒则表明是死的和不育的[18]。按照以上标准统计发现,种间杂种F1平均花粉可染率仅为4.9%,而亲本C.baccatum和C.frutescens的平均花粉可染率分别为42.0%和87.0%。如图3所示,根据镜检结果可以看出,P1和P2虽然花粉数差不多,但是能被染上色的P1花粉比P2花粉少很多,杂种F1虽然镜检花粉很多,但是成功被染上色的最少,说明这2个种之间杂交的困难程度。
2.4 种间杂种的EST-SSR分析
本研究利用45对EST-SSR引物对父母本及杂种F1进行扩增分析,由表2和图4可知:37对引物在双亲和F1中扩增出清晰条带总共127条,8对引物没有扩增出条带,占比17.8%,其中P1、P2和F1共有带30条,占22.2%,它反映了F1与双亲DNA的同源关系;F1与母本共有带6条,占4.4%,F1与父本共有带20条,占比14.8%。其中6对引物(Primer ID:AGi009、AGi054、AGI080、AGi086、AGi100、AGi101)的扩增的杂种F1谱带既有母本的特征带,又有父本的特征带,扩增条带表现为双亲互补型,进一步在分子水平上证明了杂种的真实性。
3 讨论
种间杂交是实现基因转移的有效途径之一[19-20]。本研究以下垂浆果状辣椒C.baccatum为母本,以灌木C.frutescens为父本,成功实现了种间杂交并获得杂种。这是国内首次获得C.baccatum和C.frutescens种间杂交的报道,填补了国内的空白。

图2 P1 (C. baccatum PI441570)、P2 (C. frutescens PI634826)及其杂种F1 的形态特征(A:果实;B:叶)
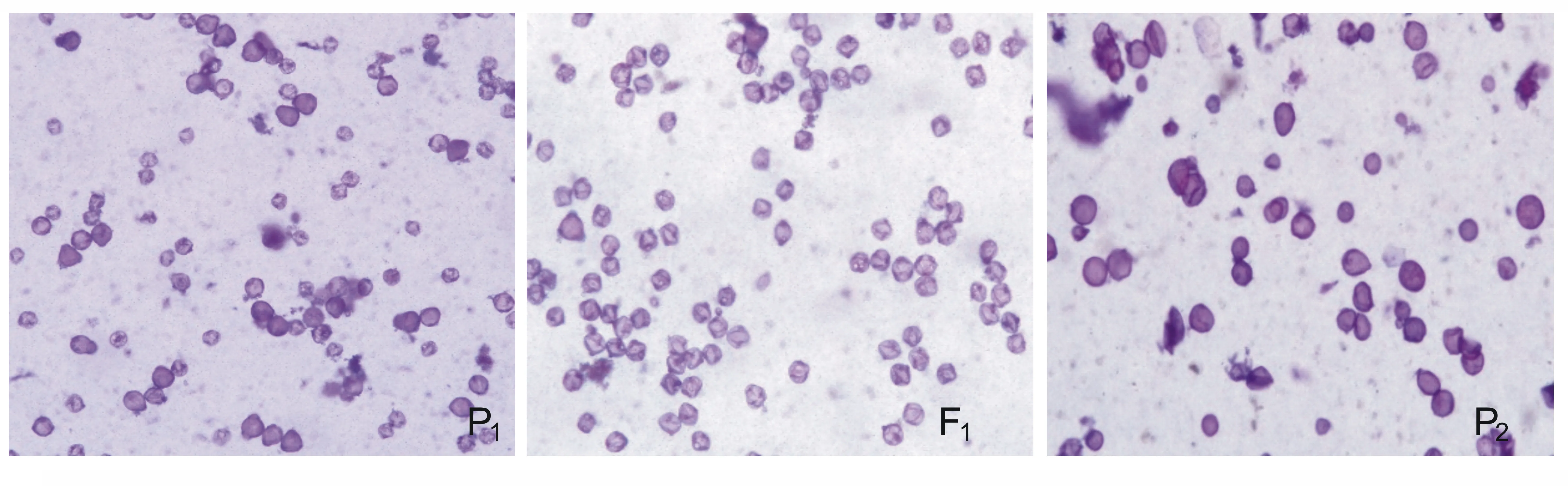
图3 P1 (C. baccatum PI441570)、P2 (C. frutescens PI634826) 及其杂种 F1 的花粉活力

引物名称正向引物(5′→3′)反向引物(5′→3′)AGi009GAGGCTTTTTAGCAGGGTGAGCAGACAACTTCGCATCTACAAGi054CAGTGTGCGATTTTCAACAGGAGCAGAGAGGGTGAGAAGI080TTGGTTTCAATTTTATTTCTCCATTGAAAGATTAAAAACCTGGGTGCTAGi086AGTCCTTGCCGATGTTGAAGGCAGCAGCAGTTAACCATGAAGi100TTCCTTCACACCCACAACCACTTTCTTGGCTTTACCACCAGAGi101TGAGGAGACAAACTTCAACTGGGATGAGGACAAAACCAAGGACT
本文成功实现了C.baccatum和C.frutescens的杂交,与程志芳等[8]得出的结果不同,分析其原因可能是:(1)本次试验采用重复授粉法[21],第1次授粉将去雄后当天开放的花朵作为授粉对象;第2次授粉为第1天授粉过后、第2天做重复授粉;第3次授粉为第1天授粉过后,分别于第2天和第3天做重复授粉处理。根据每天的天气状况采取合适的时间段来授粉。(2)另一个原因可能因为本次试验的父母本在江苏南京环境下已自交纯化连续种植多年,生长习性可能已经适应这个环境。(3)在本试验授粉过程中,尽量摘除母本植株上自交的果实,防止自交果实在营养上对杂交授粉的一个竞争。
SSR是一种近年来发展起来的以特异引物PCR为基础的新型分子标记技术,具有表现为多态性,共显性、需要DNA量少[22]。已广泛应用于作物遗传多样性、亲缘关系的研究,品种鉴定和系统发生以及遗传图谱和基因定为等研究[23-24]。但普通的SSR标记的开发时间长,费用较大,从EST数据库中建立的SSR标记更为快捷、经济,而且通用性好,比较稳定和费用低等优点。本研究利用EST-SSR对种间杂种进行鉴定,部分EST-SSR引物在父母本及F1的扩增结果表明种间F1具有双亲的共有条带,显示其标记的共显性特征,通过分子手段进一步验证了种间杂种的真实性。

图4 不同 EST-SSR引物在P1 (C. baccatum PI441570)、P2 (C. frutescens PI634826) 及杂种 F1 的电泳结果
因此,C.baccatum×C.frutescens种间杂种的获得,为深入开展不同栽培种种间优异基因的转移、分子遗传图谱构建、新材料创制和聚合育种奠定了基础。同时,为下一步开展C.annuum×(C.baccatum×C.frutescens)三元杂交提供了可能。

