17a-羟化酶/17, 20-碳裂解酶部分缺陷合并肾上腺腺瘤1例报道
崔庆鹏,刘孝东,罗钰辉,李同海,李显永,雷银,吴汶钊,李天杰
0 引言
17a-羟化酶/17, 20-碳裂解酶缺陷症是一种非常罕见的常染色体隐性遗传的先天性肾上腺增生疾病,由CYP17A1基因变异导致[1]。临床症状主要表现为高血压、低血钾、男性假两性畸形[2]。17a-羟化酶/17, 20-碳裂解酶缺陷合并肾上腺腺瘤则更加罕见,相似病例国内外仅见少量报道[3-5]。现将昆明医科大学第一附属医院收治的1例病例报道如下。
1 病例资料
患者社会性别为女性,20岁,主诉2年前单位体检时发现血压升高,最高血压达到180/110 mmHg,在我院门诊诊断为“高血压原因待查”,给予“硝苯地平30 mg、贝那普利10 mg和比索洛尔5 mg,均口服,1次/天”治疗,并行腹部超声示:左侧肾上腺区实性结节(皮质腺瘤可能),患者未特殊处理。2017年2月14日,患者再次到我院就诊,因“血压升高2年,发现肾上腺占位2年”,门诊以“肾上腺皮质腺瘤”收入我科。既往史:2015年2月10日行隐睾切除术。家族史:父母为表亲结婚。入院查体:脉搏110次/分,血压147/97 mmHg,乳房TanneⅠ级,阴、腋毛缺如,外阴幼女型。辅助检查:动态血压示:监测时间内高血压,昼夜节律存在。CT示:左侧肾上腺增厚并占位,形态规整,边界清楚,最大径约4.1 cm×1.3 cm,增强期强化明显,见图1。实验室检查:雌二醇17.00 pg/ml(参考值:11~14 pg/ml);促黄体生成素33.4 mUI/ml(参考值:0.57~12.07 mUI/ml);促卵泡生成素54.98 mUI/ml(参考值:1.37~13.58 mUI/ml);孕酮5.90 ng/ml(参考值:<0.1 ng/ml);催乳素26.92 ng/ml(参考值:3.46~19.40 ng/ml);睾酮0.13 ng/ml(参考值:1.43~9.23 ng/ml);促肾上腺皮质激素:38.42 pmol/L(参考值:1.58~13.94 pmol/L);血浆皮质醇:165 nmol/L(参考值:170~440 nmol/L);24 h尿游离皮质醇:435 mmol/L(参考值:108~961 mmol/L);立位肾素活性:0.21 μg/(L.h)。醛固酮卧立位实验:(1)卧位:血管紧张素Ⅰ:0.94 ng/ml(参考值:1.68±1.12 ng/ml);血管紧张素Ⅱ:25.96 pg/ml(参考值:50.1±21.5 pg/ml);醛固酮:261.30ng/ml(参考值:45~175 ng/ml);(2)立位:血管紧张素Ⅰ:1.66 ng/ml(参考值:1.68±1.12 ng/ml),血管紧张素Ⅱ:30.14 pg/ml(参考值:50.1±21.5 pg/ml);醛固酮:287.09 ng/ml(参考值:98~275 ng/ml);术前血钾3.03 mmol/l;术后血钾:2.13 mmol/L(参考值:3.5~5.5 mmol/L)。染色体核型分析:46,XY。治疗方法:术前给予补液扩容,控制血压、心率,螺内酯、氯化钾补钾,补充糖皮质激素等处理,于2017年2月17日行后腹腔镜左侧肾上腺肿瘤切除术,术后给予补钾及糖激素负反馈治疗。术后病理结果示:左侧肾上腺皮质腺瘤,大小约4.5 cm×3.0 cm×1.5 cm。免疫组织化学结果:CK(-)、CK8(-)、Syn(+)、CgA(-)、CD56(+)、NSE(+)、S-100(-)、Inhibin(+)、Ki-67(+)1%~3%,见图2。诊断结果:(1)左侧肾上腺皮质腺瘤;(2)17a-羟化酶/17,20-碳裂解酶部分缺陷症;(3)高血压3级高危组;(4)双侧隐睾切除术后。随访:术后3月随访患者血压、血钾恢复正常,但患者拒绝复查内分泌指标。
2 讨论
17a-羟化酶/17,20-碳裂解酶缺陷症由CYP17A1基因突变导致孕酮、睾酮雌激素等激素分泌异常造成,可分为17a-羟化酶/17,20-碳裂解酶的完全联合性缺陷,两种酶的部分联合性缺陷及17,20碳链裂解酶孤立性缺陷症。在临床表现上,部分缺陷者可有部分性腺功能。CYP17A1是一种微粒体细胞色素酶P450c17, 它同时具有羟化酶和裂解酶活性。羟化酶可使孕烯醇酮和孕酮转化为皮质醇的前体物质17-羟孕烯醇酮和孕酮, 裂解酶活性可使17和20位碳链裂解产生雌激素。该酶缺乏时,上述激素合成均受到影响,同时负反馈刺激下丘脑和垂体分泌大量促肾上腺激素释放激素及促肾上腺激素导致肾上腺皮质增生,造成该酶的前体底物堆积,诱发性分化异常和不同程度的肾上腺皮质功能减低,使患者表现出高血压、低血钾、男性外生殖器女性化、肾上腺增生等一系列表现[2]。本例患者促黄体生成素、促卵泡生成素、雌二醇、孕酮、催乳素均有不同程度增高,睾酮、肾素活性有不同程度降低,并表现为高血压、低血钾、男性假两性畸形,符合17a-羟化酶/17,20-碳裂解酶缺陷症的诊断,且有部分性腺功能,可诊断为部分性缺陷。但最准确的诊断则为CYP17A1基因变异的检测。一般认为CYP17A1功能缺陷时,肾素活性受到影响,醛固酮合成下降。但也有学者认为该酶的功能受累程度越严重,肾上腺束状带中皮质酮甲基氧化酶活性越强,醛固酮合成量越大[6]。本例患者卧立位实验醛固酮均增加,但由于肾上腺皮质腺瘤也会导致醛固酮分泌量增加,故不能明确其醛固酮增加是来源于何种疾病,也干扰了醛固酮腺瘤的诊断。Olsen等[7-8]也认为类固醇生成酶的缺陷会使肾上腺肿瘤的发病概率增高,并且给予皮质醇补充治疗可以减少先天性肾上腺增生患者继发肾上腺肿瘤的风险。Huerta等[9]认为促肾上腺皮质激素分泌过多及肾上腺皮质对促肾上腺皮质刺激的高反应性可能是先天性肾上腺增生并发肾上腺肿瘤的重要原因。吴朝明[4]也认为对先天性肾上腺皮质增生病例早期诊断并给予足量的甾体化合物,则有可能防止肾上腺皮质肿瘤的发生。Kurtoğlu等[10]也报道了一例先天性肾上腺增生患者糖皮质激素用量不足而发生肾上腺皮质腺瘤的病例。

图1 患者肾上腺CT图像Figure1 CT of adrenal gland of the patient
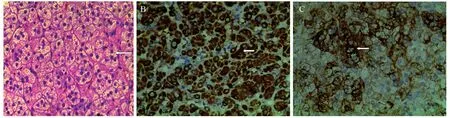
图2 患者病理(A)及免疫组织化学(B,C)图片Figure2 Pathological(A) and immunohistochemical staining(B,C) pictures of the patient
对于先天性肾上腺增生患者合并肾上腺肿瘤是否行手术治疗,目前并没有明确的指南,大多来源与个案报道的经验之谈。由于其临床内分泌症状可能来自先天性肾上腺增生,也可能来自并发的肾上腺肿瘤。因此应该慎重以肿瘤是否具有内分泌功能来作为手术指征。我国2014版《中国泌尿外科疾病诊断治疗指南》认为对于肾上腺偶发肿瘤,肿瘤具有内分泌功能及肿瘤直径>4 cm均是手术指征[11]。我们认为这对于先天性肾上腺皮质增生合并肾上腺肿瘤也具有参考意义。Speiser等[12]研究结果也显示先天性肾上腺皮质增生合并肾上腺肿瘤时绝大多数是良性肿瘤,恶性肿瘤的发生率仅0.06/105~0.167/105,故肿瘤>4 cm或具有内分泌功能可行手术治疗,其他情况并不推荐手术治疗,并且该研究还认为肾上腺皮质激素替代治疗可使肿瘤缩小甚至消失,从而不必手术。本例患者长期有药物难以控制的高血压,且CT示肿瘤>4 cm,因此具有手术指征。王剑松等[5]则报道了一例21-羟化酶缺乏症并肾上腺皮质癌的患者,术后病理明确肾上腺恶性肿瘤的诊断。因此对于17a-羟化酶/17,20-碳裂解酶缺陷合并肾上腺肿瘤的患者来说,无手术指征者可给予糖皮质激素替代治疗,同时注意控制血压,维持电解质平衡,必要时可补充性激素;有手术指征者可行手术治疗,明确肿瘤类型,术后根据情况是否继续内科治疗。
综上所述,虽然17a-羟化酶/17,20-碳裂解酶缺陷合并肾上腺腺瘤十分罕见,但对于先天性肾上腺皮质增生的患者,早期诊断及足量的肾上腺皮质激素替代治疗对于预防继发肾上腺肿瘤可能十分重要,并且对于先天性肾上腺皮质增生患者随访中可复查肾上腺CT。

