中国乌骨鸡微卫星位点LEI0258多态性研究
黄勋和 赵雪敏 柯振华 陈龙星 李纪泰 段岩丽 钟福生

摘要:应用微卫星位点LEI0258研究我国乌骨鸡的遗传多态性与分子进化。以8种乌骨鸡和4种黑羽鸡为研究材料,通过基因分型与测序,构建中介网络图,分析乌骨鸡的遗传多样性并探讨其起源。240份样品共检测到67个等位基因,片段长度为181~507 bp。乌骨鸡保持着与黑羽鸡相当的遗传变异水平,观察杂合度、期望杂合度和多态信息含量分别为0.813、0.962、0.957。经测序鉴定出38个等位基因,部分等位基因为个别乌骨鸡品种所特有。10个等位基因与25种已知MHC血清型相匹配。基于侧翼区变异信息的中介网络图将38个等位基因分为6条进化枝,未发现乌骨鸡特有的进化枝。研究结果为乌骨鸡的保种选育与开发利用及起源进化研究提供了理论基础。
关键词:乌骨鸡;微卫星位点;LEI0258;多态性;进化
中图分类号: S831.2 文献标志码: A 文章编号:1002-1302(2019)05-0040-06
收稿日期:2017-11-07
基金项目:广东省自然科学基金项目(编号:2014A030307018);广东省公益研究与能力建设项目(编号:2015A020208020、2016A030303068);嘉应学院省市共建重点建设项目[编号:嘉院(2017)27号]。
作者简介:黄勋和(1982—),男,广东河源人,博士,副教授,主要从事家鸡遗传资源与进化研究。E-mail:hxh826@jyu.edu.cn。
通信作者:钟福生,博士,教授,主要从事动物生产与畜牧工程。E-mail:zfs@jyu.edu.cn。
微卫星位点LEI0258是近年来逐渐应用于家鸡遗传多样性与分子进化的遗传标记,与常规的微卫星不同,LEI0258由R13(CTATGTCTTCTTT)和R12(CTTTCCTTCTTT)2个重复单元组成,同时侧翼区转换、颠换或缺失等变异较多,因而该位点具有较高的多态性[1-6]。微卫星位点LEI0258定位于鸡16号染色体的主要组织相容性复合体B区域(major histocompatibility complex B region,MHC-B),其遗传多态性通常与宿主的抗病能力呈正相关[7-8],并且与MHC-B血清型有较好对应关系[9]。因此,微卫星位点LEI0258对于评估保育群体的遗传多样性水平与保护潜力具有一定的参考价值。
乌骨鸡是独具中国特色的畜禽品种之一,因其特有的药用价值和我国的饮食文化,在近千年的环境选择及人工培养下,形成了近20个体型外貌、生产性能各异的地方品种[10]。微卫星与线粒体DNA研究表明乌骨鸡具有较高的遗传多样性水平[11-13],而乌骨鸡LEI0258多态性的研究尚属空白。本研究在应用微卫星位点LEI0258对我国主要乌骨鸡品种进行遗传多态性与分子进化分析,评估保育鸡种的遗传变异水平,探讨乌骨鸡的遗传起源,为乌骨鸡的保种选育与利用提供科学理论依据。
1 材料与方法
1.1 材料与试剂
乌骨鸡(乌鸡)及黑羽鸡(非乌骨鸡)样品采自各自保种场,每个品种20羽(表1),翅下静脉取血,终浓度70%的乙醇于-80 ℃保存,采用传统的酚氯仿法提取基因组DNA,PCR相关试剂购自宝生物工程(大连)有限公司,引物由广州艾基生物技术有限公司合成。
1.2 PCR扩增与基因分型
扩增引物序列参照McConnell等的序列[1],正向引物5′端添加FAM荧光标记。PCR扩增体系为30 μL:3.0 μL 10×PCR buffer,2.4 μL dNTP mixture(2.5 mmol/L),上、下游引物(20.0 μmol/L)各0.3 μL,0.3 μL rTaq酶(5 U/μL),50~100 ng 模板DNA,灭菌ddH2O补齐至30 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃ 30 s,63 ℃ 1 min,72 ℃延伸 1 min,38个循环;72 ℃延伸7 min。经1.5%琼脂糖凝胶电泳检测后送上海翼和应用生物技术有限公司ABI 3730平台进行基因分型。
1.3 等位基因测序
根據基因分型的结果,参照黄勋和等的方法[5]挑选测序样品,送广州艾基生物技术有限公司进行双向测序。
1.4 统计分析
观察杂合度(observed heterozygosity,Ho)、期望杂合度(expected heterozygosity,HE)、多态信息含量(polymorphic information content,PIC)、等位基因数(NA)和等位基因频率等由软件Cervus 3.0.3[14]统计。为与黄羽鸡[5]进行比较,应用软件ADZE 1.0[15]对等位基因多态性进行稀释处理。使用软件MEGA 6.0[16]执行序列比对。去掉重复序列后,使用软件SplitsTree 4.10[17]构建基于侧翼序列的中介网络图(median-joining network),进化枝的命名参考Chazara等[2]和黄勋和等[5-6]的方法。
2 结果与分析
2.1 基因型多态性
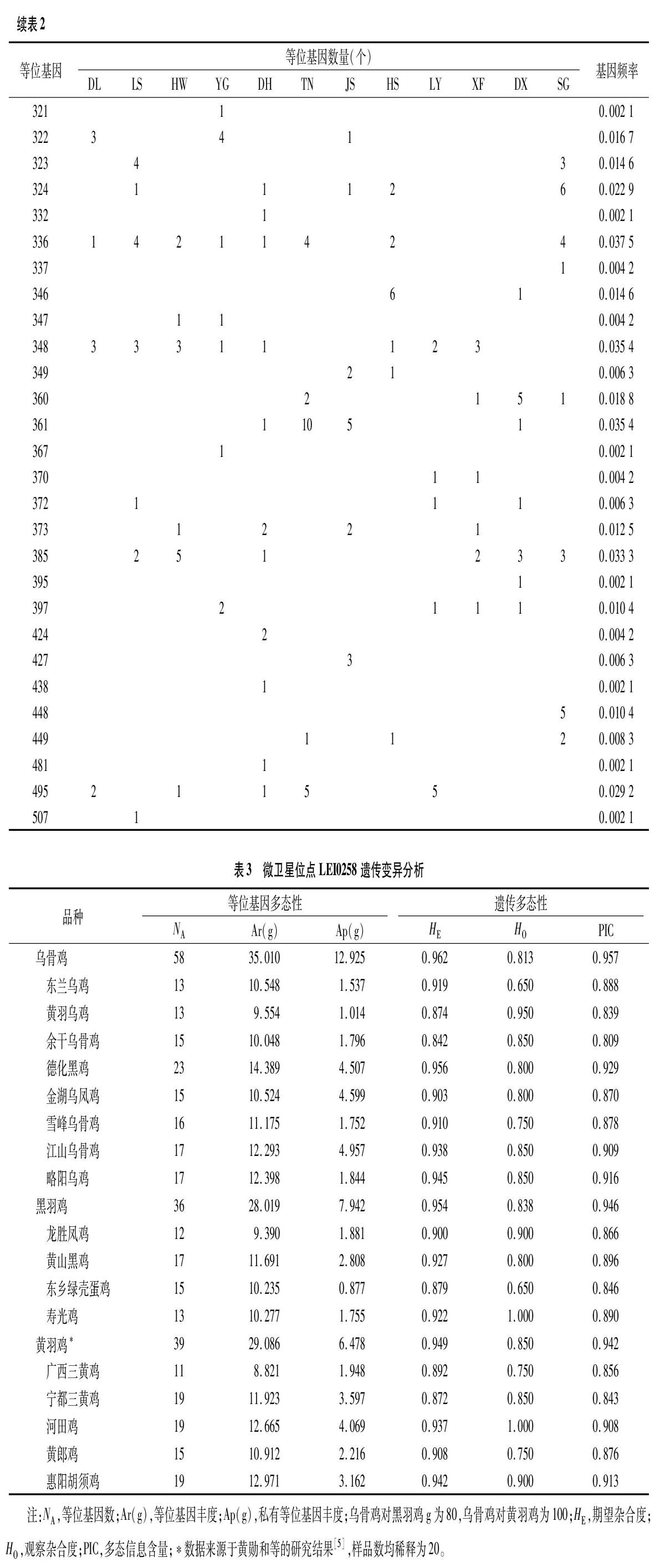
240个样品基因分型共检测出67个等位基因,片段大小范围为181~507 bp,频率最高的是等位基因205,为0.104 2,其次是193(0.068 8)和310(0.064 6)(表2)。乌骨鸡观察杂合度、期望杂合度和多态信息含量分别为0.813、0.962和0.957,与黑羽鸡和黄羽鸡相当,表明中国乌骨鸡保持着较高的遗传变异水平(表3)。其中,德化黑鸡的多态信息含量最高(0.929),余干乌骨鸡最低(0.809)。德化黑鸡的等位基因丰度最高(14.389),黄羽乌鸡最低(9.554);江山乌骨鸡的私有等位基因丰度最高(4.957),黄羽乌鸡最低(1.014)。乌骨鸡的等位基因丰度与私有等位基因丰度均高于黑羽鸡和黄羽鸡(表3)。
2.2 核苷酸序列分析
抽检67个样品进行双向测序,共检测出38个等位基因,片段大小在193~501 bp,其中10个为首次发现(表4)。3个等位基因与毛细管电泳分型结果一致,分别是193、205和237。微卫星位点LEI0258由2个重复单元R13(CTATGTCTTCTTT)和R12(CTTTCCTTCTTT)组成,重复次数分别1~17次和3~28次。R13上游有55 bp(不含引物序列),含有8个变异位点,以转换为主,但在-29~-30出现了“TT”缺失的现象。R12下游有53 bp(不含引物序列),含有5个变异位点,以颠换为主,5碱基位置出现了T/C转换的现象。部分等位基因出现下游11~18位置“ATTTTGAG”缺失的现象,但仅限于小于241 bp的等位基因。等位基因261在11~18突变为ATTTTGGG,不同于Fulton等报道的“ATTTGAG”[9],但与Han等[3]、黄勋和等[5-6]的报道相同。
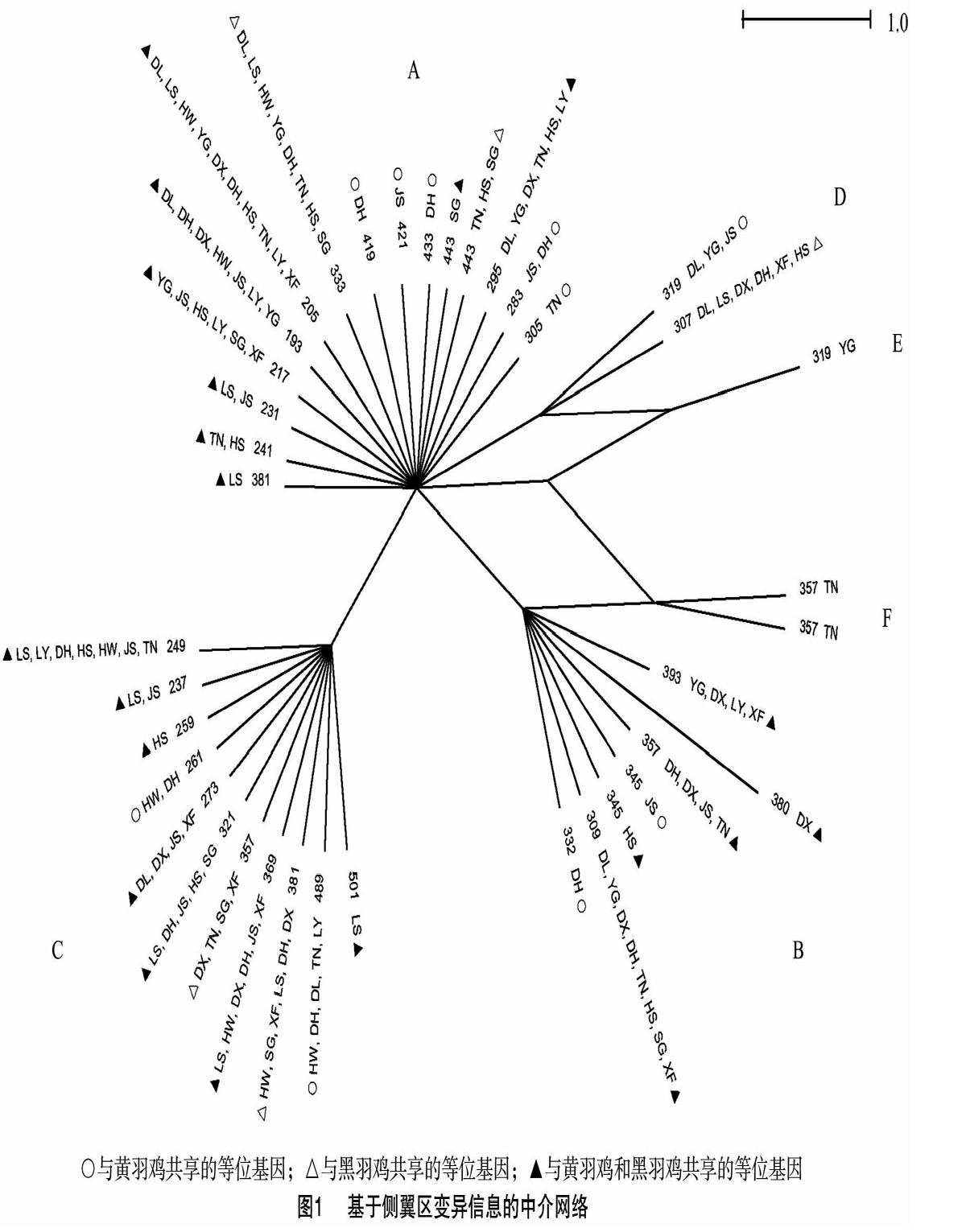
2.3 侧翼区中介网络图分析
去掉R13、R12重复序列后,构建侧翼区变异信息的中介网络图(图1)。38个等位基因可分为6条进化枝(A-F),每条进化枝有1~15个等位基因。其中,A枝的等位基因最多,为15个;E枝只含有1个等位基因。有些等位基因只出现在特定的乌骨鸡品种,如419(德化黑鸡)、421(金湖乌凤鸡);而有些等位基因则分布在多个乌骨鸡品种,如193、205、249和333。每条进化枝均有黄羽鸡与乌骨鸡共享的等位基因,其中A、B、C同样存在于红原鸡中[2,9]。10个等位基因的血清型分别与25种MHC单倍型相对应,分布在A、B、D和E进化枝中,其中2个等位基因为黑羽鸡特有(表4)。
3 讨论与结论
乌骨鸡是我国宝贵的家禽遗传资源,具有重要的经济价值和科学研究价值。微卫星位点是家鸡品种保育效果动态监测的重要遗传标记[18-19]。微卫星LEI0258遗传变异分析显示,乌骨鸡保持着与黑羽鸡相当的遗传多样性水平(表3),表明乌骨鸡保育状态较好,有利于后续的保种选育与开发利用。从期望杂合度、观察杂合度和多态信息含量可以看出,与常规微卫星相比,微卫星LEI0258位点普遍具有较高的遗传变异性[5-6],这可能与所选研究样本以及遗传标记不同有关。
微卫星位点LEI0258特异等位基因可作为品种鉴定的参考依据[3,5-6]。乌骨鸡具有较高的营养价值,为提高生长生产性能和营养价值,各地开展了乌骨鸡品种保种选育和新品系培养等工作。但市面上出现了许多良莠不齐的商品鸡冒充地方乌骨鸡品种,给鉴定工作带来了极大的困扰。本研究发现,少数等位基因为个别品种所特有,如260(黄山黑鸡)、308(金湖乌凤鸡)。将来还需加大研究样品量以鉴定更多的品种特异等位基因,同时联合其他分子标记[20-23]以及外貌特征开展品种鉴定检测工作。
乌骨鸡具有较强的环境适应能力,在我国大部分省份均有分布。MHC遗传变异性通常与家禽抗病能力密切相关[24-26],而微卫星位点LEI0258等位基因与MHC单倍型有较强的相关性[9]。本研究根据已有材料整理了乌骨鸡微卫星位点LEI0258等位基因血清型与MHC單倍型的对应关系,后续还需开展乌骨鸡MHC单倍型相关的试验鉴定工作。
家鸡驯化的起源地和时间迄今仍存在较大争议[27-33],基于侧翼区的中介网络图反映了等位基因之间的关系[34],对系统进化研究亦有一定的参考价值[5-6]。在乌骨鸡所有的进化枝中,均存在与黑羽鸡和黄羽鸡共享的等位基因(图1),乌骨鸡难以从家鸡中完全分离出来,提示乌骨鸡可能是从家鸡选育而来,但具体从哪些品种选育而来、具体选育时间等信息则需进一步研究。红原鸡也有部分等位基因分布于进化枝A、B和C中[2,9],表明红原鸡是这些家鸡的共同祖先。将来需要加大乌骨鸡品种覆盖度和样品数量,从黑色素等特色基因全基因组角度探讨乌骨鸡的起源与扩散历史。
致谢:感谢华南农业大学张细权教授与何丹林高级实验师、安徽农业大学耿照玉教授、广西大学夏中生教授与杨秀荣教授、江西省农业科学院武艳平博士、山东农业大学李显耀教授提供样品,以及广东海洋大学杜炳旺教授、福建农林大学李昂教授在采集样品时提供的帮助。
参考文献:
[1]McConnell S K,Dawson D A,Wardle A,et al. The isolation and mapping of 19 tetranucleotide microsatellite markers in the chicken[J]. Animal Genetics,1999,30(3):183-189.
[2]Chazara O,Chang C S,Bruneau N A,et al. Diversity and evolution of the highly polymorphic tandem repeat LEI0258 in the chicken MHC-B region[J]. Immunogenetics,2013,65(6):447-459.
[3]Han B,Lian L,Qu L J,et al. Abundant polymorphisms at the microsatellite locus LEI0258 in indigenous chickens[J]. Poultry Science,2013,92(12):3113-3119.
[4]金丽娜,韩建林. 鸡MHC区域内微卫星LEI0258和MCW0312的遗传多态性[J]. 畜牧与兽医,2015,47(7):50-55.
[5]黄勋和,李丽芝,张金枫,等. 华南家鸡MHC-B区域复合微卫星位点LEI0258的遗传多样性与进化研究[J]. 畜牧兽医学报,2016,47(11):2175-2183.
[6]黃勋和,张金枫,谭坤凤,等. 五华三黄鸡MHC-B区域复合微卫星位点LEI0258遗传多样性与进化研究[J]. 广东农业科学,2016,43(6):163-168.
[7]Bacon L D,Hunt H D,Cheng H H. Genetic resistance to Mareks disease[J]. Current Top Microbiology Immunogenetics,2001,255:121-141.
[8]Lee L F,Bacon L D,Yoshida S,et al. The efficacy of recombinant fowlpox vaccine protection against Mareks disease:Its dependence on chicken line and B haplotype[J]. Avian Diseases,2004,48(1):129-137.
[9]Fulton J E,Juul-Madsen H R,Ashwell C M,et al. Molecular genotype identification of the Gallus gallus major histocompatibility complex[J]. Immunogenetics,2006,58(5/6):407-421.
[10]国家畜禽遗传资源委员会. 中国畜禽遗传资源志:家禽志[M]. 北京:中国农业出版社,2011.
[11]汤青萍,陈宽维,李慧芳,等. 应用微卫星标记对12个中国地方乌骨鸡品种遗传多样性的研究[J]. 畜牧兽医学报,2005,36(8):755-760.
[12]魏 麟,刘胜贵,史宪伟. 雪峰乌骨鸡自然群体遗传多样性的微卫星分析[J]. 生物多样性,2008,16(5):503-508.
[13]徐文娟,朱文奇,束婧婷,等. 我国主要乌骨鸡品种遗传多样性和系统进化研究[J]. 中国畜牧杂志,2014,50(23):10-14.
[14]Kalinowski S T,Taper M L,Marshall T C. Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J]. Molecular Ecology,2007,16(5):1099-1106.
[15]Szpiech Z A,Jakobsson M,Rosenberg N A. ADZE:a rarefaction approach for counting alleles private to combinations of populations[J]. Bioinformatics,2008,24(21):2498-2504.
[16]Tamura K,Stecher G,Peterson D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725-2729.
[17]Huson D H,Bryant D. Application of phylogenetic networks in evolutionary studies[J]. Molecular Biology and Evolution,2006,23(2):254-267.
[18]Groeneveld L F,Lenstra J A,Eding H,et al. Genetic diversity in farm animals - a review[J]. Animal Genetics,2010,41(1):6-31.
[19]张跟喜,丁馥香,王金玉,等. 利用微卫星标记分析边鸡遗传多样性及保种效果[J]. 农业生物技术学报,2010,18(5):944-950.
[20]Yacoub H A,Fathi M M,Sadek M A. Using cytochrome b gene of mtDNA as a DNA barcoding marker in chicken strains[J]. Mitochondrial DNA,2015,26(2):217-223.
[21]黄勋和,陈洁波,何丹林,等. DNA条形码技术鉴定中国地方鸡品种的重新评估[J]. 中国农业科学,2016,49(13):2622-2633.
[22]秦玉梅,任 嵩,李佳玉,等. 鸡FSHβ、ESRα基因多态性及其合并基因型与产蛋性能的关联性分析[J]. 江苏农业学报,2017,33(4):854-862.
[23]陶志云,徐文娟,朱春红,等. 高邮鸭GH基因SNP位点及其与早期体质量的相关性[J]. 江苏农业学报,2017,33(1):146-150.
[24]Rogers S L,Kaufman J. High allelic polymorphism,moderate sequence diversity and diversifying selection for B-NK but not B-lec,the pair of lectin-like receptor genes in the chicken MHC[J]. Immunogenetics,2008,60(8):461-475.
[25]李福伟,逯 岩,雷秋霞,等. 山东地方鸡MHCB-F基因遗传变异与免疫性状相关性研究[J]. 农业生物技术学报,2013,21(2):179-184.
[26]Wang H Z,Ma T,Chang G B,et al. Molecular genotype identification of different chickens:major histocompatibility complex[J]. Journal of Science and Technology,2014,2:1-7.
[27]Liu Y P,Wu G S,Yao Y G,et al. Multiple maternal origins of chickens:out of the Asian jungles[J]. Molecular Phylogenetics and Evolution,2006,38(1):12-19.
[28]Miao Y W,Peng M S,Wu G S,et al. Chicken domestication:an updated perspective based on mitochondrial genomes[J]. Heredity,2013,110(3):277-282.
[29]Xiang H,Gao J Q,Yu B Q,et al. Early holocene chicken domestication in Northern China[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(49):17564-17569.
[30]Peng M S,Shi N N,Yao Y G,et al. Caveats about interpretation of ancient chicken mtDNAs from Northern China[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(16):E1970-E1971.
[31]Peters J,Lebrasseur O,Best J,et al. Questioning new answers regarding Holocene chicken domestication in China[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(19):E2415.
[32]Eda M,Lu P,Kikuchi H,et al. Reevaluation of early Holocene chicken domestication in Northern China[J]. Journal of Archaeological Science,2016,67:25-31.
[33]Peters J,Lebrasseur O,Deng H,et al. Holocene cultural history of red jungle fowl (Gallus gallus) and its domestic descendant in East Asia[J]. Quaternary Science Reviews,2016,142:102-119.
[34]E G X,Sha R,Zeng S C,et al. Genetic variability,evidence of potential recombinational event and selection of LEI0258 in chicken[J]. Gene,2014,537(1):126-131.劉雪娇,贾田惠,高同国,等. 贝莱斯芽孢杆菌3A3-15电击转化条件优化[J]. 江苏农业科学,2019,47(5):46-49.

