恶味乳杆菌B2的益生特性及安全性评价
魏朝治 裘纪莹 陈蕾蕾 陈相艳 刘孝永 辛雪

摘要:研究具有生物转化银杏花粉黄酮苷活性的恶味乳杆菌B2的益生特性和安全性。结果表明,该菌具有较好的β-葡萄糖苷酶活性和体外脱除胆固醇能力,对酸和人工模拟胃液的耐受性较好,而对胆盐和人工模拟肠液的耐受性一般;同時该菌对10种常见抗生素不具有耐药性,并且不携带耐药基因,不具备硝酸盐还原酶、氨基脱羧酶活性,不产生吲哚等有害代谢产物,因此该菌安全性较高。
关键词:恶味乳杆菌B2;β-葡萄糖苷酶;益生特性;安全性;耐药性
中图分类号: TS201.3 文献标志码: A 文章编号:1002-1302(2019)05-0162-04
收稿日期:2017-12-11
基金项目:山东省农业科学院创新工程(编号:CXGC2017B06);山东省泰山学者工程项目;山东省农业科学院青年英才培养计划;山东省自然科学基金三院联合基金(编号:ZR2014YL020、ZR2016YL022)。
作者简介:魏朝治(1992—),男,山东济宁人,硕士研究生,主要从事食品微生物研究。E-mail:wczwcz0220@163.com。
通信作者:辛 雪,助理研究员,主要从事农产品加工研究。E-mail:jasmine811201@126.com。
乳酸菌(lactic acid bacteria,简称LAB)是一类能利用可发酵碳水化合物产生大量乳酸的细菌通称。这类细菌在自然界分布极为广泛,具有丰富的物种多样性,是公认的安全性菌株(generally recognized as safe,简称GRAS)。乳酸菌不仅可应用于食品发酵行业,同时也能调节机体胃肠道正常菌群、保持微生态平衡等,与机体的生命活动息息相关[1]。但近年来研究发现,一些乳酸菌具有抗生素抗性,甚至有些菌株出现了多重耐药性[2]。
恶味乳杆菌B2是从手工泡菜中筛选到的1株能够生物转化银杏花粉黄酮苷的优良菌株,其培养条件简单,易存活,产酸能力适中,口感较好,可用于活菌型功能性银杏花粉产品的研制。但目前文献报道缺乏关于恶味乳杆菌益生特性和安全性方面的研究。因此,本试验以自主分离的1株恶味乳杆菌B2为研究对象,以β-葡萄糖苷酶活性、降解胆固醇能力以及耐酸、耐胆盐、耐模拟肠胃液能力和耐药性、有害代谢产物分析等为手段,开展其益生特性和安全性评价,旨在为进一步开发恶味乳杆菌资源提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株来源 试验用菌株为恶味乳杆菌B2,是由笔者所在实验室自手工泡菜中分离得到的1株能够转化银杏花粉黄酮苷的优良菌株。
1.1.2 培养基与试剂 乳酸细菌(MRS)培养基[3]用于菌株活化、培养,MRS-胆固醇(MRS-CHOL)培养基[4]用于体外降解胆固醇试验,药敏纸片购自杭州微生物试剂有限公司,对硝基苯酚(p-NP)、对硝基苯基β-D-葡萄糖苷(p-NPG)、磷酸氢二钠、柠檬酸等均为分析纯。
1.1.3 仪器与设备 CR22GⅢ高速冷冻离心机,日本日立公司生产;SHP-150生化培养箱,上海精宏实验设备有限公司生产;Mettler AE240电子分析天平,梅特勒-托利多仪器(上海)有限公司生产;UV-160型紫外可见分光光度计,日本岛津公司生产。
1.2 试验方法
1.2.1 菌株活化与培养 将菌株划线接种于MRS固体培养基上,37 ℃培养24 h,挑单菌落活化传代2次,经革兰氏染色观察为纯菌后,接种于5 mL MRS液态培养基中,37 ℃静置培养16 h。
1.2.2 β-葡萄糖苷酶活性的测定[5] 粗酶液的制备:将发酵液在8 000 r/min条件下离心20 min,沉淀用pH值为6.0的磷酸氢二 钠- 柠檬酸缓冲液洗涤2遍,离心去上清,沉淀溶于相同缓冲液中,在0 ℃条件下超声间歇粉碎15 min后,10 000 r/min、4 ℃离心20 min,上清液为粗酶液。对硝基苯酚标准曲线的绘制:精准称取0.139 mg对硝基苯酚纯品,溶解于1 mL甲醇溶液中,用pH值为6.0的磷酸氢二钠-柠檬酸缓冲液定容到 100 mL,再稀释为5.0、12.5、25.5、37.5、50.0、75.0 μmol/L等浓度梯度溶液;取100 μL稀释后的pNP溶液,加入100 μL 1 mol/L的Na2CO3溶液,测定其在405 nm处的吸光度,绘制对硝基苯酚标准曲线。β-葡萄糖苷酶活性的测定:将20 μL 25 mmol/L的p-NPG加入到80 μL的粗酶液中,在室温下进行反应,30 min 后加入100 μL浓度为 1 mol/L 的Na2CO3溶液终止反应,测定其在405 nm处的吸光度。根据对硝基苯酚标准曲线回归方程计算生成的对硝基苯酚浓度。一个β-葡萄糖苷酶活性单位(U)定义为在一定的反应条件下,每分钟分解对硝基苯基β-D-葡萄糖苷底物生成1 μmol对硝基苯酚(p-NP)所需要的β-葡萄糖苷酶量。计算公式如下:
U=pNP浓度×反应总体积反应时间×酶液体积×稀释倍数。
1.2.3 体外降解胆固醇能力试验 恶味乳杆菌B2体外降解胆固醇能力的测定参照文献[4]进行。胆固醇工作液的配制:量取一定量的胆固醇配制胆固醇贮存液,并进一步稀释,使胆固醇工作液的终浓度分别为50、100、150、200、250、300、350 μg/mL。标准曲线的制作:取胆固醇工作液和铁铵显色剂各2.5 mL振荡摇匀后,冷却至室温,以冰乙酸加显色剂为空白对照,于560 nm处测定吸光度,以D560 nm为纵坐标,胆固醇含量为横坐标绘制标准曲线。胆固醇含量的测定采用硫酸铁铵法。在MRS-胆固醇(MRS-CHOL)液体培养基中接入1%(体积比)的乳酸菌,37 ℃培养24 h,离心(8 000 r/min、4 ℃、10 min),获取上清液;用5 mL去离子水洗涤菌体沉淀(2次),离心(8 000 r/min、4 ℃、10 min),获得沉淀洗涤液;分别取上清液和沉淀洗涤液0.3 mL于离心管中,加入3.7 mL冰乙酸充分混匀,13 000 r/min离心 5 min;取上清液2.5 mL于试管中,沿管壁缓缓加入2.5 mL铁铵显色液,室温静置 20 min,然后充分振荡摇匀,测定D560 nm。以未接种乳酸菌的MRS-CHOL培养基代替发酵液为空白。胆固醇的降解率按以下公式计算:
胆固醇的降解率=D空白-D样品D空白×100%。
1.2.4 耐酸、耐胆盐和耐模拟胃肠液试验 参照高盛等的方法[6-7]测定恶味乳杆菌B2的耐酸、耐胆盐、耐模拟胃肠液能力。耐酸试验:將发酵液在8 000 r/min条件下离心20 min,沉淀用0.85%生理盐水洗涤2遍,离心去上清,沉淀重悬于等体积生理盐水中,制成菌悬液。分别将上述菌悬液接种于pH值为1.5、2.5、3.5、4.5的MRS液体培养基中,37 ℃条件下培养0、2、4、6 h,培养后取一定量梯度稀释涂布于MRS平板,37 ℃静置培养48 h后活菌计数,每个稀释度作3个平行。耐胆盐试验:将发酵液在8 000 r/min条件下离心20 min,沉淀用0.85%生理盐水洗涤2遍,离心去上清,沉淀重悬于等体积生理盐水中,制成菌悬液。分别将上述菌悬液接种于含不同浓度牛胆盐的MRS液体培养基(牛胆盐质量分数分别为0%、0.1%、0.2%、0.3%)中,37 ℃条件下培养0、2、4、6 h,培养后取一定量梯度稀释涂布于MRS平板,37 ℃条件下静置培养48 h后活菌计数,每个稀释度作3个平行。耐模拟胃肠液试验:将胃蛋白酶过滤除菌,加入到灭菌的0.5% NaCl溶液中,胃蛋白酶终浓度为3 g/L,分别调节溶液pH值至1.5、2.5、3.5,即为供试的人工胃液;将胰蛋白酶和牛胆盐过滤除菌,加入到灭菌的0.5% NaCl溶液中,胰蛋白酶和牛胆盐终浓度均为 1 g/L,调节溶液pH值至8.0,即为人工肠液;将发酵液在8 000 r/min条件下离心20 min,弃上清,沉淀重悬于MRS液体培养基中,加入等体积的人工胃液或人工肠液,37 ℃ 条件下培养0、2、4、6 h,培养后取一定量梯度稀释涂布于MRS平板上,37 ℃静置培养48 h后活菌计数,每个稀释度作3个平行。
1.2.5 耐药性评价 药敏试验:采用药敏纸片琼脂扩散法进行药敏试验[8]。将100 μL待测菌液均匀涂布于MRS固体平板上,待菌液被完全吸收后放置药敏纸片。供试药敏纸片:购自杭州微生物试剂有限公司,纸片上附有抗生素分别为青霉素、万古霉素、庆大霉素、红霉素、四环素、氯霉素、链霉素、阿莫西林、诺氟沙星、卡那霉素。质粒提取试验:取5 mL待测菌液,使用OMEGA公司质粒提取试剂盒提取质粒;取提取好的质粒液体5 μL加入1 μL 6×Loading buffer,点样于琼脂糖凝胶进行电泳,电泳液为1×TAE溶液,电压为100 V,运行 30 min,电泳结束后,置于254 nm紫外灯下观察。
1.2.6 有害代谢产物试验 吲哚试验:将菌液以2%(体积比)接种量接种于蛋白胨水培养基中,37 ℃培养48 h,滴加吲哚试剂,观测颜色变化情况,以不接菌液的蛋白胨水培养基为空白对照,试验作3次平行。硝酸盐还原酶试验:将菌液以2%(体积比)接种量接种于硝酸盐培养基中,37 ℃条件下培养48 h,滴加碘化钾溶液和淀粉溶液,观察颜色变化情况,以不接菌液的硝酸盐培养基为空白对照,试验作3次平行。氨基脱羧酶活性检测:将菌株划线于添加前体氨基酸(L-鸟氨酸、L-精氨酸、L-赖氨酸)的脱羧酶筛选平板上,以未添加前体氨基酸的脱羧酶筛选平板为对照,37 ℃条件下培养48 h后,观察培养基颜色变化情况,试验作3次平行。
2 结果与分析
2.1 恶味乳杆菌B2的β-葡萄糖苷酶活性
β-葡萄糖苷酶又称β-D-葡萄糖苷葡萄糖水解酶,能够水解结合于末端非还原性的β-D-葡萄糖苷键,释放 β-D-葡萄糖和相应的配基。研究显示,β-葡萄糖苷酶在生物转化黄酮苷中有重要应用,同时,很多生物转化黄酮苷优良菌株具有分泌β-葡萄糖苷酶能力[9-11]。恶味乳杆菌B2能够高效转化银杏花粉黄酮苷,因此检测其β-葡萄糖苷酶活性,可为转化机制研究提供参考。
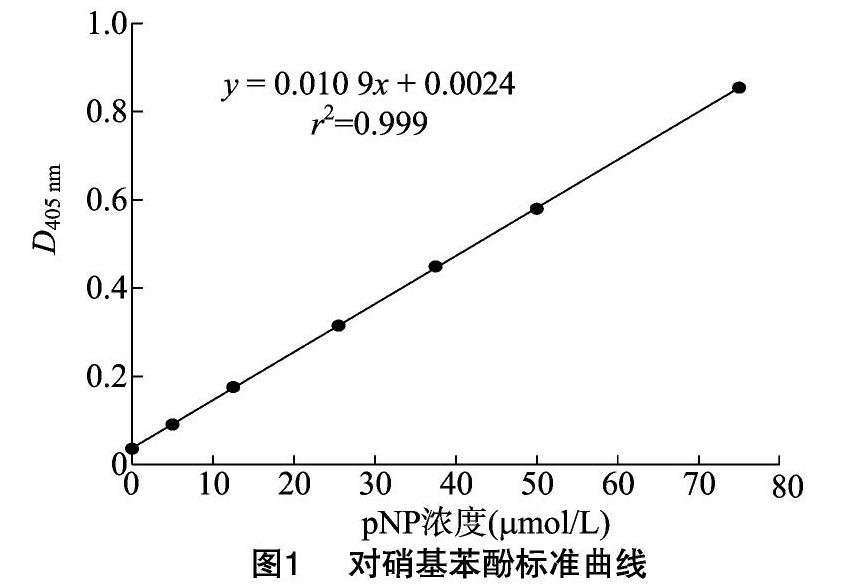
2.1.1 对硝基苯酚标准曲线 以p-NP浓度为横坐标,D405 nm为纵坐标,取3次测量的平均值绘制标准曲线,结果见图1,标准曲线回归方程为y=0.010 9x+0.002 4,r2=0.999。
2.1.2 β-葡萄糖苷酶活性 恶味乳杆菌B2粗酶液经3次平行试验后,测得的D405 nm值为0.283±0.002 7。将数据代入p-NP标准曲线回归方程计算得到,生成的对硝基苯酚浓度为(25.74±0.01) μmol/L。通过计算得到恶味乳杆菌B2的β-葡萄糖苷酶活性为16.09 U。
2.2 恶味乳杆菌B2的耐酸、耐胆盐和耐模拟胃肠液能力
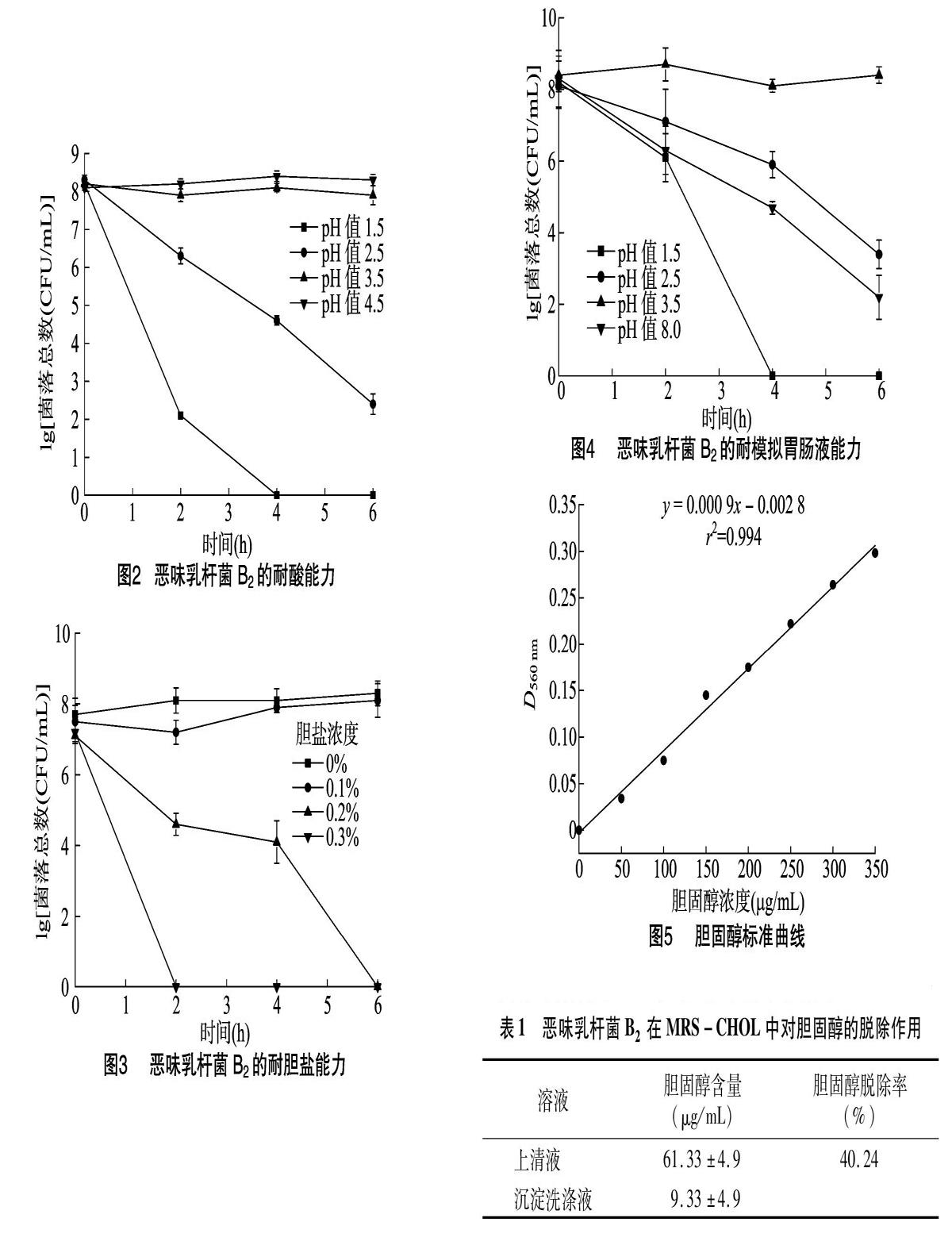
2.2.1 耐酸能力 人体胃液中胃酸的pH值一般在1.5~3.5 之间[7]。从图2可以看出,恶味乳杆菌B2在pH值为35时表现出良好的酸耐受性,6 h内活菌数无明显变化;在pH值为2.5时,每隔2 h,活菌数下降2个数量级,6 h后活菌数下降了6个数量级;当pH值为1.5时,2 h后活菌数下降了6个数量级,4 h后已无活菌检出。说明该菌对酸的耐受性较好,在酸性环境下仍可存活较长时间并保持生长。
2.2.2 耐胆盐能力 小肠中胆盐浓度一般为0.1%~0.3%肠内容物[12]。从图3可以看出,恶味乳杆菌B2在胆盐浓度为0.1%时表现出较好的耐受性,6 h内活菌数与不加胆盐相比无明显差异;在胆盐浓度为0.2%时,2 h后活菌数下降了3个数量级,6 h后无活菌检出;在胆盐浓度为0.3%时,2 h后无活菌数检出。说明恶味乳杆菌B2的胆盐耐受性一般,当胆盐浓度达到0.3%时,该菌无法存活。
2.2.3 耐模拟胃肠液能力 胃液中含有胃蛋白酶和胃酸,所以胃液是一个富含蛋白酶并且低pH值的环境。人体摄入食物后,胃液的pH值会随着胃酸的分泌和消耗在1.5~3.5之间波动。肠液里不仅富含胰蛋白酶和胆盐,而且还是一个微碱环境。胃肠液中存在的酶、胆盐以及酸碱环境对乳酸菌生长都有抑制作用。从图4可以看出,在pH值为3.5的人工模拟胃液中,活菌数在6 h内没有明显变化,都保持在同一数量级。在pH值为2.5的人工模拟胃液中,6 h后活菌数下降了5个数量级。在pH值为1.5的人工模拟胃液中,4 h后已无活菌检出。而在pH值为8.0的人工模拟肠液中,活菌数呈现明显下降趋势,6 h后活菌数下降了6个数量级。可见,恶味乳杆菌B2对人工模拟胃液具有较好的耐受性,但对人工模拟肠液的耐受性一般。
2.3 恶味乳杆菌B2的降胆固醇能力
2.3.1 胆固醇标准曲线 以胆固醇浓度为横坐标,对应吸光度(D560 nm)为纵坐标,取3次测量的平均值绘制标准曲线,结果见图5,标准曲线回归方程为y=0.000 9x-0.002 8,r2=0994。
2.3.2 体外降胆固醇能力 根据胆固醇标准曲线,计算恶味乳杆菌B2在MRS-CHOL培养基中培养24 h后上清液以及沉淀洗涤液中的胆固醇含量。从表1可以看出,恶味乳杆菌B2培养24 h后对胆固醇的脱除率达到40.24%,具有较好的体外降胆固醇能力。但沉淀洗涤液中胆固醇含量较低,表明大量的胆固醇可能被乳酸菌转运至菌株体内,说明该菌株对胆固醇的清除能力主要依靠的是菌体吸收作用[13-14]。
2.4 恶味乳杆菌B2的耐药性
恶味乳杆菌B2的耐药性评价结果见表2。10种抗生素对恶味乳杆菌B2的的抑菌圈直径均≥15 mm,抑菌效果比较明显,因此认为恶味乳杆菌B2不具有耐药性。此外,质粒提取试验结果显示,恶味乳杆菌B2不含有质粒,因此该菌株不携带耐药基因。
2.5 恶味乳杆菌B2的有害代谢产物
色氨酸是人体必需氨基酸,如果菌株分解色氨酸生成吲哚,会引起人体代谢的紊乱。硝酸盐还原酶可将硝酸盐还原成亚硝酸盐,人体摄入过多亚硝酸盐易引起中毒,同时在胃酸的条件下,亚硝酸盐易与胺类物质反应生成强致癌物亚硝胺。氨基脱羧酶可以将氨基酸转化为生物胺,若菌株含有氨基脱羧酶,则可以将L-鸟氨酸、L-精氨酸、L-赖氨酸分别转化为腐胺、精胺、亚精胺、尸胺。过量的生物胺会使人出现恶心、腹痛等食物中毒症状[8,15]。由表3可知,恶味乳杆菌B2不产生吲哚,无硝酸盐还原酶活性,因此不能还原硝酸盐生成亚硝酸盐。同时,恶味乳杆菌B2无氨基脱羧酶活性,不能以
3 讨论与结论
研究结果显示,恶味乳杆菌B2的β-葡萄糖苷酶活性较高,因此可降解银杏花粉黄酮苷中的β-葡萄糖苷键,释放出主要黄酮苷元山奈酚。β-葡萄糖苷酶的活性测定为恶味乳杆菌B2生物转化银杏花粉黄酮苷的机制研究提供依据。益生特性研究结果表明,恶味乳杆菌B2具有良好的体外脱除胆固醇能力,对酸和人工模拟胃液的耐受性较好,而对胆盐和人工模拟肠液的耐受性一般,说明恶味乳杆菌B2可能具有良好的通过胃的能力,但在小肠中的存活性一般。总体来说,恶味乳酸菌B2拥有一定的消化道通过能力,可在消化道存活并行使生理功能。安全性研究结果显示,该菌对10种常见抗生素不具有耐药性,并且不携带耐药基因,同时不具备硝酸盐还原酶活性和氨基脱羧酶,不生成亚硝酸盐、亚硝胺、腐胺、精胺和亚精胺、尸胺等有害成分,不分解色氨酸生成吲哚,安全性较高。
参考文献:
[1]杨 埔,孔文涛,孙芝兰,等. 食源性乳酸菌安全性的评价[J]. 食品科学,2014,35(19):169-173.
[2]孟祥晨,杜 鹏,李艾黎,等. 乳酸菌与乳品发酵剂[M]. 北京:科学出版社,2009.
[3]徐珑倩,胡凯弟,张艾青,等. 植物乳杆菌P158产细菌素培养基及培养条件的优化[J]. 食品科学,2017,38(22):109-116.
[4]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. 食品安全国家标准 食品中胆固醇的测定:GB 5009.128—2016[S]. 北京:中国标准出版社,2016.
[5]金艳娓. 重组高温β-葡萄糖苷酶的酶学性质及协同作用研究[D]. 长春:吉林大学,2013.
[6]高 盛,乔 宇,张宇微,等. 人母乳源乳酸菌的筛选、鉴定及益生活性的初步研究[J]. 食品工业科技,2017,38(10):205-210.
[7]Huang Y,Adams M C. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria[J]. International Journal of Food Microbiology,2004,91(3):253-260.
[8]顾旭峰,艾连中,宋 馨,等. 两株干酪乳杆菌的安全性评价[J]. 食品与发酵科技,2015,51(2):63-65.
[9]王锐丽,孙 伟,薛业敏. 嗜热菌β-葡萄糖苷酶A基因的克隆表达及转化大豆异黄酮糖苷[J]. 中国酿造,2016,35(3):114-119.
[10]赖剑峰,杨荣玲,刘学铭. 黄酮类化合物的生物转化研究进展[J]. 广东农业科学,2013(4):95-98.
[11]张 琴,李艳宾,李 华. 产β-葡萄糖苷酶甘草内生菌的筛选及对甘草黄酮转化的研究[J]. 食品科学,2013,34(1):194-198.
[12]甘 敏. 双歧杆菌胞外多糖益生功能及机理的初步探究[D]. 南昌:南昌大学,2015.
[13]李雪萍,李建宏,李敏权,等. 浆水中降胆固醇乳酸菌的筛选及其功能特性[J]. 微生物学报,2015,55(8):1001-1009.
[14]Dambekodi P C,Gilliland S E. Incorporation of cholesterol into the cellular membrane of Bifdobacterium longum[J]. Journal of Dairy Science,1998,81(7):1818-1824.
[15]Hammerman C,Bin-Nun A,Kaplan M. Safety of probiotics:comparison of two popular strains[J]. British Medical Journal,2006,333(7576):1006-1008.謝冬娣,韦燕佩,宋慕波,等. 咪鲜胺添加纳米TiO2对淮山贮藏品质的影响[J]. 江苏农业科学,2019,47(5):166-169.

