镉胁迫对芹菜生理特性及细胞超微结构的影响
徐劼 段德超
摘要:采用水培试验,研究不同浓度镉(Cd)胁迫下Cd在芹菜不同器官组织中的积累及对芹菜生理生化指标、细胞超微结构的影响。结果表明,Cd浓度为40 mg/L时,芹菜叶、茎、根中的Cd含量相对最高,分别为16.36、65.78、213.06 mg/L;Cd浓度为10 mg/L时,芹菜对Cd的富集和转运能力相对最强,富集系数、转运系数分别为5.83、0.62,同时,叶绿素a、叶绿素b、总叶绿素含量处于最高水平;Cd胁迫导致芹菜叶片细胞壁内侧模糊,轮廓不饱满,淀粉颗粒增大、变多,叶绿体出现肿胀,且基粒类囊体呈波浪状,并处于解离状态,而根尖细胞的细胞基质变稀,液泡数量明显增多,细胞核仁消失,染色质外溢,线粒体出现肿胀;Cd胁迫浓度分别为5、10、20、40 mg/L时,芹菜叶组织中的可溶性蛋白含量分别为清水处理(CK)的98.73%、96.55%、91.28%、86.16%,而根中的蛋白含量分别为对照的99.74%、109.98%、132.76%、157.18%;随Cd胁迫浓度的增大,芹菜的根系活力逐渐降低,与CK相比分别显著下降15.33%、57.72%、58.69%、70.59%(P<0.05)。
关键词:芹菜;镉;富集系数;超微结构;生理特性;转运能力;细胞
中图分类号: X53;S636.301 文献标志码: A 文章编号:1002-1302(2019)05-0095-04
收稿日期:2017-12-12
基金项目:浙江省嘉兴市科技计划(编号:2017BY18065)。
作者简介:徐 劼(1975—),男,辽宁辽阳人,博士,讲师,从事土壤重金属植物污染化学与农产品安全研究。Tel:(0573)83643295;E-mail:xujie1688@126.com。
随着我國经济建设发展加快,环境的重金属污染问题日益凸显。镉(Cd)作为生物活性相对较高的金属元素,移动性强、毒性大,且极易被农作物吸收,对人体健康构成潜在威胁,会产生致畸、致癌、致突变等效应[1]。Cd作为生物毒性最强的重金属之一[2],其引起的环境问题受到广泛关注。
芹菜(Apium graveolens L.)作为大众蔬菜,在我国种植较为广泛。肖旭峰等调查发现,在重金属污染较为严重的工矿、冶金、电镀等企业或工业园区周边,芹菜Cd污染超标现象时有发生[3]。本研究以水培芹菜为试验材料,初步探讨不同Cd浓度胁迫下芹菜各部器官对Cd的富集、吸收及生理响应,进而为芹菜对Cd胁迫的适应性研究及其抗Cd栽培实践提供理论依据及借鉴。
1 材料与方法
1.1 试验材料的准备
津南实芹1号芹菜种子,购于河北青县神华种子有限责任公司。对芹菜种子在温室预先进行育苗培养,待幼苗长出6张真叶,转移至人工气候室进行水培,昼、夜温度分别为25、20 ℃,相对湿度为70%~75%,光照时间为14 h。其间,先采用1/2浓度的营养液培养幼苗1周,随后采用塑料小桶并改用全营养液培养,每桶3株,营养液配方参考文献[4]。
1.2 试验处理
试验于2017年9—12月在嘉兴学院环境工程实验室内进行,芹菜幼苗在全营养液体系培养1周后,分别采用浓度为0(CK)、5、10、20、40 mg/L的硝酸镉溶液进行Cd胁迫处理,每处理重复3次。芹菜苗培养期间,每天用0.1 mol/L NaOH或0.1 mol/L HCl调节处理营养液的pH值为5.5左右,营养液4 d更换1次,并保持24 h通气。Cd胁迫芹菜幼苗培养 14 d,将植株用自来水冲洗以去除根表吸附的Cd及其他离子,用25 mmol/L Na2-EDTA溶液浸泡根系15 min[5];用去离子水将幼苗冲洗干净,用吸水纸吸干水分;部分根、叶样品用于透射电镜样品制备,部分根、茎、叶置于-70 ℃冰箱贮藏,备用。
1.3 测定指标与方法
1.3.1 镉含量 称取根、茎、叶鲜样各0.500 g分别置于 150 mL 三角瓶中,HNO3-HCl-HClO4法消煮完全;1% HCl定容,用美国戴安公司产ICS-2000型电感耦合等离子体发射光谱仪(ICP-AES)测定Cd含量,单位为mg/kg,其中,1 000 mg/L Cd标准液,购于国家环境保护部标准样品研究所,标准参比物质为GBW(E)090066;计算芹菜对Cd的转运系数、富集系数,公式分别为
转运系数=幼苗地上部Cd含量/根Cd含量;
富集系数=地上部Cd含量/处理溶液Cd含量[6]。
1.3.2 生理特性 叶绿素含量参照乙醇-丙酮提取法[7]测定;叶片、根的可溶性蛋白含量参照考马斯亮蓝法[8]测定;根系活力参照氯化三苯基四氮唑(TTC)还原法[9]测定,并计算TTC还原产物三苯基甲腙(TTF)的量,评价植物根系活力[10]。
1.3.3 透射电镜(SEM)观察 本观察在浙江大学农生环测试中心完成。取10 mg/L Cd胁迫处理14 d的芹菜根、叶样品,参照徐劼的方法[11]对芹菜不同器官组织进行前处理及制备:利用切片机将根、叶样品切成80 nm的薄片,切片经醋酸铀-柠檬酸铅双重染色,采用HITACHI H7650型透射电镜进行超微结构观察并拍照。
1.4 数据分析
采用Excel 2010软件对试验数据进行统计整理,采用SPSS 17.0软件对各处理进行最小显著差异法(LSD)差异性检验。
2 结果与分析
2.1 芹菜对镉的富集、转运情况
由表1可知,随Cd胁迫浓度的增加,芹菜叶、茎、根中的Cd含量呈逐渐上升趋势;同一浓度Cd胁迫下,芹菜各器官组织中的Cd含量由低到高依次为叶<茎<根,根对Cd的富集能力相对较强;Cd胁迫浓度为40 mg/L,叶、茎、根中的Cd含量相对最高,分别为16.36、65.78、213.06 mg/kg,显著高于其他处理(P<0.05);Cd胁迫浓度为10 mg/L时,芹菜对Cd的富集、转运系数相对最大,分别为5.83、0.62。
2.2 Cd胁迫下芹菜叶、根细胞的超微结构变化
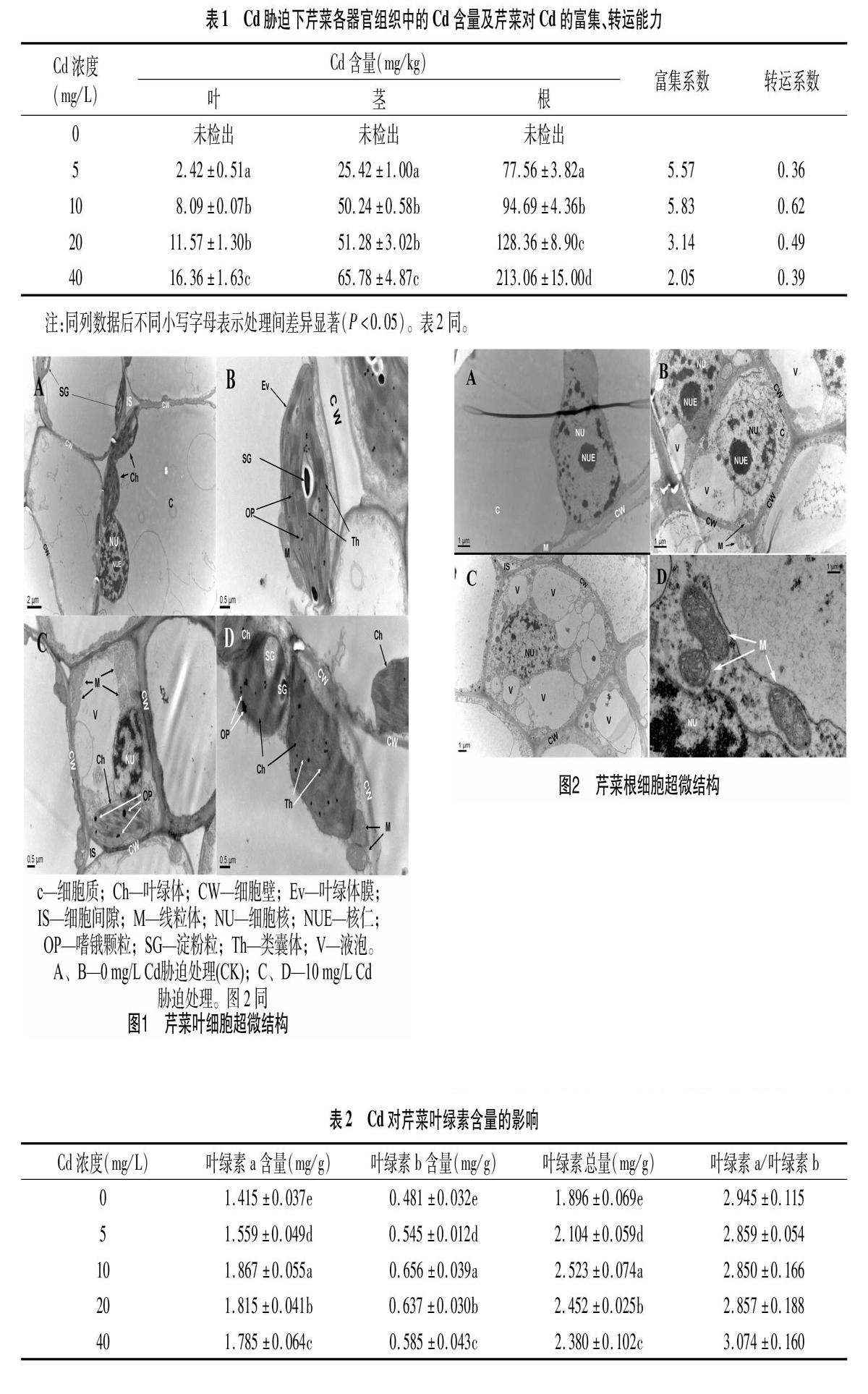
2.2.1 叶细胞超微结构变化 由图1可见,0 mg/L Cd胁迫处理(CK)的芹菜幼苗,其叶细胞中细胞壁与细胞质膜相互紧贴,细胞核完整,核仁清晰可见,核内染色质分布均匀,叶绿体为长梭形,双层被膜结构清晰,且叶绿体中含有一定数量的嗜锇颗粒及较小体积尺寸的淀粉颗粒,叶绿体基质片层结构层次清晰、排列规整;10 mg/L Cd胁迫处理的芹菜叶片细胞超微结构发生较大变化,细胞壁内侧模糊,轮廓不饱满,叶绿体肿胀变形,内部基粒片层结构松散,基粒类囊体疏松呈波浪状排列,叶绿体中淀粉颗粒体积尺寸变大。
2.2.2 根细胞超微结构变化 由图2可见,0 mg/L Cd胁迫处理(CK)的芹菜幼苗根尖组织细胞结构正常,细胞核质界限分明,细胞核结构完整,核仁完整,细胞核内染色质呈均匀分布;10 mg/L Cd胁迫处理的芹菜根组织细胞超微结构产生毒害,根细胞中液泡数量明显增多,细胞核仁消失,核内染色质外溢,胞内线粒体脊突膨胀。
2.3 Cd胁迫对芹菜生理特性的影响
2.3.1 叶绿素含量 由表2可见,10 mg/L Cd胁迫处理时,芹菜叶片叶绿素a、叶绿素b及其总量相对最高,分别为 1.867、0.656、2.523 mg/g,后随Cd胁迫浓度的增加呈下降趋势;随Cd胁迫浓度的增大,叶绿素a与叶绿素b比值呈先降低后上升趋势,这与叶绿素a、叶绿素b含量的变化趋势相反;不同浓度Cd胁迫处理下,芹菜叶片叶绿素a、叶绿素b及叶绿素总量相互间差异显著(P<0.05)。
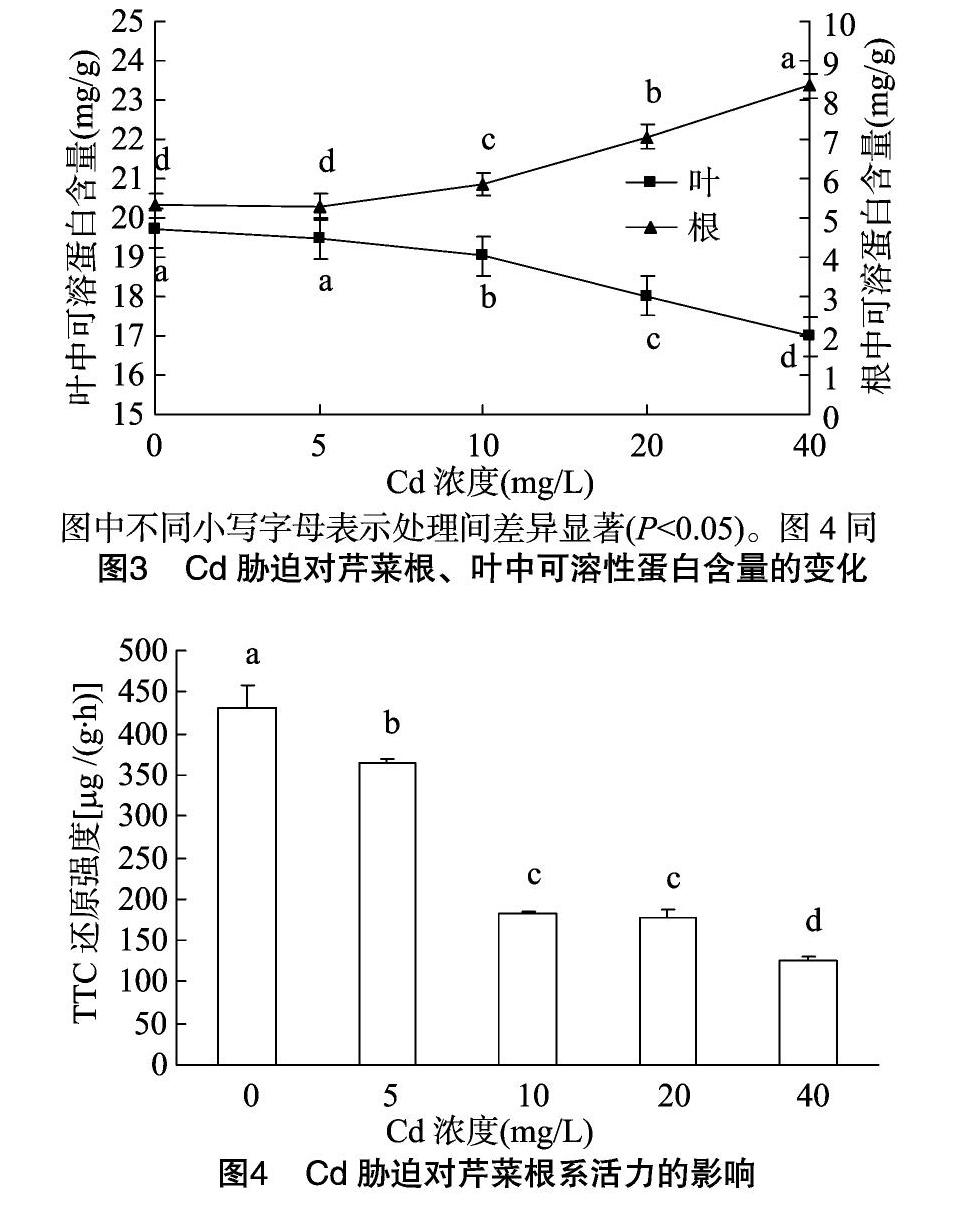
2.3.2 根、叶中可溶性蛋白含量 可溶性蛋白含量变化可间接反映Cd胁迫对芹菜组织中蛋白质合成、降解或变性等过
程的影响。由图3可见,随Cd胁迫浓度的增大,芹菜叶中的可溶性蛋白含量逐渐减少, 而根中的可溶性蛋白含量正好相反,呈增加趋势;Cd胁迫浓度为5、10、20、40 mg/L时,芹菜叶、根组织中的可溶性蛋白含量分别为各自对照的98.73%、96.55%、91.28%、86.16%和99.74%、109.98%、132.76%、157.18%;Cd胁迫浓度为5 mg/L时,芹菜叶、根组织中的可溶性蛋白含量与对照处理差异不显著(P>0.05),当Cd胁迫浓度≥10 mg/L时,各处理相互间差异显著(P<0.05)。
2.3.3 根系活力 植物对各种元素的吸收主要借助根系,根系的发育状况对地上部生长代谢活动存在重要的影响。由图4可知,随Cd胁迫浓度的增大,芹菜根系活力呈逐渐降低趋势;Cd胁迫浓度为5、10、20、40 mg/L时,芹菜根系活力分别较CK下降15.33%、57.72%、58.69%、70.59%,说明高浓度Cd胁迫对芹菜根的影响显著(P<0.05),产生一定的毒害作用。
3 结论与讨论
重金属进入植物体内,通过在植物根部富集可一定程度上限制其向地上部迁移,进而提高植物对重金属的耐性。重金属在植物根系组织中的大量累积是源于其透过根表进入皮层组织细胞,与皮层细胞中的核酸、多糖、多肽、蛋白质等化合物络合而形成各种稳定的、不溶大分子物质[12]。本研究结果表明,同一镉(Cd)浓度胁迫下,芹菜不同器官中的Cd含量由高到低分布为根>茎>叶,根中的Cd含量相对最高,与邹金华等的研究结果[13-16]相似,而Cd在芹菜根系内的过量累积可适当减少其对地上部器官组织的伤害,这是芹菜一定条件下自我保护的一种耐受方式;随Cd胁迫浓度的增加,芹菜叶、茎、根中的Cd含量提高,Cd胁迫浓度为40 mg/L,芹菜叶、茎、根中的Cd含量相对最高,分别为16.36、65.78、213.06 mg/kg,显著高于其他处理(P<0.05),说明高浓度的Cd胁迫可能对芹菜根系质膜产生较大毒害作用,由于膜透性增强使得根系吸收的Cd更容易向地上部转运。
组织细胞超微结构的改变会对植物的生理活动产生一定负面影响[17]。Nash等研究发现,在重金属胁迫下,植物器官组织细胞中的线粒体、细胞核、细胞膜及多核糖体等细胞器最先显现受毒害症状[18]。植物光合作用功能的发挥主要由叶绿体结构承担完成,叶绿体结构的正常与否对光合作用的影响至关重要[19]。正常环境下,叶细胞叶绿体结构中的类囊体垛叠紧密,并能保持叶绿体膜电荷的稳定,进行更加有效的光能传递[20],而此时胞内超氧化物自由基的产生和消除也能维持在动态平衡水平[21]。有研究认为,叶绿体由正常的紡锤形结构转成椭球或圆球形,一方面是由于重金属的胁迫作用导致渗透压的改变,另一方面重金属胁迫也会造成叶细胞中过量H2O2的蓄积,最终通过Haber-Weiss反应产生氧化能力超强的羟基自由基,从而造成膜脂过氧化过程的发生并破坏膜蛋白,引起膜结构的改变[22]。线粒体是植物细胞代谢的能量中转站,含有多种参与能量转换的酶类物质。细胞的发育生长及胞内蛋白质的合成受控于细胞核[23],进入植物组织细胞的重金属会与细胞核内的大分子物质如核酸发生结合作用,而造成染色体的畸变或断裂[24],最终导致细胞消亡。侯江涛等研究认为,胁迫环境下,植物组织细胞中液泡增大可有利于吸收其他细胞器解体后所释放出的有毒物质,从而可适当减轻这些有毒物质对细胞结构及代谢途径的破坏作用[25]。本研究结果表明,Cd胁迫造成芹菜叶细胞中叶绿体结构的改变,芹菜叶片细胞细胞壁内侧模糊,轮廓不饱满,淀粉颗粒增大变多,叶绿体被膜破损,类囊体出现空泡化现象,Cd胁迫引起叶绿体光合功能丧失;芹菜不同器官组织细胞中的线粒体脊突出现膨胀或部分消失、溶解,线粒体正常的呼吸作用和糖代谢功能受到干扰;Cd胁迫导致根尖组织细胞中细胞基质变稀,液泡数量明显增多,细胞器组织结构遭受一定程度破坏,细胞核仁消失,染色质外溢,线粒体出现肿胀。
叶绿素含量高低可反映植物光合作用的水平,其中,叶绿素a发挥捕获光能和原初反应的作用,叶绿素b传递光能[26]。重金属胁迫会导致叶细胞中叶绿素含量的下降,进而使植物出现叶片失绿现象,而植物受重金属毒害的作用程度,一定范围内可用叶绿素含量的变化间接评判[27]。本研究发现,10 mg/L Cd胁迫处理时,芹菜叶片叶绿素a、叶绿素b及其总量相对最高,分别为1.867、0.656、2.523 mg/g,后随Cd胁迫浓度的增加呈下降趋势,而造成叶绿素含量下降的原因可能是Cd与叶绿体中胆色素原脱氨酶、原叶绿素脂还原酶、δ- 氨基乙酰丙酸合成酶等多种酶的巯基结合,使得叶绿体功能和结构受到影响,从而使叶绿素分解[28],可能是Cd胁迫引起叶细胞内膜结构破坏,从而导致叶绿素的含量下降[29],也有可能是Cd影响植物叶片组织对Fe、Mn元素的吸收,从而导致叶绿素含量和对CO2吸收量的减少,进而影响叶绿素合成[28-30]。
植物组织内的可溶性蛋白大多为参与各种代谢的酶类组分,其含量高低反映体内细胞总代谢水平能力的大小[31],从某种意义可体現逆境生长环境下植物生长能力的强弱[32],而重金属胁迫造成植物组织中可溶性蛋白含量的变化主要是由于重金属会影响蛋白酶的水解活性。同时,可溶性蛋白含量的增加,还意味着细胞渗透物质浓度的提高及相关功能蛋白数量的增多,反过来会对细胞正常的代谢活动产生一定的促进作用[33]。本研究发现,随Cd胁迫浓度增大,芹菜根组织中的可溶性蛋白含量增加,这说明在Cd胁迫下,芹菜根组织可通过某些生理生化转化过程诱导产生类金属鳌合蛋白、金属硫蛋白、胁迫蛋白等镉结合蛋白,防止Cd敏感酶变性失活,从而弱化Cd的毒性作用,进而提高植株对Cd胁迫的适应能力[34];相对于根系而言,芹菜叶片对Cd的胁迫作用较为敏感,较低浓度的Cd胁迫也会造成叶片组织中活性氧自由基增多,造成叶细胞的过氧化损伤,导致合成蛋白质的酶活性受抑制,进而影响某些可溶性蛋白的合成而导致蛋白含量降低,这可能是因为Cd胁迫作用能诱导植物组织中的蛋白快速分解[35],而叶绿体中的蛋白质含量占到叶片中蛋白质总量的70%,Cd胁迫会造成叶绿体超微结构的损伤,进而使得蛋白含量水平随Cd处理浓度的增大而不断降低[33]。
植物根系活力可以表征根系代谢活动过程中的吸收、合成、氧化及还原能力[36]。本研究结果表明,随Cd胁迫浓度的增大,芹菜根系活力不断下降,说明Cd胁迫对芹菜根系产生一定的毒性作用,从而导致根系吸收水分、养分的能力减弱。
参考文献:
[1]Jin Y H,Clark A B,Slebos R J,et al. Cadmium is a mutagen that acts by inhibiting mismatch repair[J]. Nature Genetics,2003,34(3):326-329.
[2]Basa B,Lattanzio G,Solti A,et al. Changes induced by cadmium stress and iron deficiency in the composition and organization of thylakoid complexes in sugar beet (Beta vulgaris L.)[J]. Environmental and Experimental Botany,2014,101(5):1-11.
[3]肖旭峰,解庆娓,范淑英,等. 镉、铅胁迫对芹菜生长及抗氧化酶活性的影响[J]. 江西农业大学学报,2015,37(5):793-797.
[4]徐 劼,保积庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报,2015,35(8):2605-2612.
[5]Du R J,He E K,Tang Y T,et al. How phytohormone IAA and chelator EDTA affect lead uptake by Zn/Cd hyperaccumulator Picris divaricate[J]. International Journal of Phytoremediation,2011,13(10):1024-1036.
[6]张 静,赵秀侠,汪 翔,等. 重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J]. 植物生理学报,2015,51(11):1969-1974.
[7]王国栋,陈 云,梁 飞,等. 控墒补灌对新疆春玉米产量和穗叶光合特性的影响[J]. 应用生态学报,2016,27(8):2499-2506.
[8]徐臣善. 钙对盐胁迫下小金海棠幼苗生物量及抗氧化系统的影响[J]. 植物生理学报,2014,50(6):817-822.
[9]程海宽,张 彪,景鑫鑫,等. 玉米对铅胁迫的响应及体内铅化学形态研究[J]. 环境科学,2015,36(4):1468-1473.
[10]Yamauchi T,Watanabe K,Fukazawa A,et al. Ethylene and reactive oxygen species are involved in root aerenchyma formation and adaptation of wheat seedlings to oxygen-deficient conditions[J]. Journal of Exprimental Botany,2014,65(1):261-273.
[11]徐 劼. 茶树(Camellia sinensis L.)对铅的吸收累积及耐性机制研究[D]. 杭州:浙江大学,2011.
[12]Xu C,Chen X,Duan D,et al. Effect of heavy-metal-resistant bacteria on enhanced metal uptake and translocation of the Cu-tolerant plant,Elsholtzia splendens[J]. Environmental Science and Pollution Research,2015,22(7):5070-5081.
[13]邹金华,张忠贵,魏爱琪. 毛葱的镉吸收积累及亚细胞分布特征[J]. 天津师范大学学报(自然科学版),2014,34(1):72-77.
[14]Yin A G,Yang Z Y,Ebbs S,et al. Effects of phosphorus on chemical forms of Cd in plants of four spinach (Spinacia oleracea L.) cultivars differing in Cd accumulation[J]. Environmental Science and Pollution Research,2016,23(6):5753-5762.
[15]Wang A Y,Wang M Y,Liao Q,et al. Characterization of Cd translocation and accumulation in 19 maize cultivars grown on Cd-contaminated soil:implication of maize cultivar selection for minimal risk to human health and for phytoremediation[J]. Environmental Science and Pollution Research,2016,23(6):5410-5419.
[16]Huang B F,Xin J L,Dai H W,et al. Root morphological responses of three hot pepper cultivars to Cd exposure and their correlations with Cd accumulation[J]. Environmental Science and Pollution Research,2015,22(2):1151-1159.
[17]劉卫国,丁俊祥,邹 杰,等. NaCl对齿肋赤藓叶肉细胞超微结构的影响[J]. 生态学报,2016,36(12):3556-3563.
[18]Nash W W,Poor B W,Jenkins K D. The uptake and subcellular-distribution of lead in developing sea-urchin embryos[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology,1981,69(2):205-211.
[19]Brain G S,Martin S W. Ultrastructure and the biology of plant cells[M]. New York:Edward Arnold,1975.
[20]Yao Y C,Wang S H,Kong Y. Characteristics of photosynthesis mechanism in different peach species under low light intensity[J]. Scientia Agricultura Sinica,2007,40(4):855-863.
[21]Asada K. The water-water cycle in chloroplasts:scavenging of active oxygens and dissipation of excess photons[J]. Annual Review of Plant Biology,1999,50:601-639.
[22]Jiang M Y,Yang W Y,Xu J. Active oxygen damage effect of chlorophyll degradation in rice seedlings under osmotic stress[J]. Acta Botanica Sinica,1994,36(4):289-295.
[23]Hall J L. Electron microscopy and cytochemistry of plant cells[M]. New York:North-holland Biomedical Press,1978.
[24]段昌群,王焕校. 重金属对蚕豆的细胞遗传学毒理作用和对蚕豆根尖微核技术的探讨[J]. 植物学报,1995,37(1):14-24.
[25]侯江涛,高启明,克热木·伊力. NaCl胁迫对两种扁桃幼苗根系K+、Na+、Cl-含量和超微结构的影响[J]. 北方园艺,2014(23):1-5.
[26]宇克莉,孟庆敏,邹金华. 镉对玉米幼苗生长、叶绿素含量及细胞超微结构的影响[J]. 华北农学报,2010,25(3):118-123.
[27]李铮铮,伍 钧,唐 亚,等. 铅、锌及其交互作用对鱼腥草(Houttuynia cordata)叶绿素含量及抗氧化酶系统的影响[J]. 生态学报,2007,27(12):5441-5446.
[28]Bhaduri A M,Fulekar M H. Antioxidant enzyme responses of plants to heavy metal stress[J]. Reviews in Environmental Science and Biotechnology,2012,11(1):55-69.
[29]彭 玲,贾 芬,田小平,等. 硒对油菜根尖镉胁迫的缓解作用[J]. 环境科学学报,2015,35(8):2597-2604.
[30]董如茵,徐应明,王 林,等. 土施和喷施锌肥对镉低积累油菜吸收镉的影响[J]. 环境科学学报,2015,35(8):2589-2596.
[31]郭艳丽,台培东,韩艳萍,等. 镉胁迫对向日葵幼苗生长和生理特性的影响[J]. 环境工程学报,2009,3(12):2291-2296.
[32]李佩华,刘小文. 重金属铅、镉胁迫对马铃薯生长及抗氧化酶系统的影响[J]. 云南农业大学学报(自然科学版),2014,29(5):746-751.
[33]吴桂容,严重玲. 镉对桐花树幼苗生长及渗透调节的影响[J]. 生态环境,2006,15(5):1003-1008.
[34]Bartolf M,Brennan E,Price C A. Partial characterization of a cadmium-binding protein from the roots of cadmium-treated tomato[J]. Plant Physiology,1980,66(3):438-441.
[35]Wang X E,Shi G X,Xu Q S,et al. Exogenous polyamnines enhance copper tolerance of Nymphoides peltatum[J]. Journal of Plant Physiology,2007,164(8):1062-1070.
[36]王玉凤,王庆祥,商丽威. 钙对NaCl胁迫下玉米幼苗根系活力和有机渗透调节物质含量的影响[J]. 玉米科学,2008,16(2):66-70.李 浪,孙 燕,刘 妮. 红托竹荪与覆土土壤矿质元素相关性分析[J]. 江苏农业科学,2019,47(5):99-102.

