益肾化浊方对SAMP8小鼠学习记忆能力和海马神经元及相关炎症因子的影响
孙伟明 崔远武 王凯 郭威 程汝珍 张玉莲
摘要:目的 观察益肾化浊方对SAMP8小鼠学习记忆能力和海马CA1区神经元、肿瘤坏死因子-α(TNF-α)、核因子-κB(NF-κB)表达的影响,探讨其可能的作用机制。方法 将7月龄SAMP8小鼠随机分为SAMP8组和益肾化浊方低、中、高剂量组,选择SAMR1小鼠作为对照;益肾化浊方低、中、高剂量组分别给予3.12、6.24、12.48 g/kg益肾化浊方药液灌胃,SAMR1组和SAMP8组给予等体积蒸馏水灌胃,每日1次,连续4周;采用Morris水迷宫实验评价小鼠学习记忆能力,尼氏染色观察小鼠海马CA1区神经元变化,免疫组化检测小鼠海马CA1区TNF-α和NF-κB的表达。结果 水迷宫实验结果显示,各组小鼠平均游泳速度差异无统计学意义(P>0.05);与SAMR1组比较,SAMP8组小鼠逃避潜伏时间显著增加、穿越平台次数显著减少(P<0.05);与SAMP8组比较,益肾化浊方中剂量组小鼠逃避潜伏时间显著减少、穿越平台次数显著增加(P<0.05)。尼氏染色结果显示,与SAMR1组比较,SAMP8组小鼠海马CA1区神经元数量显著减少(P<0.05);与SAMP8组比较,益肾化浊方中剂量组小鼠海马CA1区神经元数量显著增加(P<0.05)。免疫组化染色结果显示,与SAMR1组比较,SAMP8组小鼠海马CA1区TNF-α和NF-κB表达显著增加(P<0.05);与SAMP8组比较,益肾化浊方中剂量组小鼠海马CA1区TNF-α和NF-κB表达显著减少(P<0.05)。结论 中剂量益肾化浊方可有效改善7月龄SAMP8小鼠学习记忆能力,该作用机制可能与其减少海马CA1区神经元丢失、抑制炎症因子TNF-α、NF-κB的表达有关。
关键词:益肾化浊方;阿尔茨海默病;学习记忆;海马神经元;肿瘤坏死因子-α;核因子-κB;小鼠
中圖分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)07-0060-06
Abstract: Objective To investigate the effects of Yishen Huazhuo Decoction on learning and memory ability, hippocampus neurons, tumor necrosis factor-α (TNF-α) and nuclear factor-κB (NF-κB) of senescence accelerated mouse prone 8 (SAMP8) and its possible mechanism. Methods 7-month old SAMP8 mice were randomly divided into SAMP8 group, Yishen Huazhuo Decoction low-, medium-, and high-dosage groups. Senescence accelerated mouse resistant 1 (SAMR1) were selected as control group. Mice in Yishen Huazhuo Decoction low-, medium-, and high-dosage groups received 3.12, 6.24, 12.48 g/kg respectively for gavage. The SAMR1 group and the SAMP8 group were given an equal volume of distilled water once a day for 4 weeks. Morris water maze test was used to evaluate the learning and memory ability of mice. Nissl staining was used to observe the changes of neurons in hippocampal CA1 region of mice, and the expressions of TNF-α and NF-κB in hippocampus of mice was detected by immunohistochemistry. Results The results of water maze test showed that there was no significant difference in the average swimming speed among the groups (P>0.05). Compared with the SAMR1 group, the escape latency of theSAMP8 group significantly increased, and the number of crossing platforms was significantly reduced (P<0.05). Compared with the SAMP8 group, the escape latency of the mice in the Yishen Huazhuo Decoction medium-dosage group was significantly reduced, and the number of crossing platforms significantly increased (P<0.05). Nissl staining showed that the number of neurons in hippocampal CA1 region of SAMP8 group significantly decreased compared with SAMR1 group (P<0.05). Compared with the SAMP8 group, the number of neurons in the hippocampal CA1 region of the Yishen Huazhuo Decoction medium-dosage group significantly increased (P<0.05). Immunohistochemical staining showed that compared with SAMR1 group, the expressions of TNF-α and NF-κB in hippocampal CA1 region of SAMP8 group significantly increased (P<0.05). Compared with the SAMP8 group, the expression of TNF-α and NF-κB in the hippocampal CA1 region of Yishen Huazhuo Decoction medium-dosage group significantly decreased (P<0.05). Conclusion Medium-dose Yishen Huazhuo Decoction can effectively improve the learning and memory ability of 7-month old SAMP8 mice, which may be related to the reduction of neuron loss in hippocampal CA1 region and the inhibition of inflammatory factors TNF-α and NF-κB.
Keywords: Yishen Huazhuo Decoction; Alzheimer disease; learning and memory; hippocampal neurons; TNF-α; NF-κB; mice
阿尔茨海默病(Alzheimer disease,AD)临床上以进行性认知功能下降为主要特点,大多发病年龄大于65岁,占痴呆总数的60%~80%[1]。我国AD患者超过1000万,是欧洲国家痴呆人数的总和[2]。AD病理上主要表现为海马区萎缩、神经元丢失、神经元纤维缠结和以β-淀粉样蛋白(amyloid β protein,Aβ)为核心的神经炎性斑[3],其中神经元丢失与认知功能下降直接相关,是脑萎缩的病理基础[4]。研究发现,Aβ会导致中枢微环境中肿瘤坏死因子-α(TNF-α)水平明显上升[5],二者均可激活神经元核因子-κB(NF-κB),活化的NF-κB入核后可进一步增加Aβ的生成[6]。SAMP8小鼠为AD常用动物模型,与其他模型比较,更侧重于衰老过程[7-8]。前期研究发现,益肾化浊方可改善轻度AD患者临床症状,提高认知和日常生活能力,保护AD模型大鼠神经元与突触超微结构,提高记忆相关蛋白的表达[9-10]。在此基础上,本研究选取7月龄SAMP8小鼠作为研究对象,观察益肾化浊方对模型小鼠学习记忆能力、海马CA1区神经元的作用及相关炎症因子TNF-α、NF-κB表达的影响。
1 实验材料
1.1 动物
7月龄雄性健康SPF级SAMP8小鼠40只,体质量25~30 g,7月龄雄性SPF级SAMR1小鼠10只,体质量25~30 g,天津中医药大学第一附属医院提供,动物许可证号SCXK(津)2015-0003。饲养于中国医学科学院放射医学研究所实验动物中心,12 h光照,温度23~25 ℃,相对湿度50%~60%,自由摄食饮水。
1.2 药物
益肾化浊方(淫羊藿10 g,女贞子10 g,制首乌6 g,肉苁蓉10 g,石菖蒲6 g,川芎6 g),参照文献计算临床等效剂量小鼠给药为6.24 g/kg[11],设为中剂量,低、高剂量给药剂量分别为3.12、12.48 g/kg,饮片由天津中医药大学第二附属医院制剂室提供并制备,水煎3次,每次30 min,混合后浓缩至1.248 g/mL(益肾化浊方高剂量药物浓度),4 ℃保存备用。
1.3 主要试剂与仪器
NF-κB单克隆抗体(Abcam公司,ab32360),TNF-α抗体(Abcam公司,ab6671),组化试剂盒(Servicebio公司,GDP1001)。Morris水迷宫和数据采集分析系统(北京众实迪创科技发展有限责任公司,ZS-001),脱水机(武汉俊杰电子有限公司,JJ-12J),包埋机(武汉俊杰电子有限公司,JB-P5),病理切片机(上海徕卡仪器有限公司,RM2016),正置光学显微镜(日本尼康,NIKON ECLIPSE CI),成像系统(日本尼康,NIKON DS-U3)。
2 实验方法
2.1 分组和给药
40只SAMP8小鼠按随机数字表分为SAMP8组和益肾化浊方低、中、高剂量组。益肾化浊方高剂量组给予1.248 g/mL药液灌胃,采用蒸馏水将高剂量药液稀释至0.312、0.624 g/mL,分别作为低、中剂量组干预用药;SAMP8组和SAMR1组给予蒸馏水干预。给药体积10 mL/kg,每日1次,連续4周。
2.2 Morris水迷宫实验
水迷宫直径120 cm×高50 cm×水深30 cm,水温控制在20~22 ℃,平台直径10 cm,位于第一象限水面下1 cm。加入黑色食用色素,使水变成不透明的黑色。
2.2.1 定向航行实验
参考Vorhees等[12]实验方案:每日每只小鼠连续检测4次,持续5 d。小鼠入水后,摄像机同时开始记录。若65 s内小鼠找到平台,记录实际所用时间,保持小鼠在平台处停留15 s;若65 s内无法找到平台,记录逃避潜伏时间为65 s,引导其找到平台,停留15 s。
2.2.2 空间探索实验
定向航行实验结束后次日进行检测,每只小鼠检测1次。将平台撤除,从第三象限桶壁中点投入小鼠,记录65 s内在平台区域的穿越次数。
2.3 尼氏染色
水迷宫检测结束后,小鼠腹腔注射5%水合氯醛(400 mg/kg)麻醉,仰卧位固定于手术台上,开放胸腔,剪开右心耳,将灌注针由心尖处刺入,到达主动脉,先后灌注0.9%氯化钠溶液和4%多聚甲醛;取全脑于4%多聚甲醛固定24 h,选取视交叉至丘脑后侧区域,冠状切块得到标本,脱水石蜡包埋,切片(厚度约4 μm),甲苯胺蓝染色,封片。400倍显微镜下分别选取双侧海马CA1区各3个区域拍照,照片采用Image-Pro Plus 6.0软件分析。
2.4 免疫组化染色
标本制备方法同“2.3”项。抗原微波修复,中火8 min,停火8 min,中低火7 min;血清封闭,滴加抗体(TNF-α 1∶200,NF-κB 1∶400),4 ℃孵育过夜;加二抗,室温孵育50 min;DAB显色,苏木素复染3 min;脱水,封片。400倍显微镜下分别选取双侧海马CA1区各3个区域拍照,照片采用Image-Pro Plus 6.0软件分析。
3 统计学方法
采用SPSS19.0统计软件进行分析。正态分布计量资料以—x±s表示;多组间比较采用方差分析,连续变量比较采用重复测量方差分析;偏态分布数据计量资料以M(P25,P75)表示,组间比较采用非参数Kruskal-Wallis检验。P<0.05表示差异有统计学意义。
4 结果
4.1 一般状况
SAMR1组小鼠情绪稳定,毛顺滑、光泽度较好;SAMP8组小鼠情绪暴躁易激惹,行走时左右摇摆,部分小鼠皮肤可见破溃,毛色略发黄;益肾化浊方低剂量组小鼠易激惹,行走不稳但好于SAMP8组,部分小鼠皮肤可见破溃,毛色略发黄。益肾化浊方中剂量组小鼠情绪较稳定,行走较稳,皮肤无破溃,毛色略发黄;益肾化浊方高剂量组小鼠易激惹,行走较稳,部分小鼠皮肤可见破溃,毛色略发黄;SAMR1组小鼠未出现死亡,SAMP8组和益肾化浊方低、中剂量组给药过程小鼠各死亡2只,益肾化浊方高剂量组给药过程小鼠死亡6只。解剖死亡小鼠发现部分胸腺异常肿大,心脏缩小,考虑死因为心脏受压迫导致的循环衰竭,其中益肾化浊方高剂量组小鼠肝脾质地柔软,有瘀血,轻度肿大,伴有散在紫黑色瘀斑;益肾化浊方低、中剂量组小鼠肝脾质地柔软,颜色均一,呈暗红色,未见明显瘀斑。
4.2 益肾化浊方对模型小鼠学习记忆能力的影响
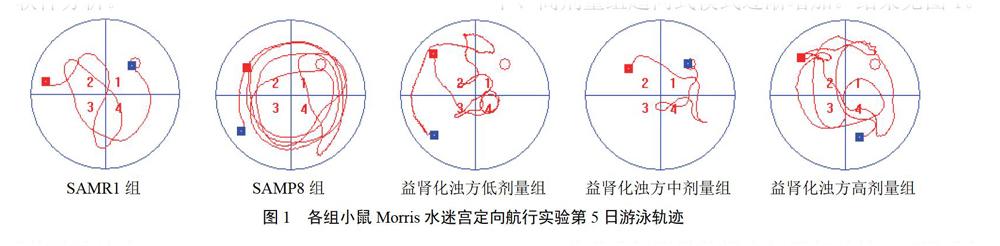
4.2.1 搜索模式
经过5 d训练学习,SAMR1组为趋向式或直线式,SAMP8组多为边缘式或随机式,益肾化浊方低、中、高剂量组趋向式模式逐渐增加。结果见图1。
4.2.2 平均游泳速度
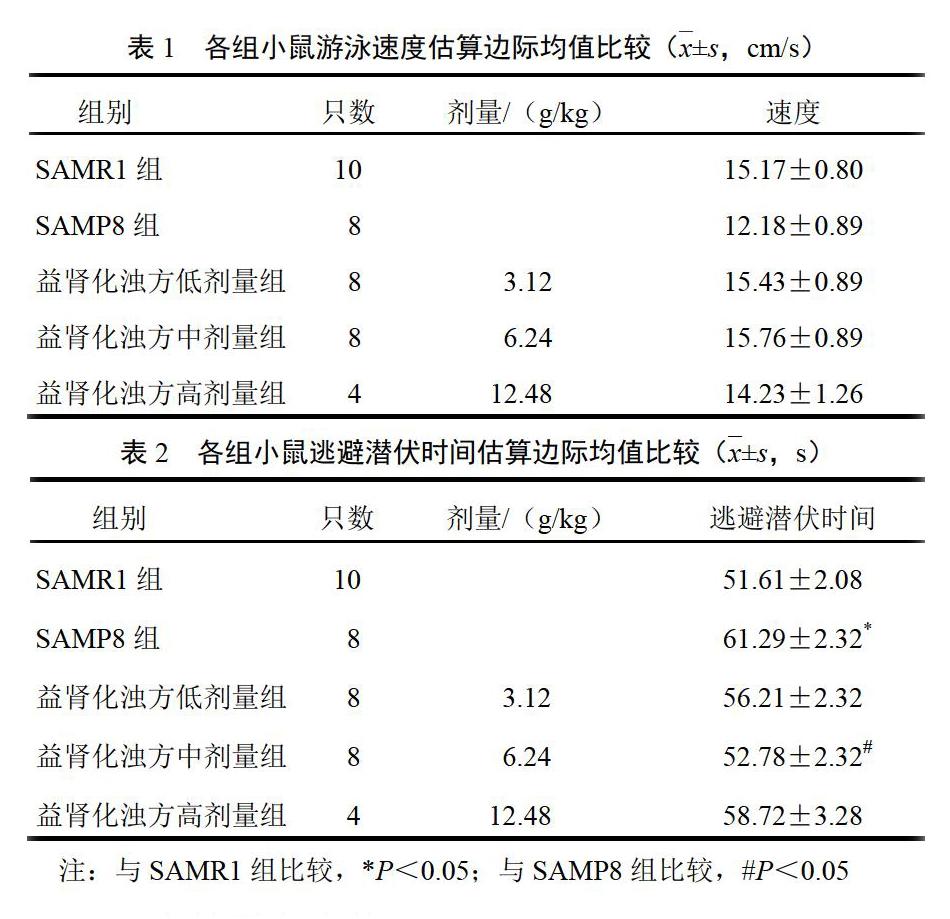
经重复测量方差分析,主体间效应检验发现各组间差异无统计学意义(P>0.05),说明各组小鼠体质基本一致,可排除游泳速度对潜伏时间的影响。结果见表1。
4.2.3 逃避潜伏时间
经重复测量方差分析,数据通过球形检验(P>0.05),说明重复测量数据之间无相关性,可用重复测量设计资料的单变量方差分析处理资料;主体内效应检验显示:时间因素差异有统计学意义(P<0.05)。说明测量指标(逃避潜伏时间)有随时间变化的趋势;但时间和分组交互作用差异无统计学意义(P>0.05),说明时间因素的作用并不随着分组的不同而不同。主体间效应检验显示:分组因素差异有统计学意义(P<0.05),说明各组间逃避潜伏时间不同。事后比较采用LSD法:与SAMR1组比较,SAMP8组小鼠逃避潜伏期时间明显延长(P<0.05);与SAMP8组比较,益肾化浊方中剂量组小鼠逃避潜伏期时间明显缩短(P<0.05)。结果见表2。
4.2.4 穿越平台次数
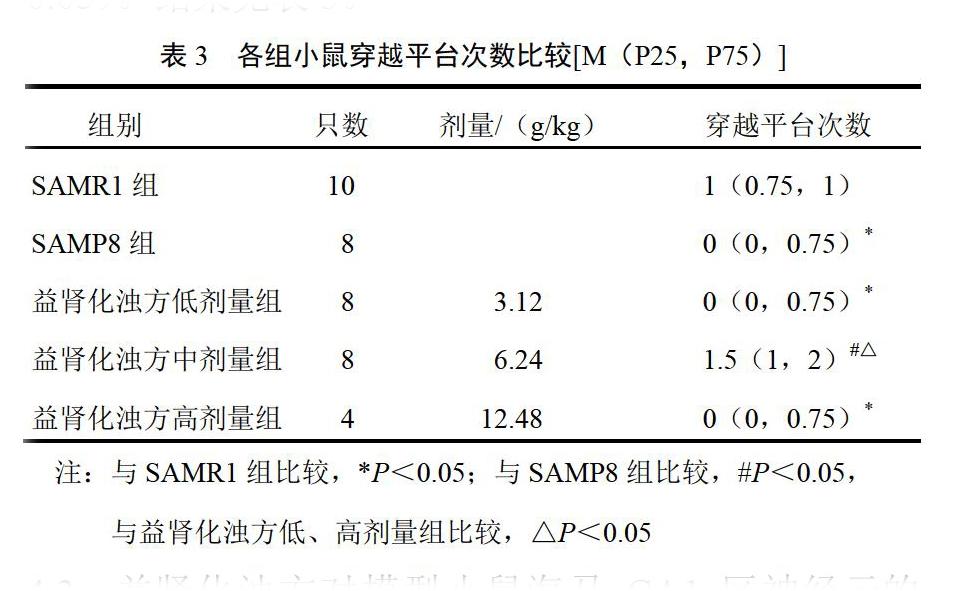
经Kruskal-Wallis检验,两两比较结果显示,与SAMR1组比较,SAMP8组和益肾化浊方低、高剂量组小鼠穿越平台次数显著减少(P<0.05);与SAMP8组,益肾化浊方中剂量组小鼠穿越平台次数显著增加(P<0.05);与益肾化浊方低、高剂量组比较,益肾化浊方中剂量组小鼠穿越平台次数显著增加(P<0.05)。结果见表3。
4.3 益肾化浊方对模型小鼠海马CA1区神经元的影响
SAMR1组小鼠海马CA1区神经元整体排列有序,可见部分缺失,神经元形态较好无明显肿胀及固缩现象;SAMP8组小鼠海马CA1区神经元缺失严重,可见较大空泡,神经元间隙明显增宽,部分神经元固缩较明显;益肾化浊方低剂量组小鼠海马CA1区神经元部分缺失,神经元间隙增宽,部分神经元固缩;益肾化浊方中剂量组小鼠海马CA1区神经元整体排列较好,可见部分缺失,神经元间隙略增宽,部分神经元固缩,见图2。各组小鼠海马CA1区神经元数量经方差分析,与SAMR1组比较,SAMP8组和益肾化浊方低、中剂量组神经元数量明显减少(P<0.05);与SAMP8组、益肾化浊方低剂量组比较,益肾化浊方中剂量组神经元数量明显增加(P<0.05)。结果见表4。
4.4 益肾化浊方对模型小鼠海马CA1区肿瘤坏死因子-α和核因子-κB表达的影响
经方差分析,两两比较结果显示,与SAMR1组比较,SAMP8组和益肾化浊方中剂量组小鼠海马CA1区TNF-α和活化的NF-κB表达明显升高(P<0.05);与SAMP8组比较,益肾化浊方中剂量组小鼠海马CA1区TNF-α和活化的NF-κB表达明显降低(P<0.05)。结果见表5、图3和图4。
5 讨论
中医学关于AD的论述见于“善忘”“文痴”等病症中,根据其发病特点与临床表现属中医学“呆证”范畴。AD病机根本在于肾精不足,兼有痰瘀内扰。肾藏精,精充骨而生髓,髓聚而为脑,髓满而脑髓充,精脱而脑髓消,肾中精气作为构成人体最基本的物质基础,其盛衰直接影響人体生命的全过程。益肾通淋方中淫羊藿、肉苁蓉充肾精、温肾阳,女贞子、何首乌益精髓、滋肝肾,以应“阴中求阳,阳中求阴”之意;石菖蒲开窍化湿、宁神安智,川芎为血中气药,活血祛瘀,二者合用有化浊蠲饮之功效。
加速老化小鼠(SAM)是由AKR/J小鼠培育而来[8],其中SAMP8小鼠具有与AD类似的临床与病理表现[13],研究发现,4~6月龄小鼠开始进入快速老化期,逐步表现出学习记忆能力下降、脱毛、皮肤溃损、脊柱后凸变形、情绪不稳定等衰老状态[14],这与中医肾虚证的部分特点及肾虚模型具有相似性[15]。海马是AD中最早损伤的区域之一,是记忆形成与存储的关键区域,其中CA1区神经元作用尤为重要[16];在评价AD模型中Morris水迷宫实验为经典的方案[17];AD患者尸检发现海马和内嗅皮层区活化的NF-κB表达增强[18],在NF-κB众多的激活物质中,TNF-α是目前研究较为完善的炎症因子[6]。因此,本研究选取7月龄SAMP8小鼠作为研究对象,通过Morris水迷宫实验评价其学习记忆能力,尼氏染色观察海马CA1区神经元形态和数量的变化情况,免疫组化检测海马CA1区TNF-α及活化的NF-κB的表达。
本研究发现,与SAMR1小鼠比较,SAMP8小鼠出现学习记忆能力下降、走路摇摆、情绪暴躁易激惹、皮肤溃损和脱毛等行为学变化,与既往研究一致[14],采用益肾化浊方干预后可改善上述症状。对死亡小鼠解剖发现部分胸腺肿大,压迫心脏,考虑SAM与AKR/J小鼠具有相似的基因背景[8],而AKR/J小鼠常用做胸腺瘤模型。益肾化浊方高剂量组小鼠死亡数量高于其他组别,解剖死亡小鼠发现肝脾存在散在瘀斑。同时,研究发现何首乌具有一定的肝毒性,其损伤作用随剂量增加而愈发明显[19]。因此,考虑高剂量益肾化浊方(临床实际用量的18.2倍)具有潜在的药理毒性。
水迷宫实验逃避潜伏时间和穿越平台次数结果提示,益肾化浊方中剂量可显著改善SAMP8小鼠的空间学习记忆能力及空间记忆的较长时间维持[20],同时该组小鼠搜索模式由最初的随机式逐渐转向趋向式,说明其学習能力得到改善;而益肾化浊方高、低剂量组小鼠虽经药物干预后搜索模式有一定变化,逃避潜伏时间也有下降趋势,但穿越平台次数变化不明显,说明两者在改善和维持学习记忆能力方面尚有不足。同时考虑高剂量益肾化浊方长期连续服用具有潜在毒性,在研究益肾化浊方对海马神经元的影响时未再涉及益肾化浊方高剂量组。
尼氏染色结果显示中剂量益肾化浊方(临床实际用量的9.1倍)对减少海马CA1区神经元丢失作用明显,且好于低剂量益肾化浊方(临床实际用量的4.55倍),CA1区神经元在调节新记忆形成以及长期记忆的维持具有重要作用[21],因此,该结果提示益肾化浊方中剂量可通过保护海马CA1区神经元从而改善SAMP8小鼠的学习记忆能力。结合水迷宫实验与尼氏染色结果低剂量对SAMP8小鼠空间学习记忆能力及海马神经元的改善作用不明显,因此在可能涉及的机制研究中不再涉及该组。
Aβ是AD的病理因素中重要驱动因子[22],来源于淀粉样前体蛋白(amyloid precursor protein,APP),经β分泌酶和γ分泌酶连续水解产生。Aβ可选择性地将NF-κB亚基p65、p50进行核转移,从而促进神经元凋亡基因的表达[23],诱导神经元丢失;同时Aβ也可间接通过增加脑区TNF-α的释放,激活NF-κB。活化的NF-κB可增加β分泌酶,从而进一步增加Aβ含量。前期研究发现,益肾化浊方可降低SAMP8小鼠APP、PS1基因的表达,从而减少Aβ的生成[24]。本研究发现,该方可降低SAMP8小鼠TNF-α的表达与NF-κB的入核活化。
综上,益肾化浊方中剂量可改善7月龄SAMP8小鼠学习记忆能力,其作用机制可能与该方具有降低海马CA1区TNF-α的表达与NF-κB的入核活化,从而减少神经元丢失的作用有关。此外,发现高剂量益肾化浊方存在潜在的药物毒性,虽然益肾化浊方中剂量组动物死亡数量未出现显著增多,但对于中剂量的药物用量与服用时间等问题仍需通过对肝肾功能等方面指标检测,进一步评估其安全性以优化组方。同时,鉴于影响NF-κB活化的因素众多,以及活化后NF-κB会参与突触长时程增强调控、影响记忆相关蛋白CREB等多种因子的表达[6],因此,益肾化浊方对NF-κB的调控作用及具体机制尚需进一步研究明确。
参考文献:
[1] GAUGLER J E, JAMES B, JOHNSON T, et al. 2016 Alzheimer's disease facts and figures[J]. Alzheimers & Dementia,2016,12(4):459-509.
[2] 田金洲.中国痴呆诊疗指南(2017年版)[M].北京:人民卫生出版社, 2018:1.
[3] QUERFURTH H W, LAFERLA F M. Alzheimer's disease[J]. New England Journal of Medicine,2010,362(4):329-344.
[4] SERRANOPOZO A, FROSCH M P, MASLIAH E, et al. Neuropathological alterations in Alzheimer disease.[J]. Cold Spring Harbor Perspectives in Medicine,2011,1(1):a006189.
[5] NILSON A N, ENGLISH K C, GERSON J E, et al. Tau oligomers associate with inflammation in the brain and retina of tauopathy mice and in neurodegenerative diseases[J]. Journal of Alzheimer's Disease,2017,55(3):1083-1099.
[6] SNOW W M, ALBENSI B C. Neuronal gene targets of NF-κB and their dysregulation in Alzheimer's disease[J]. Frontiers in Molecular Neuroscience,2016,9:118.
[7] 梁梅亭,朱宏,董克礼,等.补肾活血针刺法对SAMP8小鼠杏仁核蛋白质组学表达的影响[J].中国中医药信息杂志,2018,25(3):58-63.
[8] TAKEDA T, HOSOKAWA M, TAKESHITA S, et al. A new murine model of accelerated senescence[J]. Mechanisms of Ageing & Development, 1981,17(2):183-194.
[9] ZHANG Y, LIN C, ZHANG L, et al. Cognitive improvement during treatment for mild Alzheimers disease with a Chinese herbal formula:a randomized controlled trial[J]. PLoS One,2015,10(6):e0130353.
[10] 李強,王凯,孙伟明,等.益肾化浊方对阿尔茨海默病模型大鼠海马区Ca2+浓度及钙相关记忆蛋白表达的影响[J].时珍国医国药,2018,21(3):111-114.
[11] 魏伟,吴希美,李元建.药理实验方法学:第4版[M].北京:人民卫生出版社,2010:1698.
[12] VORHEES C V, WILLIAMS M T. Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nature Protocols,2006,1(2):848-858.
[13] MORLEY J E, ARMBRECHT H J, FARR S A, et al. The senescence accelerated mouse (SAMP8) as a model for oxidative stress and Alzheimer's disease[J]. Biochim Biophys Acta,2012,1822(5):650-656.
[14] 褚芹,于建春,潘建明,等.快速老化模型小鼠SAMP8行为学的增龄性变化[J].现代生物医学进展,2008,8(10):1801-1804.
[15] 沈自尹,黄建华,林伟,等.从整体论到系统生物学进行肾虚和衰老的研究[J].中国中西医结合杂志,2009,29(6):548-550.
[16] JEONG Y, HUH N, LEE J, et al. Role of the hippocampal CA1 region in incrementalvaluelearning[J]. Sci Rep,2018,8(1):9870.
[17] 王凯,李强,孙伟明,等.不同浓度Aβ(25-35)蛋白模拟阿尔茨海默病模型学习记忆的差异[J].中国比较医学杂志,2017,27(3):14-19.
[18] TERAI K, MATSUO A, MCGEER P L. Enhancement of immunoreactivity for NF-κB in the hippocampal formation and cerebral cortex of Alzheimer's disease[J]. Brain Research,1996,735(1):159-168.
[19] 黄伟,张亚囡,孙蓉.何首乌不同组分单次给药对小鼠肝毒性“量-时-毒”关系研究[J].中国药物警戒,2011,8(4):193-197.
[20] MORRIS R G M. Spatial localization does not require the presence of local cues[J]. Learning and Motivation,1981,12(2):239-260.
[21] LEEM Y H, CHANG H. The ameliorating effect of exercise on long-term memory impairment and dendritic retraction via the mild activation of AMP-activated protein kinase in chronically stressed hippocampal CA1 neurons[J]. J Exerc Nutrition Biochem, 2018,22(3):35-41.
[22] HURTADO D E, MOLINA-PORCEL L, IBA M, et al. Aβ accelerates the spatiotemporal progression of tau pathology and augments tau amyloidosis in an Alzheimer mouse model[J]. American Journal of Pathology,2010,177(4):1977-1988.
[23] VALERIO A, BORONI F, BENARESE M, et al. NF-κB pathway: a target for preventing β-amyloid (Aβ)-induced neuronal damage and Aβ42 production[J]. European Journal of Neuroscience,2006,23(7):1711-1720.
[24] 宋宛珊,张玉莲,周震,等.益肾化浊方对快速老化小鼠认知功能与海马神经元形态学的影响及机制[J].中国老年学杂志,2016,36(11):2586-2590.

