耐硫变换-甲烷化Mo/TiO2 催化剂的动力学研究
王吉平,蒋 超,赵庆鲁,余汉涛,蒋斌波
(1. 中国石化 齐鲁分公司研究院,山东 淄博 255400;
2. 浙江大学 联合化学反应工程研究所,浙江 杭州 310027)
水煤气变换反应和甲烷化反应是现代煤化工的两个重要反应[1-3],其中,耐硫甲烷化反应工艺由于不需要对合成气进行预脱硫,且具有流程短、能耗低、投资低等优势,受到越来越多的关注,同时耐硫甲烷化反应催化剂的研究也取得了积极进展[4-7]。目前,工业上耐硫变换反应和甲烷化反应通常需要在不同的反应器中单独进行,但对于煤气化制氢联产甲烷燃料气而言,存在工艺流程长、装置投资大、运行能耗高等问题。开发“合成气耐硫变换-甲烷化协同反应”工艺,在一台反应器中同时进行耐硫变换和部分耐硫甲烷化反应,则可开创煤制氢气联产甲烷燃料气的新路线,大幅提高相关装置的灵活性和经济性。
基于钼基催化剂在加氢脱硫、脱氮反应、水煤气变换反应和耐硫甲烷化反应中的广泛应用研究[8-11],目前已研制开发出了一种合成气耐硫变换-甲烷化Mo/TiO2催化剂,该催化剂具有良好的变换反应和甲烷化反应活性,且具有较低的甲烷化起活温度和良好的稳定性。
本工作制备了耐硫变换-甲烷化Mo/TiO2催化剂,采用正交实验考察了温度、水气体积比、氢气含量、一氧化碳含量和压力等因素对耐硫变换-甲烷化反应Mo/TiO2催化剂反应性能的影响,建立了耐硫变换-甲烷化催化剂动力学方程,探讨了动力学方程的适用性。
1 实验部分
1.1 催化剂的制备
通过浸渍法制备耐硫变换-甲烷化催化剂。首先将载体物料按配比准确称重,置入捏合机中,缓慢加入蒸馏水并进行捏合,捏合一定时间后,将载体物料挤出成型为圆条状,在120 ℃下干燥2 h,然后在480 ℃下继续焙烧3 h,制得载体。配制一定浓度的钼酸铵溶液,然后将钼酸铵溶液浸渍到干燥的载体上,60 ℃下搅拌均匀浸渍,浸渍后,在120 ℃下干燥2 h,并于480 ℃下焙烧一定时间,制得催化剂试样。
1.2 工艺流程
反应在中国石化石油化工科学研究院研制的固定床管式反应器评价装置上进行,工艺流程见图1。该装置主要由进料单元、反应单元和分析单元3 部分组成。进料单元由两路气相进料和一路液相进料组成,气相进料由质量流量计控制,液相通过柱塞泵完成进料,液相物料进入反应管前必须经过预热器过热气化。采用安捷伦公司的Agilent GC7820A型气相色谱仪对产物组分进行在线分析,通过反应前后各组分的变化,计算CO 转化率和CH4收率。色谱柱为Porapak Q 填充柱,检测器为TCD,载气为氦气,流速为40 mL/min,柱箱初始温度38 ℃,保持时间2 min,以20 ℃/min 的升温速率升温,终温150 ℃,保持2 min。
固定床管式反应器内径25 mm、长1 350 mm,反应管内设有一根外径6 mm 的热电偶套管,配备3 根热电偶测量催化剂床层不同部位的温度。反应管置于五段式控温的电加热炉中,以确保反应器的等温效果。反应管恒温段长度约60 cm,恒温段内温差低于±2 ℃,反应器入口预热段长约40 cm,原料气到达催化剂床层前可保证达到设定温度。实验时催化剂与惰性填料稀释装填,保证催化剂床层的等温效果。
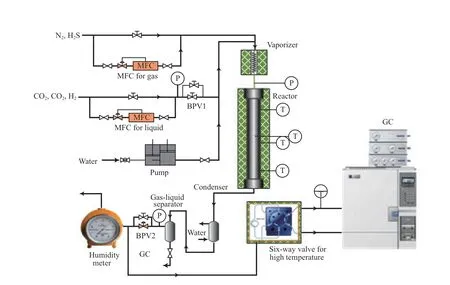
图 1 固定床管式反应器评价装置Fig.1 Fixed bed tubular reactor evaluation device.MFC:mass flow controller;BPV1:back pressure valve 1;BPV2:back pressure valve 2;GC:gas chromatography;P:pressure;T:temperature.
1.3 实验方案
正交实验方案见表1。根据催化剂性能及应用工况,每组实验在为1 000 ~3 000 h-1空速范围内布置3 个点,合成气中H2S 含量为0.2%(φ)。
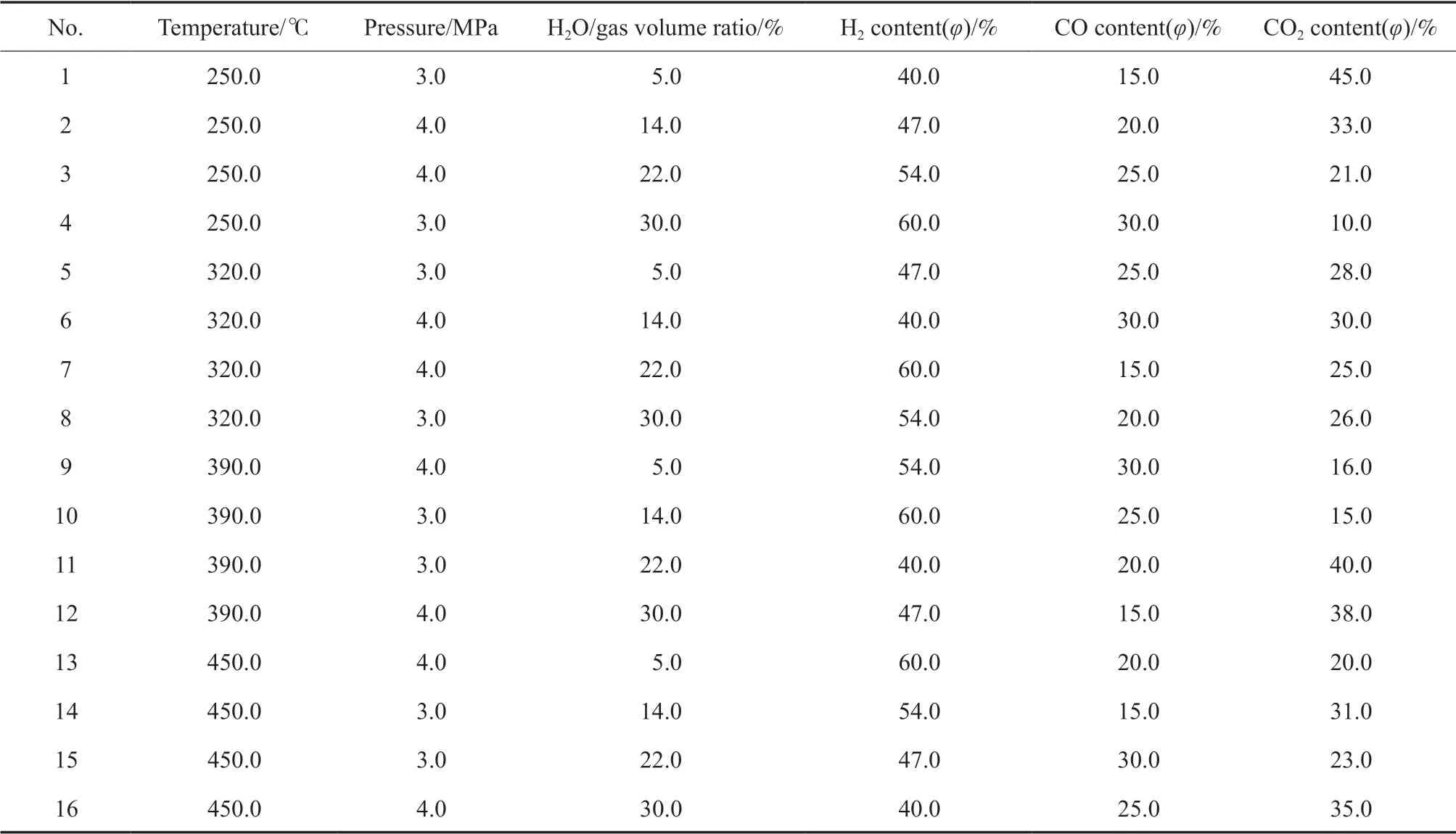
表1 正交实验设计方案Table 1 Orthogonal experimental design
2 结果与讨论
2.1 外扩散的消除
图2 为甲烷收率与原料气流量之间的关系曲线。
从图2 可以看出,采用不同装填量的催化剂进行实验所得到的甲烷收率与原料气流量关系曲线趋势相吻合,因此,可以认为在1 000 ~3 000 h-1空速范围内,外扩散的影响已排除。
2.2 正交实验评价结果
因其他空速时得到的各个因素的影响效果与空速为1 216 h-1的相同,以空速为1 216 h-1时的正交实验结果为例,采用极差分析方法对正交实验结果进行分析,极差分析结果见表2 ~6。
由表2 ~6 可看出,温度、水气体积比、氢气含量、CO 含量和压力等因素对不同优化目标的影响不同。如CO 含量对CO 的转化量影响最显著,其次是温度,压力和氢气含量的影响较弱,水气体积比的影响最小;如以H2的转化量为目标,则温度、压力、氢气含量、CO 含量和水气体积比等因素的影响依次减弱;温度对CO2的生成量影响最大,氢气含量、压力、水气体积比和CO 含量对CO2生成量的影响依次减弱,且相比温度的影响来说均显著减弱,特别是最后两个因素基本相同。
根据表2 ~6 的分析结果还可以进一步优选出在考察范围内的最佳条件。如以CO 转化量为优化目标进行说明,从温度一列可以发现,k2最大,因此温度的最优条件为第2 水平,即320 ℃。同理,可以优选出最佳水气比为5.0,最佳氢气含量为40.0%(φ),最佳CO 含量为30.0%(φ),而压力增加有利于CO 转化。
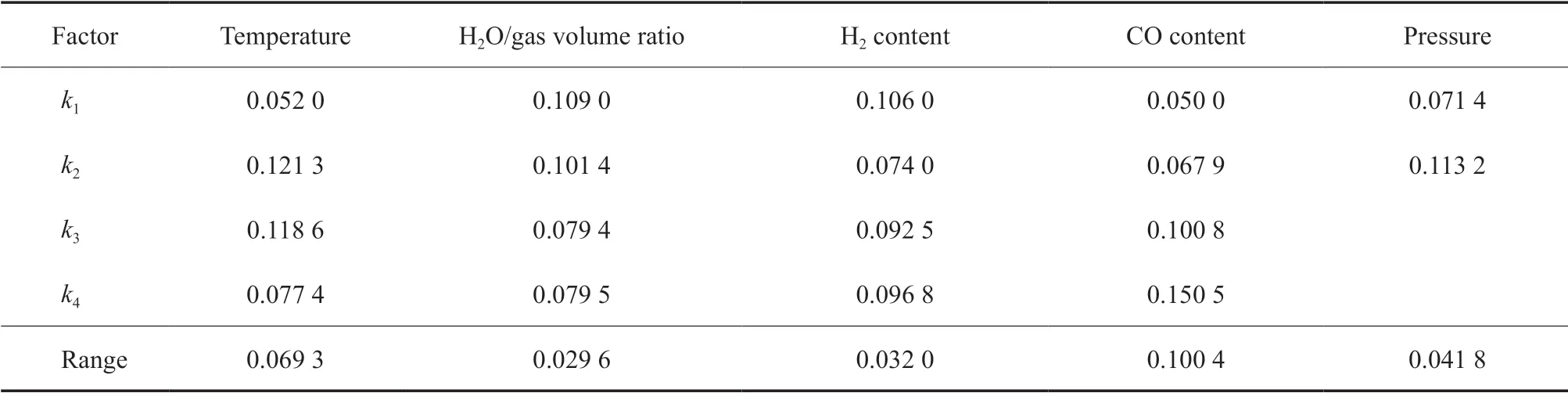
表2 以CO 转化量为优化目标时的极差分析结果Table 2 The results of the range analysis with CO conversion as optimization objective
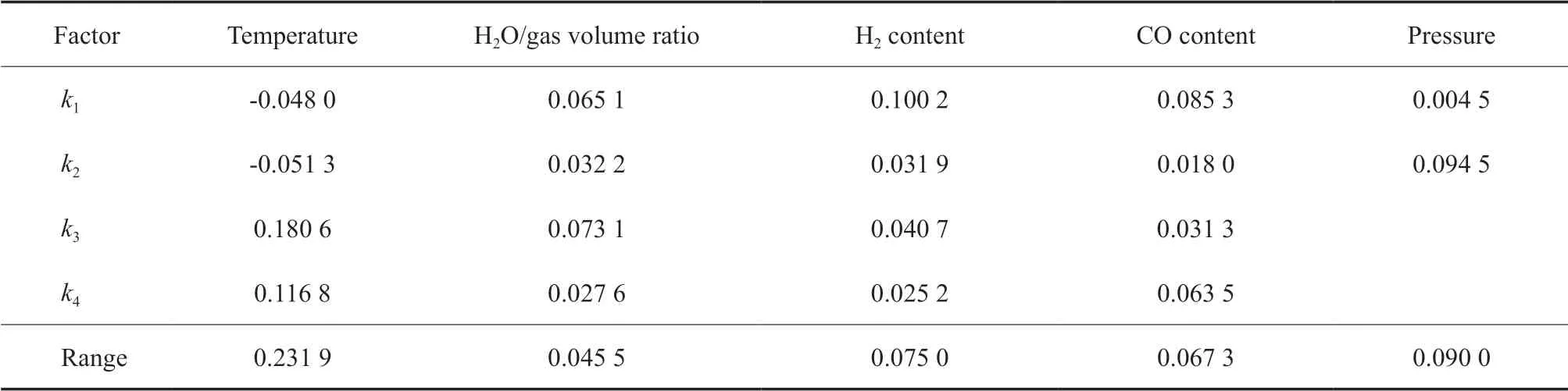
表3 以H2 转化量为优化目标时的极差分析结果Table 3 The results of the range analysis with H2 conversion as optimization objective
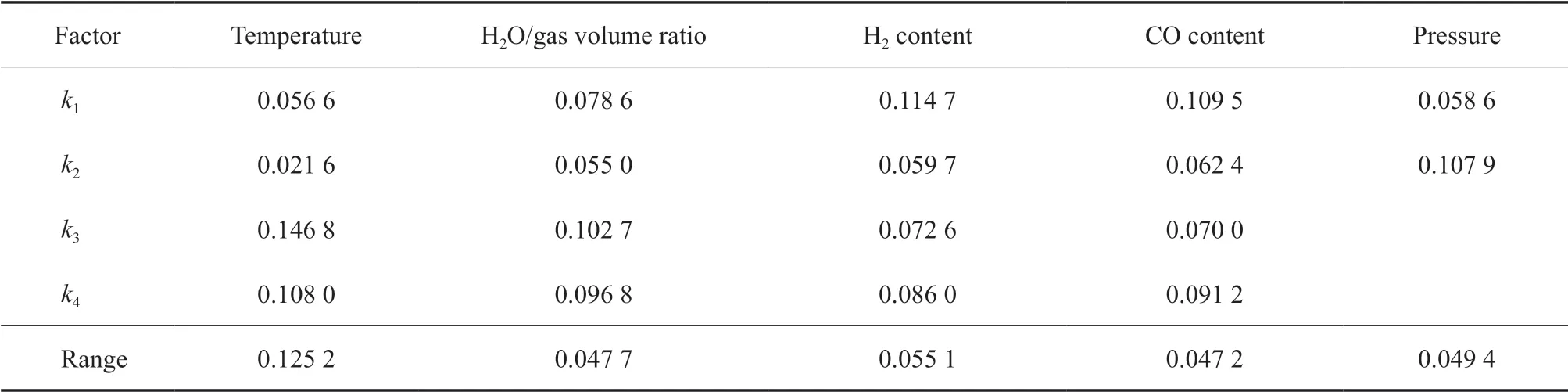
表4 以CO2 生成量为优化目标时的极差分析结果Table 4 The results of the range analysis with CO2 production as optimization objective
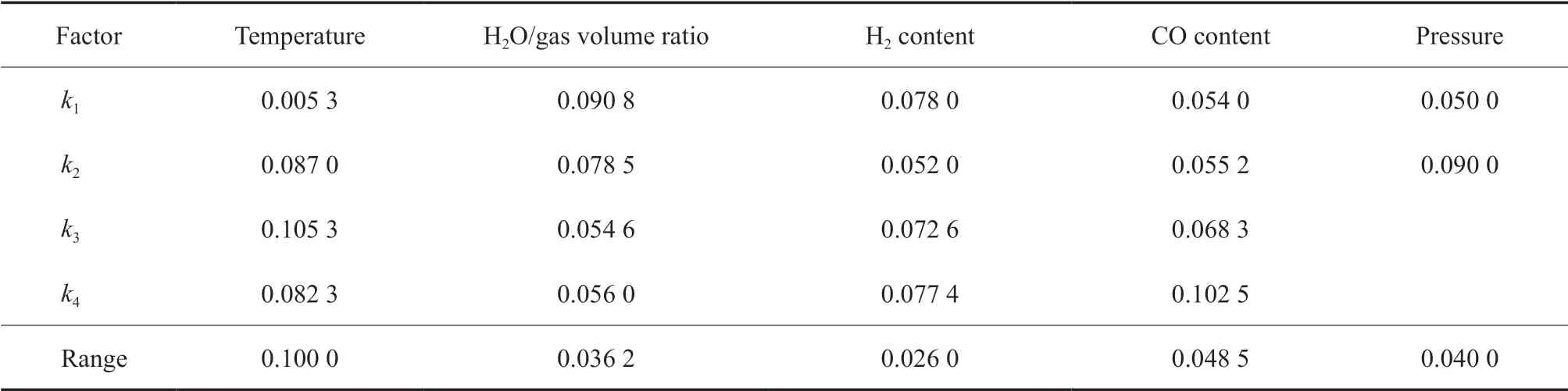
表5 以CH4 生成量为优化目标时的极差分析结果Table 5 The results of the range analysis with CH4 production as optimization objective
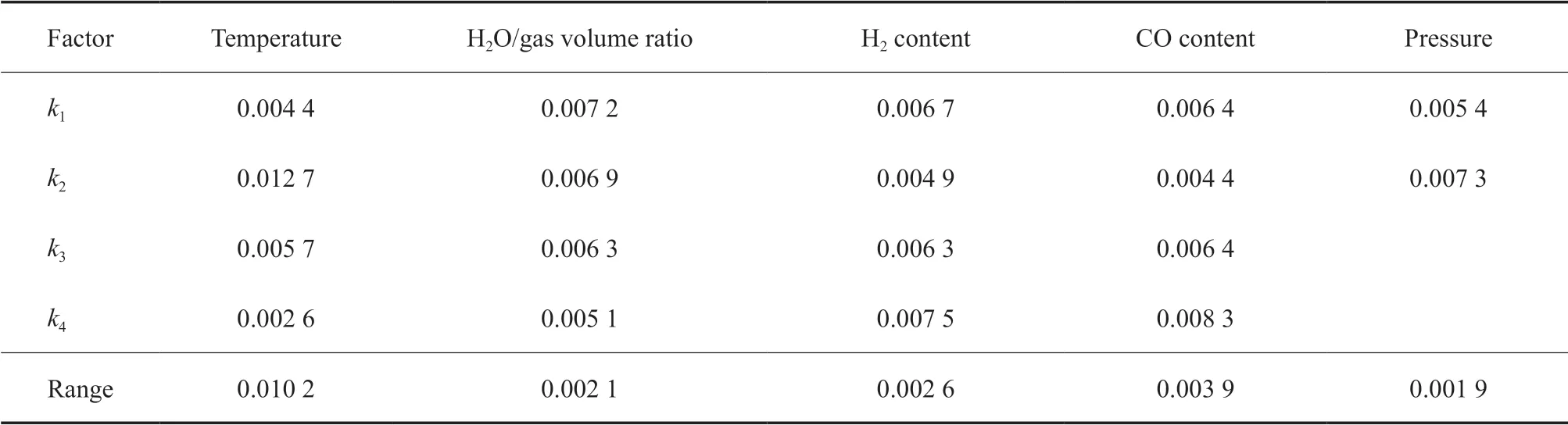
表6 以C2H6 生成量为优化目标时的极差分析结果Table 6 The results of the range analysis with C2H6 production as optimization objective
2.3 动力学模型的建立
采用半经验动力学模型,该模型具有一定的外推能力,可以满足工业反应器设计需要。反应方程见式(1)~(3)。其中,式(1)为甲烷化反应,式(2)为变换反应,式(3)为反应的副反应。
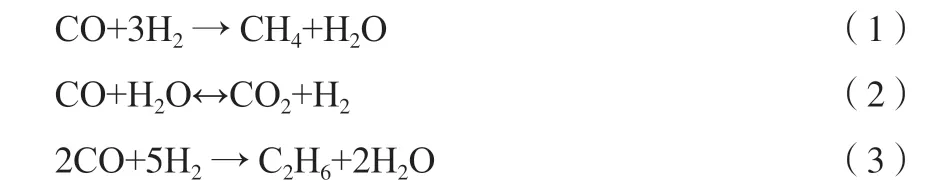
定义组分CO,H2,CH4,H2O,CO2,C2H6依次为1,2,3,4,5,6 号物质,则有:

设反应器中合成气物料流型为平推流,则根据式(7)~(12)可得到各物料的物料衡算方程。
动力学模型参数估计就是根据组分速率物料衡算方程由实验数据拟合未知参数,共有15 个动力学常数,分别为:,(见式(4)~(6))。动力学参数的估计方法:首先假设一组和,选定原料合成气各组分浓度为初值,通过四阶五级变步长Runge-Kutta 法求解微分方程,计算各总气体体积空速时对应的组分浓度值,与反应器出口的实验浓度值比较,若目标函数(残差平方和)满足终止条件,则假设的和为最终拟合值,否则按一定的优化计算方法重新产生新的k0和,直至目标函数达到终止条件为止[12]。
参数估计的目标函数为各组分浓度的残差平方和,参数估计的目的是使目标函数值达到最小,目标函数见式(13)。
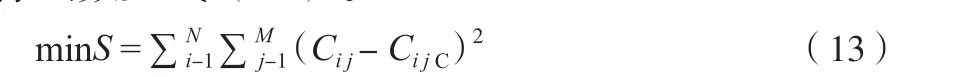
式中,N 为实验数据组数,M 为组分数,计算终止条件为:。
计算过程采用Matlab 编程计算[13],最优化计算采用非线性回归计算,通过Matlab 的内置函数非线性最小二乘法函数lsqnonlin 计算得到[14-15]。
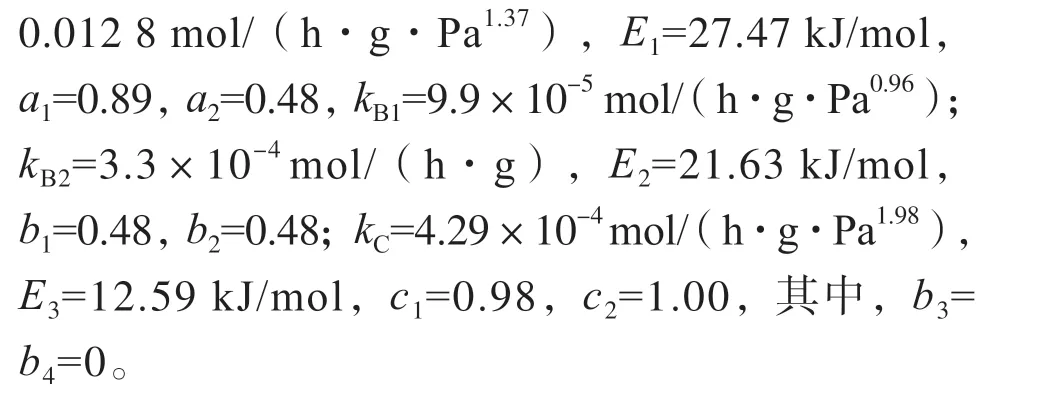
动力学模型的计算值与实验值对比结果见图3。从图3 可看出,所建立的动力学模型方程的计算值与实验值基本吻合。表明所建立的包括15 个动力学模型参数的耐硫变换-甲烷化催化剂动力学方程可以准确描述一氧化碳、氢气、二氧化碳、甲烷、乙烷等主要组分的反应速率,满足工业反应器的设计需要。
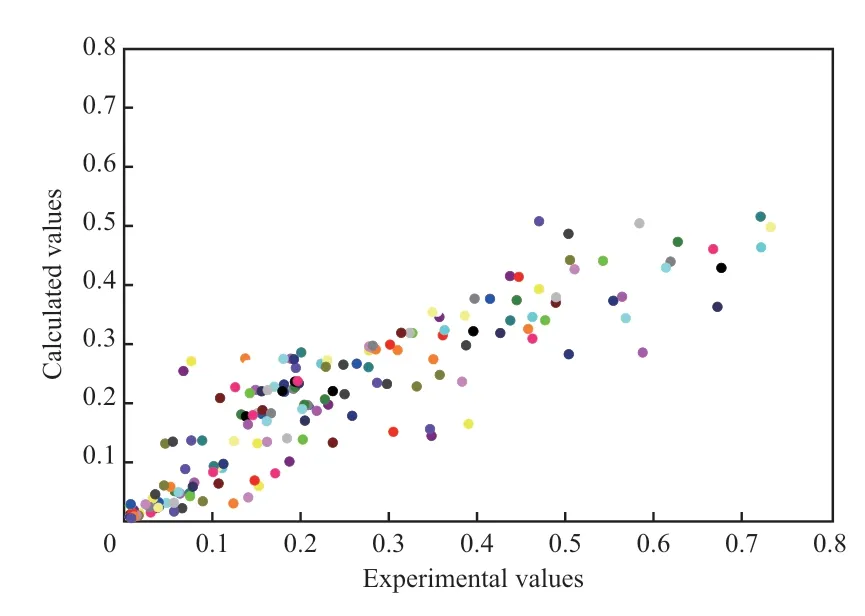
图3 反应动力学模型实验值与计算值的比较Fig.3 Comparison of the calculated values and the experimental values of the reaction kinetics model.
3 结论
1)采用正交实验考察了温度、水气体积比、氢气含量、一氧化碳含量和压力等因素对耐硫变换-甲烷化反应Mo/TiO2催化剂反应性能的影响,并用极差分析法进行了分析,温度、水气体积比、氢气含量、一氧化碳含量和压力等因素对不同优化目标的影响不同。
2)采用四阶Runge-Kutta 法求解动力学微分方程组,运用最优化方法回归得到动力学模型参数 为kA=0.012 8 mol/(h·g·Pa1.37),E1=27.47 kJ/mol,a1=0.89,a2=0.48,kB1=9.9×10-5mol/(h·g·Pa0.96);kB2=3.3×10-4mol/(h·g),E2=21.63 kJ/mol,b1=0.48,b2=0.48;kC=4.29×10-4mol/(h·g·Pa1.98),E3=12.59 kJ/mol,c1=0.98,c2=1.00,其中,b3=b4=0。
3)所建立的包括15 个动力学模型参数的耐硫变换-甲烷化催化剂动力学方程可以准确描述一氧化碳、氢气、二氧化碳、甲烷、乙烷等主要组分的反应速率,可以满足工业反应器的设计需要。
符 号 说 明
a1甲烷化反应速率方程CO 的反应级数
a2甲烷化反应速率方程H2的反应级数
b1变换反应速率方程CO 的反应级数
b2变换反应速率方程H2O 的反应级数
b3变换反应速率方程CO2的反应级数
b4变换反应速率方程H2的反应级数
C1~6C1~C6依 次 为CO,H2,CH4,H2O,
CO2,C2H6组分的浓度,mol/m3
c1副反应速率方程CO 的反应级数
c2副反应速率方程H2的反应级数
E1甲烷化反应活化能,kJ/mol
E2变换反应活化能,kJ/mol
E3副反应活化能,kJ/mol
Ea活化能初值,kJ/mol
FAO原料气流量,L/min
k0假设的指数前因子初值
kA甲烷化反应速率常数的方程指数前因子,
mol/(h·g·Pa1.37)
kB1变换反应速率常数的方程指数前因子(对
应反应物CO 和H2O),mol/(h·g·Pa0.96)
kB2变换反应速率常数的方程指数前因子(对应产物CO2和H2),mol/(h·g)
kC副反应速率常数的方程指数前因子,mol/(h·g·Pa0.96)
M 组分数
m 催化剂质量,g
N 实验数据组数
rA甲烷化反应速率,mol/(h·m3)
rB变换反应速率,mol/(h·m3)
rC副反应速率,mol/(h·m3)
S 目标函数
Sn,Sn-1迭代n,n-1 次的目标函数
T 温度,K
t 时间,min下角标
i,j 矩阵代号

扫码了解更多相关
专题研究信息

