6个不同种源任豆树幼苗对干旱胁迫的生理响应
陆奇丰 黄至欢 唐文秀

摘 要:任豆树是喀斯特地区具有重要生态和经济价值的保护植物,其树叶可作为饲料,然而不同种源任豆树耐旱性鲜有研究。本研究以广西6个不同地理种源(大新、乐业、上林、忻城、龙胜、南丹)的1年生任豆树幼苗为试验材料,采用盆栽人工控水模拟自然干旱胁迫条件,测定不同干旱胁迫阶段任豆树幼苗叶片的相对含水量、脯氨酸、可溶性糖、丙二醛(MDA)含量变化及超氧化物歧化酶(SOD)和过氧化物酶(POD)活性变化,并采用隶属函数法对不同种源任豆树的抗旱性进行综合评价。结果表明:随着干旱胁迫时间的延长,6个种源任豆树幼苗叶片相对含水量逐渐减少而可溶性糖含量逐渐增加;游离脯氨酸含量在大新和乐业种源呈持续上升趋势,上林、忻城和龙胜种源呈升—降—升的趋势,而南丹种源在4 d时下降后持续上升;MDA含量在大新、上林、忻城和龙胜种源呈升—降—升的趋势,乐业种源呈降—升—降的趋势,而南丹种源则在4 d时降低后持续升高;SOD活性在大新种源呈升—降—升的趋势,乐业种源在4 d时升高后持续下降,上林和龙胜种源持续上升,忻城和南丹则呈降—升—降的趋势;POD活性除南丹持续上升外,其他种源均呈升—降—升的趋势,且除龙胜在4 d时达到最大值外均在12 d时达到最大值。根据隶属函数法综合評价不同种源任豆树耐旱能力大小为龙胜>大新>乐业>上林>南丹>忻城。
关键词:种源;任豆树;幼苗;干旱胁迫;生理响应
中图分类号:Q945.78; S792.99 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.08.001
Abstract: Zeniain signis Chun, which is an important protected tree endemic to Karst area with leaves used for fodder, has important ecological and economic value in south China. However, little was known about the drought resistance capability of Z. signis from different provenances. The experiment was conducted with one-year Z. signis seedlings leaves from 6 provenances (Daxin, Leye, Shanglin, Xincheng, Longsheng, Nandan) in Guangxi, the physiological parameters of leaf relative water content, free proline content, soluble sugar content, malondialdehyde (MDA) content, superoxide dismutase (SOD) activity and peroxidase (POD) activity were measured under artificial simulated natural drought stress environment. The results showed that with the prolongation of drought stress, the leaf relative water content decreased while the soluble sugar content increased in all the six provenances; the free proline content showed an increasing trend in Daxin and Leye, an up-down-up trend in Shanglin, Xincheng and Longsheng, and a decreasing at 4 d then increasing trend in Nandan; the MDA content showed an up-down-up trend in Daxin, Shanglin, Xincheng and Longsheng, a down-up-down trend in Leye, and a decreasing at 4 d then increasing trend in Nandan; the SOD activity showed an up-down-up trend in Daxin, an increasing at 4 d then decreasing trend in Leye, an increasing trend in Shangling and Longsheng, and a down-up- down trend in Xincheng and Nandang; the POD activity showed an increasing trend in Nandan, and an up-down-up trend in the others which the POD activity maximum were appeared at 12 d except Longsheng (4 d). According to the comprehensive evaluation of membership function method, the drought tolerances of six Z. signis provenances were showing as followed: Longsheng>Daxin> Leye>Shanglin>Nandan>Xincheng.
Key words: provenances; Zeniain signis Chun; seedling; drought stress; physiological responses
任豆树(Zeniain signis Chun),又称翅荚木、任木,是国家二级重点保护植物,为苏木科任豆属落叶高大乔木,属内单种,主要分布于我国华南与西南地区石灰岩地带,是广西南部岩溶地区的局域广布种[1-3]。任豆树萌芽更新快,生长迅速,成材成林快、树形高大,适应性强、耐旱热、根具根瘤且吸附重金属能力强等特点[4-5],叶片中蛋白含量高,可开发为畜牧饲料,且叶片易腐烂分解,可改良土壤,也可开发为绿肥[6-7]。目前对任豆树的研究主要集中在其抗寒性[2]、遗传多样性[2-3]、快繁技术[8]、重金属吸附[4-9]、不同地理种源生长变异[10]等方面,但关于不同地理种源间任豆树对干旱胁迫敏感程度的比较研究尚未见报道。目前的研究表明:不同地理种源的物种间的抗旱能力有着显著性差异[11]。因此,对不同地理种源的任豆树耐旱能力进行评定,筛选出高耐旱树种具有重要意义。
本研究以来源于广西6个典型石灰岩地区的1年生盆栽任豆树幼苗为试验材料,采用人工控水模拟土壤自然干旱,探讨干旱胁迫下任豆树幼苗叶片的水分状况、可溶性糖、酶活性等生理生化指标的变化规律,旨在对6个不同地理种源任豆树耐旱能力进行综合评价,为石灰岩地区石漠化植被恢复和生态重建树种选育提供参考。
1 材料和方法
1.1 试验材料
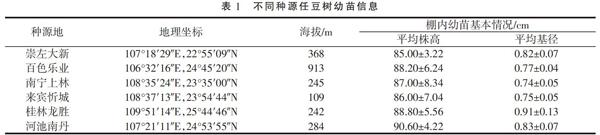
试验材料采集地数据由广西植物研究所刘演研究员赠予,从中选取6个极富代表性的石灰岩地区进行种子采集,种子母本均为本地野生种,种子采集后进行常规种子播种育苗,选择生长状况较为一致的1年生任豆树幼苗作为试验材料,移栽入塑料盆中进行盆栽试验。任豆树种子来源地信息及幼苗生长状况见表1。
1.2 试验设计
试验选择在广西植物研究所防雨大棚内进行。
于2017年5月选取长势良好、大小较为一致的1年生任豆树幼苗移栽入深为23 cm,直径20 cm的黑色塑料盆中,栽培基质为南方常见红壤土(pH值为7.70,有机质为36.63 g·kg-1,全氮为2.01 g·kg-1,全磷1.4 g·kg-1,全钾为12.10 g·kg-1),每盆装入1.5 kg,每盆移栽任豆树幼苗1株,共计240株(6个种源×40株)。幼苗栽植后,移入防雨大棚内,进行正常浇水管护,并保持土壤含水量为(26.42±1.75)%,待幼苗恢复生长2个月后进行停水处理,令土壤自然失水获得干旱胁迫梯度。在自然干旱第0(停水当天),4,8,12天的上午8:00—9:00进行采样,每次采样选取每个种源任豆树各10株,每株选取植株位置相同功能叶片(枝条顶端向下3~5片)10片进行混合,装入自封袋后置于冰盒内,重复采集3次,以此作为生物学重复,同时测定土壤含水量。
1.3 测定项目与方法
采用土壤温湿度仪对土壤含水量进行测定,测定部位为任豆树根部附近和花盆边缘的中间部分,测定深度为5 cm。叶片相对含水量(RWC)采用烘干称重法[12];酸性茚三酮反应法测定叶片游离脯氨酸[13];硫酸-蒽酮法测定叶片可溶性糖含量;愈创木酚法测定过氧化物酶(Peroxidase,POD)活性[13];氯化硝基四氮唑蓝(NBT)光化还原法测定叶片超氧化物歧化酶(Superoxide dismutase,SOD)[13];丙二醛(Malonaldehyde,
MDA)含量采用南京建成MDA试剂盒测定。
1.4 数据处理
采用SPSS16.0对植物材料在干旱脅迫下的叶片相对含水量、游离脯氨酸、可溶性糖、MDA含量、SOD和POD活性酶活性进行单因素(one-way ANOVA)方差分析,并采用LSD法进行多重比较检验,检验显著性水平为P<0.05。
参照文献[14]和[15]方法,采用隶属函数法对参试材料的耐旱性进行评价,以6种不同种源任豆树在不同干旱胁迫下的叶片相对含水量、可溶性糖、游离脯氨酸、MDA、SOD和POD作为指标进行综合评价。通过各指标的具体隶属函数值计算其平均值,并进行比较。计算公式如下:
隶属函数U(Xi)= (Xi-Xmin)/(Xmax-Xmin)
若该指标与耐旱性呈负相关,如丙二醛等指标,则通过反隶属函数计算其隶属函数值。
反隶属函数U(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
平均隶属函数Uj=ΣU(Xi)/n
式中,Xi为指标测定值,Xmax、Xmin分别为所有参试材料某一指标的最大值和最小值,Uj为平均抗旱隶属值,数值越大,表明耐旱能力越强。
2 结果与分析
2.1 干旱胁迫对土壤含水量的变化
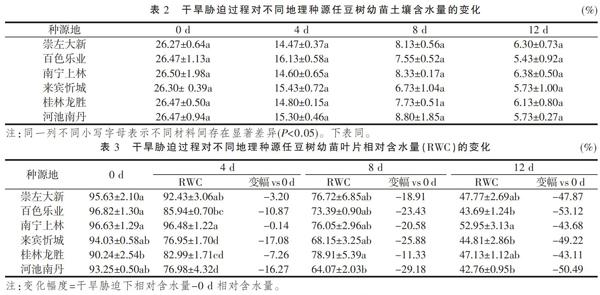
随着停水时间的持续,土壤含水量逐渐降低(表2),不同种源任豆树幼苗在停水0~8 d时,土壤含水量下降较快,而在8~12 d,下降速度趋于平稳。在相同处理天数中不同种源任豆树幼苗土壤含水量间差异均不显著(P>0.05),表明在相同处理下所有种源任豆树幼苗受到较为一致的水分胁迫。
2.2 干旱胁迫对任豆树幼苗叶片相对含水量(RWC)的影响
由表3可知,随着干旱胁迫时间的延长,不同种源任豆树幼苗叶片相对含水量均呈下降趋势,且种源之间具有一定的差异。0 d时,龙胜显著低于大新、乐业和上林(P<0.05),而忻城和南丹与其他种源差异均不显著(P>0.05);4 d时,上林>大新>乐业>龙胜>南丹>忻城,除大新与乐业和上林,龙胜与乐业和南丹差异不显著(P>0.05)外,其他种源间差异均显著(P<0.05);8 d时,龙胜显著高于南丹(P<0.05),其他种源间差异均不显著(P>0.05);12 d时,上林显著高于乐业、忻城和南丹,其他种源间差异均不显著(P>0.05)。综合说明不同种源任豆树叶片相对含水量对土壤失水的敏感性存在一定的差异,在0~4 d时,乐业、忻城和南丹下降幅度较大,保水能力较弱,大新、上林、龙胜下降幅度较小;8 d时,龙胜叶片相对含水量下降幅度最小,为11.33%,其他种源地均有较大幅度的下降;12 d时,所有种源任豆树叶片相对含水量达到最低,下降幅度表现为乐业>南丹>忻城>大新>上林>龙胜。由此可见,不同种源任豆树幼苗叶片含水量在干旱胁迫时,水分亏损表现有所差异,其差异可能与来源地差异有关。
2.3 干旱胁迫对任豆树渗透调节物质的影响
植物游离脯氨酸含量与耐旱能力正相关[15-16]。由表4可知,随着干旱胁迫时间的延长,大新和乐业种源任豆树幼苗游离脯氨酸含量呈持续上升的趋势,上林、忻城和龙胜种源呈升—降—升的趋势,而南丹种源呈4 d时下降后持续上升的趋势。0 d时,忻城和南丹显著高于大新、乐业和龙胜(P<0.05),与上林无显著性差异(P>0.05),乐业与大新、上林和龙胜均无显著性差异(P>0.05);胁迫至4 d时,忻城游离脯氨酸含量显著高于其他种源(P<0.05),而其他种源间无显著差异(P>0.05);8 d时,南丹显著高于其他种源(P<0.05),大新和乐业显著高于上林、龙胜(P<0.05),均与忻城无显著差异(P>0.05);12 d时,南丹显著高于除大新外的其他种源(P<0.05),大新显著高于乐业和忻城(P<0.05),乐业、上林、忻城和龙胜间无显著差异(P>0.05)。在研究中发现,南丹、上林分别在4 d、8 d时低于0 d水平;在12 d时,除忻城外其他种源的任豆树幼苗游离脯氨酸含量均达到各自的峰值,其升幅顺序为龙胜>大新>南丹>乐业>上林>忻城,表明随着胁迫程度加重,游离脯氨酸含量进一步积累,维持细胞渗透压平衡。
由表5可以看出,随着干旱胁迫时间的延长,不同种源任豆树幼苗可溶性糖含量的变化均呈增加趋势。0 d时,除忻城显著低于大新和南丹外(P<0.05),其他种源间差异不显著(P>0.05);4 d时,乐业显著高于其他种源(P<0.05),其他种源间无显著差异(P>0.05);8 d时,南丹显著高于其他种源(P<0.05),其他种源间无显著差异(P>0.05);12 d时,除忻城显著高于大新外(P<0.05),其他种源与二者均无显著差异(P>0.05)。此外,研究中发现大新种源在干旱胁迫过程中,其可溶性糖含量升幅最小,升幅最大为忻城种源;干旱胁迫至12 d时,可溶性糖含量均达到各自峰值,表明任豆树幼苗在受到持续干旱胁迫时,可溶性糖不断积累,参与维持细胞膨压,但不同来源任豆树间升高幅度存在一定的差异。
2.4 干旱胁迫对任豆树幼苗丙二醛(MDA)含量的影响
表6显示,随着干旱胁迫时间的延长,大新、上林、忻城和龙胜种源MDA含量呈升—降—升的趋势,乐业种源呈降—升—降的趋势,而南丹种源则呈4 d时降低后持续升高的趋势。0 d时,乐业、龙胜和南丹种源MDA含量显著高于大新、上林和忻城种源(P<0.05);4 d时,龙胜MDA含量最大,忻城次之,二者差异显著且均显著高于其他种源(P<0.05),其他种源间差异不显著(P>0.05);8 d时,乐业显著高于其他种源(P<0.05),忻城、南丹高于大新、上林种源(P<0.05),而这4个种源与龙胜差异均不显著(P>0.05);12 d时,南丹显著高于其他种源(P<0.05),大新和上林显著低于忻城和龙胜种源(P<0.05),乐业显著高于上林种源(P<0.05),但与大新、忻城、龙胜种源差异均不显著(P>0.05)。此外,在干旱胁迫中不同种源任豆树幼苗MDA含量变化存在一定的差异,4 d时忻城、大新和龙胜种源升幅较大,乐业和南丹种源MDA含量低于0 d水平;而在8 d和12 d时所有种源MDA含量均大于0 d水平,且维持在较高的含量,其中12 d时忻城和南丹种源升高幅度较大,表明其细胞受损程度较高。
2.5 干旱胁迫对任豆树抗氧化酶活性的影响
从表7可以看出,随着干旱脅迫时间的延长,大新种源任豆树幼苗叶片超氧化物歧化酶(SOD)活性呈升—降—升的趋势,乐业种源呈4 d时升高后持续下降的趋势,上林和龙胜种源呈持续上升的趋势,忻城和南丹则呈降—升—降的趋势。在0 d时,南丹、乐业种源任豆树幼苗SOD酶活性显著高于其他种源(P<0.05),大新种源显著低于上林、忻城和龙胜种源(P<0.05),后三者间差异不显著(P>0.05);4 d时,乐业显著高于其他种源(P<0.05),大新与上林、龙胜种源无显著差异(P>0.05),显著高于忻城和南丹种源(P<0.05),上林、忻城、龙胜和南丹种源间无显著差异(P>0.05),其中大新种源上升幅度最大,而忻城和南丹种源低于0 d水平;8 d时,忻城和南丹种源无显著差异(P>0.05),但显著高于其他种源(P<0.05),其他种源间差异亦显著(P<0.05),其中忻城和龙胜种源上升幅度较大,乐业种源低于0 d和4 d水平;12 d时,龙胜和上林、南丹和忻城、大新和乐业种源差异不显著(P>0.05),但相互间差异均显著(P<0.05),其中升高幅度最大的为龙胜种源,其次为大新和上林种源,而乐业、南丹种源均低于0 d水平。表明在一定的干旱胁迫程度下,植物可通过增加SOD活性,提高自身适应能力,而随着胁迫程度的加深,超出其耐受范围时,SOD活性随之下降[14,17],这在乐业、忻城和南丹种源体现较为明显,而上林和龙胜的SOD活性处于持续上升的状态,说明其可能未超出干旱耐受范围。
由表8可知,随着干旱胁迫时间的延长,任豆树幼苗过氧化物酶(POD)活性除南丹呈持续上升趋势外,其他种源均呈升—降—升的趋势,且除龙胜在4 d时达到最大值外,其他种源均在12 d时达到最大值。0 d时,忻城POD酶活性最高,显著高于其他种源任豆树幼苗(P<0.05),其次为南丹、上林,显著高于龙胜、大新和乐业种源(P<0.05),龙胜又显著高于大新和乐业种源(P<0.05),后二者之间差异不显著(P>0.05);4 d时,忻城和南丹POD活性显著高于其他种源(P<0.05),其他种源间无显著差异(P>0.05);8 d时,南丹显著高于忻城二者均显著高于其他种源(P<0.05),大新、上林均显著高于龙胜种源(P<0.05),乐业与三者差异均不显著(P>0.05);12 d时,南丹和忻城显著高于上林种源三者均显著高于其他种源(P<0.05),大新、乐业和龙胜间无显著差异(P>0.05)。任豆树幼苗POD活性在干旱胁迫至12 d时,以大新和南丹种源升高幅度最大;不同胁迫时间各种源POD活性均大于0 d水平,表明在干旱胁迫下,任豆树幼苗POD酶活性升高,清除氧自由基,减轻其对细胞膜的破坏。
2.6 不同种源任豆树耐旱综合评价
干旱胁迫中不同种源任豆树幼苗的各生理生化指标变化存在一定差异,因此采用单一生理生化指标难以考察其耐旱能力强弱,利用隶属函数可综合多指标客观评价其耐旱能力。本研究以干旱胁迫下的4,8,12 d叶片相对含水量、游离脯氨酸含量、可溶性糖含量、丙二醛含量、超氧化物歧化酶活性、过氧化物酶活性的各指标变化幅度为依据,进行隶属函数计算,并计算出各指标在干旱胁迫下4,8,12 d隶属函数平均值,再综合计算各种源的平均隶属函数值,以此进行排序,平均数值越大,表明其耐旱能力越强,反之,则越弱。由表9可知,各种源耐旱能力大小为龙胜>大新>乐业>上林>南丹>忻城,其平均隶属函数分别为0.581,0.564,0.475,0.463,0.449和0.398。
3 结论与讨论
不同来源地的同一种植物在长期适应所在地的环境(温度、水分等)中,其抗逆能力往往会有所差异,主要体现在形态解剖特性、组织含水、渗透物质、抗氧化酶活性、光合等生理生化方面的差异[18-19]。
叶片相对含水量是直接反映植物水分情况的重要指标[20]。本试验中,随着土壤含水量的下降,不同种源任豆树幼苗叶片相对含水量均呈现下降趋势,但不同种源间下降幅度有一定差异,其中乐业、南丹种源相对含水量下降幅度大于其他种源,在胁迫12 d时,下降幅度达到50%以上;而龙胜种源任豆树叶片含水量变化幅度最小,分别为43.11%,表明其保水能力强于其他种源地任豆树幼苗。
水分亏缺时,细胞渗透势降低,水势升高,植物可通过控制胞内溶质含量对渗透势进行调节,维持细胞膨压,同时还能过促进对胞内活性氧的清除,维持正常生理功能,其中植物细胞内游离脯氨酸、可溶性糖等是调节植物细胞渗透势重要物质,其含量变化与抗旱性密切相关[15,20-22]。本研究中,不同种源任豆树游离脯氨酸和可溶性糖含量呈上升趋势,在胁迫12 d时,各种源任豆树中脯氨酸和可溶性糖含量均达到各自峰值,表明干旱胁迫中任豆树幼苗通过积累脯氨酸和可溶性糖含量提高细胞渗透势,维持细胞膨压,进一步增强其抗旱性[20],其中龙胜和忻城种源分别在脯氨酸含量和可溶性糖含量升高幅度最大,具有较强的耐旱能力。
在干旱、盐害等环境中,植物往往会产生大量氧自由基破坏细胞膜脂,引起细胞损伤,丙二醛(MDA)是膜脂过氧化过程重要产物,其含量变化反映膜氧化及细胞损伤程度[23]。本研究发现,不同种源任豆树幼苗丙二醛(MDA)含量在干旱胁迫下基本呈现增加趋势,表明任豆树细胞膜脂过氧化作用逐渐增强,细胞膜受到一定的损伤,但不同种源任豆树幼苗间MDA含量变化幅度有所差异,其中乐业与龙胜干旱胁迫期间MDA含量表现为降低后再升高趋势,与丁龙等[14]研究结果相似,推测其降低的原因可能是在采样期间正好处于MDA含量下降阶段,干旱胁迫对其细胞的损伤较小,而抗氧化酶的活性升高,从而有效地降低活性氧水平;而上林种源在胁迫期间MDA含量增加幅度最小,表明该种源任豆树幼苗在胁迫期间膜质过氧化程度相对较小。
随着活性氧自由基的增加,植物体内抗氧化酶活性增加,以降低逆境对植物细胞的的伤害,其中超氧化物歧化酶(SOD),过氧化物酶(POD)在逆境下,能协同清除植物体内氧自由基,减低其对膜系统、DNA等活性物质的损伤,提高植物抗性[24]。有研究認为,干旱胁迫初期,植物产生超氧阴离子,进而诱导SOD合成增加,其与超氧阴离子作用的产物(H2O2)进一步增多;随着干旱胁迫程度的加深,植物细胞受损严重,合成SOD基因被抑制,从而活性下降[17]。本研究发现,不同种源任豆树幼苗在胁迫过程中,其SOD活性变化趋势有所差异,大新种源任豆树幼苗叶片SOD活性呈升—降—升的趋势,乐业种源呈4 d时升高后持续下降的趋势,上林和龙胜种源呈持续上升的趋势,忻城和南丹则呈降—升—降的趋势,表明干旱胁迫下,不同种源任豆树SOD响应机制有所差异,龙胜与大新种源的合成SOD较为活跃,而乐业、南丹种源合成SOD受到较强的抑制作用,细胞受损较为严重。POD具有消除H2O2等细胞内过氧化物的作用[17],本研究中,任豆树幼苗POD活性除南丹呈持续上升趋势外,其他种源均呈升—降—升的趋势。此外,本研究在干旱胁迫下,不同种源任豆树幼苗SOD和POD活性变化存在差异,而POD活性变化幅度远大于SOD,推测任豆树幼苗POD活性对干旱胁迫的敏感程度大于SOD,在清除过氧化物中起着重要作用,进一步表明2种抗氧化酶在响应干旱胁迫的敏感性有所差异,也反映其清除活性氧机制有一定的差异性[17,25]。
植物抗旱性由多因素调控的复杂性状,以单一的生理变化对植物抗旱性进行考察缺乏客观性,难以反映植物整体的抗旱能力[26],而隶属函数分析为多指标测定下的材料抗旱性进行综合评价提供思路。目前,隶属函数分析已广泛运用于多种物种的抗旱性评价,如蕨类[27]、黑果枸杞[14]、沙芥[15]等。因此,本研究通过对不同干旱胁迫时间6个生理指标的变化幅度值进行隶属函数计算,并以此对不同种源任豆树抗旱性进行综合评价,其耐旱性强弱排序结果为:龙胜>大新>乐业>上林>南丹>忻城,该结果与测试指标变化基本一致,即龙胜、大新种源地任豆树幼苗在试验中叶片保水力较强、植物细胞受损程度较小,乐业、上林次之,而忻城和南丹在胁迫期间水分保水力最弱,细胞受损程度较严重。本研究仅在不同种源任豆树幼苗叶片生理生化方面对其进行耐旱能力研究,并初步得出其耐旱能力的强弱,为明确其耐旱能力,还需要进一步从多个方面(如致死率、根系生长情况等)进行深入研究。
参考文献:
[1]刘演,宁世江.广西重点保护野生植物资源的现状与评价[J].广西科学,2002,9(2):124-132.
[2]何小勇.翅荚木种源遗传多样性及其抗低温胁迫能力研究[D].长沙:中南林业科技大学,2007.
[3]林玮,周玮,周鹏,等.基于SRAP标记的任豆遗传多样性分析[J].华南农业大学学报,2017,38(1):82-89.
[4]李霞,彭霞薇,伍松林,等.丛枝菌根对翅荚木生长及吸收累积重金属的影响[J].环境科学,2014,35(8):3142-3148.
[5]ZHAO X, LIU J, XIA X, et al. The evaluation of heavy metal accumulation and application of a comprehensive bio-concentration
index for woody species on contaminated sites in Hunan, China[J]. Environmental science and pollution research, 2014, 21(7):5076-5085.
[6]范霭萱,梁兆彦,宋喜宣.值得开发利用的木本饲料——任豆树[J].广西畜牧兽医,1995,11(2):20-23.
[7]KIM S E, KIM H S, HONG Y S, et al. Sesquiterpene esters from Celastrus orbiculatus and their structure-activity relationship on the modulation of multidrug resistance[J]. The journal of nature products, 1999, 62(5): 697-700.
[8]周宇晴,张俊杰,韦雪芬,等.任豆叶片的愈伤组织诱导和植株再生[J].植物生理学报,2017,53(9):1659-1665.
[9]覃勇荣,盘芳丽,吴达伟,等.重金属胁迫背景下的任豆幼苗抗性生理试验[J].河池学院学报,2015,35(2):1-8.
[10]邝雷,周玮,邓小梅,等.不同种源任豆苗期生长性状的变异[J].西部林业科学,2017,46(3):165-168.
[11]贾遂民,王国霞,杨玉珍.不同种源香椿抗旱性的坐标综合评定[J].河南科学,2013,31(3):289-292.
[12]宋维民,周海燕,贾荣亮,等.土壤逐渐干旱对4中荒漠植物光合作用和海藻糖含量的影响[J].中国沙漠,2008,28(3):449-454.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[14]丁龙,赵慧敏,曾文静,等.五种西北旱区植物对干旱胁迫的生理响应[J].应用生态学报,2017,28(5):1455-1463.
[15]郑清岭,杨冬艳,刘建文,等.干旱胁迫对沙芥和斧形沙芥幼苗生长及抗氧化系统的影响[J].植物生理学报,2017,53(4):600-608.
[16]潘昕,邱权,李吉跃,等.干旱胁迫对青藏高原6种植物生理指标的影响[J].生态学报,2014,34(13):3558-3567.
[17]何建社,张利,刘千里,等.岷江干旱河谷区典型灌木对干旱胁迫的生理生化响应[J].生态学报,2018,38(7):2362-2371.
[18]张兰,韦小丽,龙鹏,等.不同种源棕榈幼苗对干旱胁迫的响应及抗旱性评价[J].东北林业大学学报,2017,45(11):1-5.
[19]唐承财,钟全林,王健.林木抗旱生理研究进展[J].世界林业研究,2008,21(1):20-26.
[20]梁丹妮,郭兴燕,兰剑. 6份沿阶草种质对干旱胁迫的生理响应[J].草业科学,2016,33(2):184-191.
[21]刘雪,陈涛,蒋亚荣,等.6种宿根花卉在土壤干旱胁迫下的生理变化与抗旱性关系[J].西北农业学报,2017,26(1):70-78.
[22]SCHURR U, HECKENBERGER U, HERDEL K. Leaf development in Ricinus communis during drought stress: dynamics of growth processes, of cellular structure and of sink-source transition[J]. Journal of experiment botany, 2000, 51: 1515-1529.
[23]ROBERT R C, BEWLERY J D. Lipid peroxidation associated with accelerated aging of soybean axes[J]. Plant physiol, 1980, 65: 245-248.
[24]王红梅,包维楷,李芳兰.不同干旱胁迫强度下白刺花幼苗叶片的生理生化反应[J].应用与环境生物学报,2008,14(6):757-762.
[25]刘锦春,钟章成,何跃军.干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系統的影响[J].应用生态学报,2011,22(11):2836-2840.
[26]魏永胜,梁宗锁,山仑,等.利用隶属函数值法评价苜蓿抗旱性[J].草业科学,2005,22(6):33-36.
[27]沈彦会,蔡静如,许建新,等.华南地区6种蕨类植物耐旱性研究[J].广西植物,2017,38(8):1032-1040.

