干酪乳杆菌LC01对小鼠肠道菌群和肠道转运调节作用的剂量效应
陆文伟,胡文兵,曹文金,杨震南,丁历伟,杨京梅,陈 卫,*
(1.江南大学食品学院,江苏 无锡 214122;2.杭州味全食品有限公司,浙江 杭州 310018)
人体肠道是一个极其复杂的微生态系统[1]。在这个微生态系统之中,肠道菌群、营养素以及宿主细胞有着紧密的联系[2-4]。肠道菌群中本身就含有条件致病菌,一旦肠道菌群失调可能会诱发这类细菌产生毒素或者侵染肠道黏膜,造成系统性的感染[5-6]。另外,肠道菌群的失调也会引起人体对相关营养素的代谢失衡。因此,肠道菌群的失调会给人体健康带来较大的负面影响[7]。越来越多的研究表明,肠道菌群的失调会引起肥胖、糖尿病、动脉粥样硬化和肠易激综合征等疾病[8-10]。
世界卫生组织和联合国粮食及农业组织定义益生菌是一类活的微生物,摄入足量益生菌会对宿主健康有益[11]。益生菌具有拮抗肠道致病菌,维持肠道内环境稳态,重建失调的肠道菌群以及调节肠道免疫系统等功效[12-15]。最常用于食品的益生菌主要是乳酸杆菌和双歧杆菌,且主要来源于发酵制品。酸奶不仅是一类风味良好、营养物质丰富的发酵制品,更是益生菌重要的食物载体。因此,从酸奶中筛选具有优良益生特性的益生菌菌株不仅安全,而且简单易行,具有十分重要的意义。
益生菌Lactobacillus caseiLC01具有良好的耐酸、耐胆盐特性,目前已被广泛用于乳品工业[16]。本研究以小鼠为实验动物,通过灌胃LC01菌株,结合高通量测序技术分析正常小鼠以及青霉素干预小鼠的肠道菌群差异,评价LC01菌株对小鼠肠道菌群的调节作用,并探讨其对小鼠肠道转运率的影响,为开发LC01菌株作为有益人体健康的益生菌提供基础研究数据。
1 材料与方法
1.1 动物、材料与试剂
清洁级BALB/c雄性小鼠130 只,体质量18~22 g,购自上海杰思捷实验动物有限公司,合格证号:311620400001877,生产许可证号:SCXK(沪)2013-0006。
Lactobacillus caseiLC01菌株(300亿组活菌数为1.25×108CFU/mL;600亿组活菌数为2.5×108CFU/mL)购自丹麦科汉森公司。
盐酸洛哌丁胺胶囊(2 mg/粒,6 粒/盒,批号:161028325) 西安杨森制药有限公司;注射用青霉素钠(0.48 g,8×105U/g,批号:20160303) 哈药集团有限公司兽药厂;MRS培养基 青岛海博生物技术有限公司;土壤基因组提取试剂盒 美国MP Biomedicals公司。
1.2 仪器与设备
GRP-9160型隔水式恒温培养箱 上海森信实验仪器有限公司;RC BIOS 10型冷冻离心机 赛默飞世尔科技(中国)有限公司;FE-20型pH计 瑞士梅特勒-托利多公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 菌悬液的制备
采用MRS液体培养基,37 ℃条件下静置培养LC01菌,生长至稳定前期时,室温条件下5 000 r/min离心5 min收集菌体,菌体沉淀用pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)清洗后,加入脱脂乳后冻干成菌粉。菌粉再经蒸馏水复溶后制成5×108CFU/mL菌悬液。
1.3.2 动物分组及处理条件
动物于屏障环境(使用许可证号:SYXK(苏)2016-0011)下饲养,室内环境温度(22±2)℃,相对湿度50%~60%。室内环境保持清洁、安静,12 h/12 h白天-黑夜循环光照。适应性喂养1 周后,小鼠随机分为3 个大组(模型1、模型2和模型3),分别用于评价LC01菌对正常小鼠菌群、青霉素处理后小鼠菌群以及便秘模型小鼠肠道转运的影响。具体分组和处理条件如表1所示,其中300亿组、600亿组服用LC01的剂量根据人与小鼠的等效剂量系数之算法换算得到,稀释1.3.1节制备的菌悬液灌胃小鼠。

表1 小鼠分组及处理情况Table 1 Grouping and treatment of mice
1.3.3 小鼠粪便宏基因组的提取
收集模型1和模型2小鼠停止灌胃一周后的小鼠粪便,使用土壤基因组提取试剂盒提取小鼠粪便的宏基因组。具体方法按照试剂盒说明书进行。
1.3.4 16S rRNA扩增分析
通过N a n o D r o p 2 0 0 0和琼脂糖凝胶电泳来评价提取效果,总体显示提取的基因组D N A浓度和纯度都符合进一步建库要求。使用引物515F(5'-GTGCCAGCMGCCGCGG-3')和907R(5'-CCGTCAATTCMTTTRAGTTT-3'),扩增细菌16S rRNA基因的V3~V4可变区,分析小鼠肠道菌群多样性。纯化后的聚合酶链式反应产物等量混合构建测序文库,使用Illumina的MiSeq测序平台进行测序。下机数据经过质控过滤得到有效序列用于分析小鼠肠道菌群在分别服用300亿活菌和600亿活菌的多样性变化。
1.3.5 小肠推进率的测定
末次给药0.5 h后,各组小鼠均用墨汁灌胃。0.5 h后立即脱颈处死小鼠,打开腹腔,剪取上端自幽门,下端至回盲肠结点的肠管,置于托盘上,轻拉小肠至直线,测量肠管长度为小肠总长度,幽门至墨汁前沿为墨汁推进长度,按照以下公式计算小肠推进率。

1.4 数据统计分析
实验数据的差异显著性采用Graphpad Prism 6.0软件进行单因素方差分析判断,P<0.05视为差异显著。
2 结果与分析
2.1 LC01菌株对正常小鼠肠道菌群的调节作用
2.1.1 LC01菌株对小鼠肠道菌群组成的影响

图1 不同LC01菌株剂量对正常小鼠肠道菌群丰度及多样性的影响Fig. 1 Effect of different doses of LC01 on relative abundance and diversity of intestinal microbiota in normal mice
如图1所示,正常小鼠灌胃2 周LC01菌株(300亿、600亿)后,小鼠肠道优势菌属(相对丰度大于1%)的结构组成并未发生显著变化,拟杆菌属(Bacteroides)、梭菌属(Clostridium)、毛螺菌(Lachnospira)、乳杆菌属(Lactobacillus)依旧为优势菌群,说明正常小鼠肠道优势菌属的组成相对稳定。进一步分析不同组别小鼠肠道菌群的β多样性来说明LC01菌株对小鼠肠道菌群的影响。

图2 不同LC01菌株剂量对小鼠肠道菌群结构β多样性的影响Fig. 2 Effect of different doses of LC01 on β diversity of intestinal microbiota in mice
如图2所示,相对于空白组,300亿组和600亿组小鼠肠道微生物菌群的β多样性具有显著差异。PCA分析发现,空白组、300亿组和600亿组小鼠肠道内菌群多样性均有明显的聚类现象,说明LC01菌株的灌胃剂量对小鼠肠道菌群结构的影响显著。
2.1.2 LC01菌株对小鼠肠道菌群不同菌属相对丰度的影响



图3 LC01菌株对小鼠肠道菌群不同菌属相对丰度的影响Fig. 3 Effect of LC01 on relative abundance of intestinal microbiota at the genus level
在菌群分析的基础上,进一步比较各个处理组小鼠肠道菌群中不同菌属相对丰度的变化。结果如图3所示,相对于空白组的(2.90±1.34)%,300亿和600亿组中的Lactobacillus属相对丰度均有显著增加,分别提高至(14.22±13.24)%(P<0.05)和(22.85±9.34)%(P<0.001),说明LC01菌株可以显著增加小鼠肠道内乳杆菌的相对丰度。乳杆菌属不同菌种具有显著的益生效果,包括抑制致病菌,改善肠道菌群结构,增强机体免疫功能,改善血脂,减轻乳糖消化不良症状,抗氧化等功效[17-20]。同时发现,活菌组的Bacteroides和Bacteroides S24-7属丰度显著增加(P<0.05),而同为拟杆菌门的Odoribacter属丰度则极显著降低(P<0.01)。相对于空白组,活菌组的毛螺菌科未定菌属丰度显著降低(P<0.05),而梭菌目未定菌属和Rikenellaceae未定菌属则均无统计学上的差异(P>0.05)。此外,600亿组Prevotella属相对丰度显著降低,由空白组的(3.97±1.37)%降低至(0.99±0.78)%(P<0.001),提示LC01菌株的细胞组份可以显著地抑制小鼠肠道内Prevotella属的增殖,并且菌量越高,其抑制效果越明显。研究发现Prevotella属是临床上较常见的一种条件致病菌,在促炎环境中很旺盛,并在风湿性关节炎中扮演着关键的角色[21-22]。LC01株的细胞组分可以显著降低小鼠肠道中Prevotella属的相对丰度,具有潜在缓解风湿性关节炎的作用。活菌组Helicobacter属的相对丰度显著降低,由空白组的(3.00±1.89)%降低至300亿组的(1.12±1.01)%(P<0.01)和600亿组的(0.82±0.42)%(P<0.001),表明LC01菌株可以显著降低小鼠肠道中Helicobacter属的相对丰度。Helicobacter属是人体条件致病菌,可引起慢性肠炎和胃癌等疾病,提示LC01菌株可能具有预防慢性肠炎和胃癌的功效。
2.2 LC01菌株对青霉素导致的肠道菌群失调的影响
2.2.1 LC01菌株显著改善青霉素导致的肠道菌群失调
肠道菌群失调可导致众多疾病,包括慢性代谢疾病、肝脏疾病和肠道疾病等[23]。因此,改善肠道菌群失调可营造良好的肠道环境,有利于维护人体健康。本研究利用青霉素构建肠道菌群失调小鼠模型,通过比较模型组和活菌组粪便中菌群丰度及多样性变化,评价LC01菌株对青霉素导致的小鼠肠道菌群失调的改善作用。

图4 不同LC01菌株剂量对青霉素引起的小鼠肠道菌群丰度变化的恢复作用差异Fig. 4 Effect of different doses of LC01 on changes in relative abundance of intestinal microbiota in penicillin-treated mice
如图4所示,相对于模型组,青霉素菌群失调小鼠灌胃两周LC01菌株(300亿或者600亿)后,肠道优势菌属拟杆菌属、梭菌属的相对丰度显著恢复,乳杆菌属的相对丰度则显著增加,且600亿组的效果优于300亿组。该研究结果表明LC01菌株有助于改善青霉素所致失调菌群,提示LC01在调节菌群失调方面具有一定潜力。
2.2.2 LC01菌株对青霉素干预小鼠肠道菌群不同菌属相对丰度的影响
如图5所示,与模型组相比,服用LC01菌株实验组的Lactobacillus属相对丰度均有所增加,300亿组可以基本恢复到青霉素处理前的水平,而600亿组则可以显著增加乳杆菌相对丰度,由模型组的(0.62±0.19)%提高至(9.92±3.25)%(P<0.001)。同时,活菌组的梭菌目和毛螺菌科未定菌属的相对丰度均显著增加(P<0.05)。梭菌目和毛螺菌科未定菌属代谢所产生的丁酸对肠癌具有显著的预防作用[24-26],提示LC01菌株可通过调节梭菌目和毛螺菌科未定菌的丰度来预防肠癌的发生。另外,600亿组极显著恢复了瘤胃菌科未定菌属以及Bacteroides属的丰度(P<0.01),并显著降低Prevotella属、Helicobacter属、Rikenellaceae未定菌属(Alistipes属为其代表性属)和Parabacteroides属丰度。其中,600 亿活菌的Prevotella属和Helicobacter属丰度降低最为显著(P<0.001)。综上结果表明,LC01菌株可显著恢复青霉素引起的小鼠肠道中Lactobacillus属,梭菌目、毛螺菌科和瘤胃菌科未定菌属相对丰度异常,同时降低条件性致病菌Prevotella属、Helicobacter属、Rikenellaceae未定菌属的相对丰度,对青霉素引起的小鼠肠道菌群失调具有显著的改善作用。

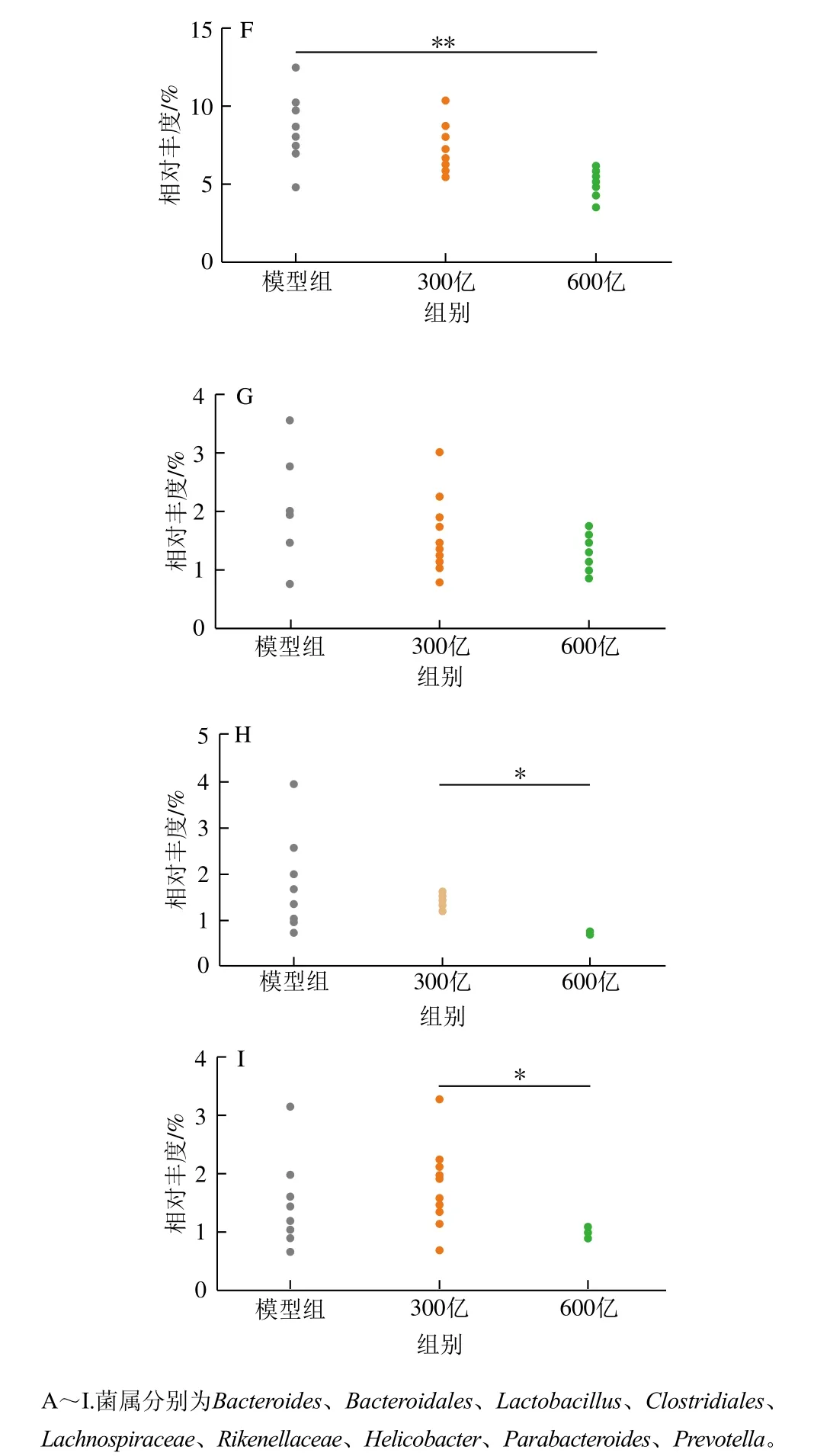
图5 青霉素建模后LC01菌株恢复和正常恢复小鼠肠道菌群属水平丰度差异分析Fig. 5 Variation analysis of relative abundance of intestinal microbiota between the LC01 treatment group and the control group at the genus level
2.2.3 LC01菌株对小鼠肠道转运的影响
便秘是一种常见的功能性胃肠道疾病,也是许多高死亡率疾病的诱发因素,已严重影响了人们的身体健康和生活质量[27-28]。研究表明,益生菌能够有效地缓解小鼠便秘,提示其在缓解便秘方面具有较大的潜力[29-30]。洛哌丁胺是一种阿片受体激动剂,可作用于肠壁阻止乙酰胆碱和前列腺素的释放,导致肠道蠕动的减缓,因而常用于便秘模型的造模[30]。本研究利用洛哌丁胺构建便秘小鼠模型,通过比较模型组和活菌组的排便数量、排便质量以及肠道推进率,评价LC01菌株对便秘小鼠肠道转运的影响。

图6 LC01菌株对小鼠肠道转运的影响Fig. 6 Effect of LC01 on intestinal peristalsis in mice
由图6可知,在洛哌丁胺干预后,模型组5 h内的排便数量、排便质量和肠道推进率分别为(1.6±1.0)粒、(25.4±17.3)g和(44.1±7.2)%,与空白组的(16.4±3.4)粒、(132.4±36.4)g和(57.22±4.60)%均有高度显著差异(P<0.001),说明造模成功。在LC01干预组中,5 h内的排便数量由模型组的(1.6±1.0)粒增加到300亿组的(4.6±1.7)粒和600亿组的(80.0±2.9)粒;排便质量由模型组的(25.4±17.3)g增加到300亿组的(55.0±19.8)g和600亿组的(82.0±16.9)g;肠道推进速率由模型组的(44.1±7.2)%恢复到300亿组的(50.6±4.2)%和600亿组的(55.2±4.1)%。上述结果表明,LC01菌株可以显著提高小鼠肠道的推进速率,增加排便数量和质量,从而有效缓解便秘。
3 结 论
本实验探究了干酪乳杆菌LC01菌株对小鼠肠道菌群和肠道转运的影响。结果发现,LC01菌株可明显提高正常小鼠肠道中Lactobacillus属和Bacteroides属的相对丰度,降低条件性致病菌Prevotella属、Helicobacter属的相对丰度,对小鼠肠道菌群具有显著的调节作用。另外,LC01菌株能够显著改善青霉素所致肠道菌群失调,并可促进洛哌丁胺引起的肠道转运速率缓慢症状的恢复。综上,LC01菌株对小鼠肠道菌群具有一定的调节作用,并且对肠道转运有着良好的促进作用,说明LC01菌株具有潜在的益生作用,有利于肠道健康。

