子宫内膜间质肿瘤临床病理分析
卢 婷,王文超,赵 燕
(泰州市人民医院 病理科,江苏 泰州 225300)
2014版WHO女性生殖系统肿瘤分类里子宫内膜间质肿瘤(Endometrial stromal tumour, EST)包括良性的子宫内膜间质结节(Endometrial stromal nodule, ESN)、恶性的低级别子宫内膜间质肉瘤(Low-grade endometrial stromal sarcoma, LGESS)、高级别子宫内膜间质肉瘤(High-grade endometrial stromal sarcoma, HGESS)、未分化的子宫肉瘤(Undifferentiated uterine sarcoma,UUS)和恶性潜能不定的类似卵巢性索肿瘤的子宫肿瘤(Uterine tumour resembling ovarian sex cord tumour,UTROSCT)[1]。这组肿瘤虽是子宫第二大间叶源性肿瘤,但罕见,发生率远低于第一位的子宫平滑肌肿瘤,加之临床特征和影像学表现不特异,组织学形态多变,常诊断困难。
1 材料与方法
1.1 材料 搜集2011 年1 月至2018 年10 月泰州市人民医院病理数据库中EST11 例,在同期子宫间叶性肿瘤中占比0.3%。
1.2 方法 所有标本常规固定,脱水,石蜡包埋,切片,染色。免疫组化为EnVision 法,选用抗体desmin、caldesmon、SMA、CD10、ER、PR、Ki-67购自Dako公司。所有病例经2位病理副主任医师以上专家确诊,电话随访。
2 结果
11 例EST 包括1 例ESN、9 例LGESS(其中1例LGESS 患者两次复发,第二次复发时发生高级别转化、诊断为HGESS)和1例UUS。
2.1 临床资料 11 例EST 平均发病年龄50.4 岁。例1、例2体检偶然发现,其余9例阴道异常出血来院检查发现。肿瘤的临床特征和手术方式见表1。

表1 EST临床病理情况表
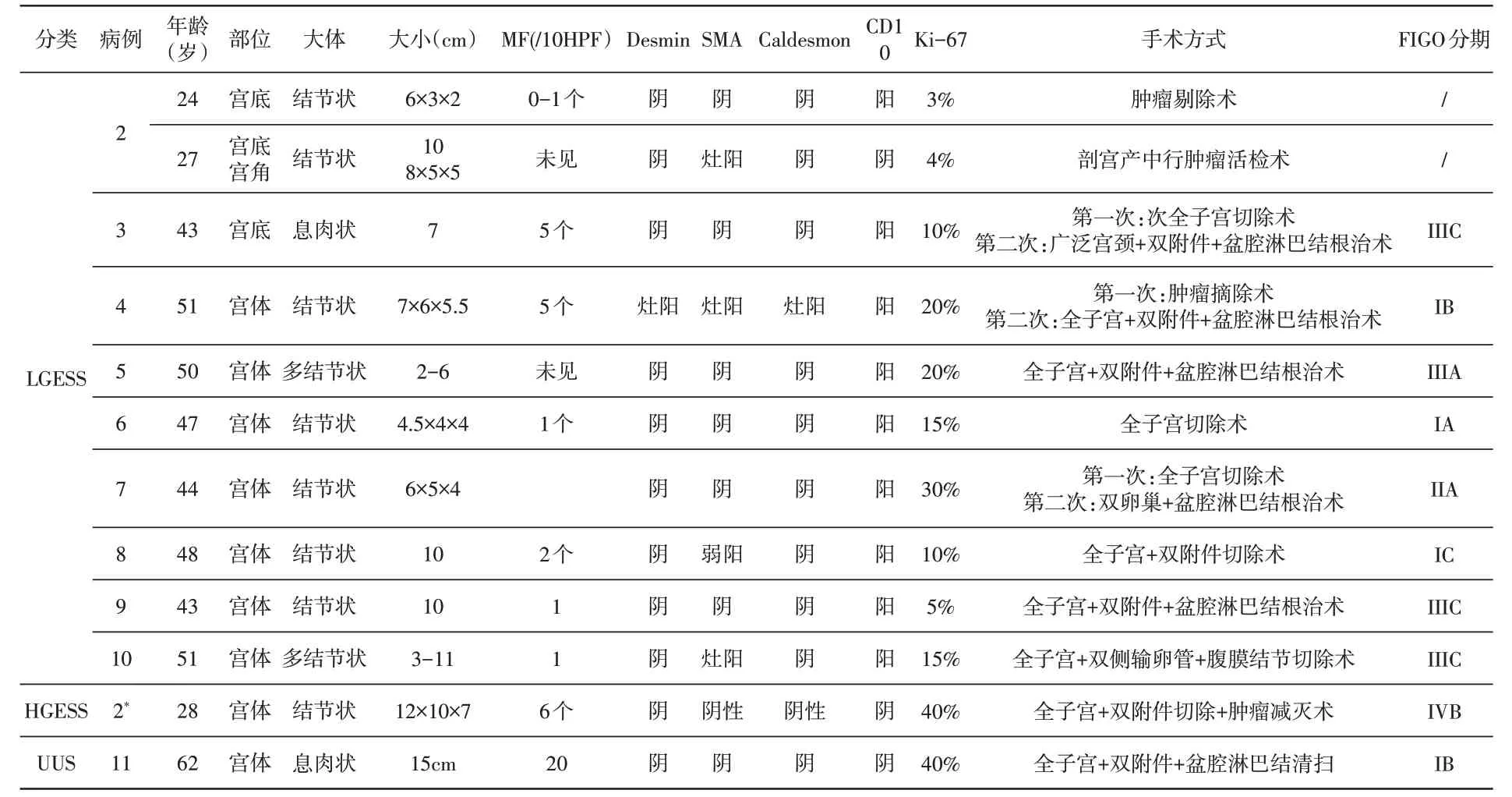
续表
2.2 大体检查 肿瘤平均最大径约7.8cm。例1肿瘤与附有的少许固有肌层分界清楚。所有肿瘤大体观察呈灰黄或灰白色、实性,较经典平滑肌瘤质地软。例11 肿瘤切面呈鱼肉状,见出血坏死。其余肿瘤未见坏死。
2.3 镜检 例1~10(包括例2 的首发肿瘤和第1次复发肿瘤)的肿瘤细胞形态单一,弥漫成片、大多类似增生期子宫内膜间质细胞(图1),胞质少,核卵圆或纺锤形、无明显异型,围绕小动脉螺旋状生长,核分裂象0~5 个/10HPF。螺旋状小动脉样的小血管分布均匀(图2)。有些区域见泡沫状组织细胞。例1 肿瘤境界清楚,于周围固有肌层交界处广泛取材,未见浸润(图3)。例2~11肿瘤浸润性生长(图4),显示肿瘤细胞巢在子宫肌层内舌状穿插式浸润,易见脉管内瘤栓,以薄壁血管内瘤栓多见,亦见于淋巴管。例1 肿瘤组织内易见“星爆”样结构(图5),显示巢团状生长的肿瘤细胞围绕中央玻璃样变的胶原呈放射状排列。例2 首发肿瘤和第1 次复发肿瘤形态相似,可见因水肿、粘液变性引起的微囊/网眼样疏松结构,部分瘤细胞胞质高度水肿、透亮似假脂母样细胞(图6、7)。例5瘤细胞密度随着区域性间质水肿造成结节状的假象。例6 瘤细胞巢内出现丝团样玻璃样嗜酸性物质,形成类似实性假乳头样结构(图8),肿瘤细胞围绕分支状薄壁血管呈血管外皮瘤样结构(图9)。
例2患者第2次复发显示肿瘤部分区域发生高级别转化(图10),高级别圆形瘤细胞密度增高、异型增大,胞质增多、嗜酸,核增大、染色质空泡状,出现小核仁,核分裂象达40个/10HPF(初诊和第一次复发时仅1个/10HPF),并见瘤巨细胞。
例11显示高密度瘤细胞鱼骨样排列,类似纤维肉瘤(图11),缺乏明确可识别的子宫内膜间质的特征,局部粘液样背景。易见坏死,瘤细胞异型显著,核分裂象20个/10HPF,见病理性核分裂象。偶尔找见的螺旋小动脉提示来源于子宫内膜间质。
2.4 免疫组化 结果见表1 及图12。最后病理诊断:例1 诊断ESN,例2~例10 诊断LGESS,其中例2第二次复发肿瘤诊断HGESS,例11诊断UUS。
2.5 随访 至2018 年11 月,11 例EST 随访时间5~91 月,平均随访38 月。例1 患者ESN 未见复发,7 例LGESS 患者存活、其中例5 患者带瘤生存。3例死亡、平均术后生存时间33月。例2在首次LGESS术后55月时发现高级别转化、全身多器官转移、83 月时死亡;例3 患者术后6 月和例11患者术后10月,均死于多器官转移、衰竭。
3 讨论

图1~12 EST的组织学图像
3.1 诊断 总的来说,EST 是一组来源于子宫内膜间质细胞的肿瘤。特征性的小血管类似子宫内膜螺旋状小动脉,也可分支状,常弥漫均匀分布。团块状纤维透明变性和泡沫状组织细胞的出现对诊断有提示意义。EST 良恶性肿瘤的鉴别主要在于生长方式,着重强调肿瘤的边界。ESN 的瘤体边界清楚,没有子宫肌层和/或脉管侵犯(2014版WHO允许出现有指状突起或与主瘤体紧密相连的小巢,这样的小巢必须同时满足<3个且与主瘤体相距<3mm)[1,2]。实际工作中我们作出ESN 的诊断非常谨慎,最好是在全切子宫标本中对肿瘤与周围肌层交界处广泛大量的取材,确保没有浸润或没有超出诊断标准的浸润,方可诊断ESN。ESS呈舌状、蚯蚓状浸润子宫肌层,甚至突破浆膜至周围器官、乃至远处转移,亲脉管并形成瘤栓是其典型特征。
3.2 分子遗传学 复习文献,分子病理检查如RT-PCR 和FISH 法检测到大多数ESN、ESS 和部分UUS 具有t(7;17)(p21;q15),导致JAZF1和SUZ12(JJAZ1)基因融合的异常染色体。这种特征性的染色体异常,不仅见于EST 的普通型,还见于EST各种变异亚型及子宫外ESS,提示起源相同。ESS 的第二常见染色体异常是t(6;10;10)(p21;q22;p11)导致的EPC1-PHF1 基因重排,其它还有t(6;7)(p21;q15)导致的PHF1-JAZF1 基因重排、t(1;6)(p34;p21)导致的MEAF6-PHF1 基因重排和t(X;22)(p11;q13)导致的ZC3H7B-BCOR 基因融合,伴性索分化的ESS 常见累及6p21 的重排,部分HGESS 具有t(10;17)(q22;p13)导致的YWHAE-FAM22 基因重排[3,4]。有文献报道具有明显粘液样基质、类似粘液样平滑肌肉瘤的ESS,常见ZC3H7B-BCOR基因融合,具有更具激进的临床过程,与预后差相关[5]。或许伴随着分子分型,诊断HGESS 可能不局限于形态学。
3.3 鉴别诊断 EST 少见,被误诊、漏诊的原因还因为这组肿瘤的组织学形态有很多变异。包括:平滑肌分化,纤维母细胞分化,粘液样变性,性索样分化,苗勒氏腺体分化(类似增生期的子宫内膜腺体),骨骼肌/横纹肌细胞样分化,上皮样细胞/透明细胞分化,脂肪细胞样/泡沫状细胞分化,裂隙、乳头/假乳头状结构等。大多数肿瘤通过组织学形态、免疫组化标记可以鉴别诊断。
常用CD10,desmin,SMA,H-Caldesmon 这组免疫组化标记来鉴别EST 和平滑肌肿瘤。EST表达CD10,偶尔表达desmin 和SMA,不表达HCaldesmon,除非伴有平滑肌分化。平滑肌肿瘤表达后三项,CD10 常常阴性或局灶表达。EST 有一种罕见的变异模式,其内形成广泛的胶原化玫瑰花结,类似低级别粘液纤维肉瘤,且后三项平滑肌源性标记弥漫的强阳性表达,特别容易误诊平滑肌肉瘤[6]。此时,JAZF1-SUZZ12 融合基因转录物的检测对诊断EST 起决定作用。在HGESS 和UUS中,CD10常常阴性,寻找经典的子宫内膜间质的特征非常重要。
EST 内出现苗勒氏腺体分化,要鉴别子宫腺肌病、腺肉瘤甚至癌肉瘤,需结合整个病变的背景来鉴别诊断。另外,EST 出现上皮分化,可以表达CK,一般不表达EMA,真正的子宫内膜腺体以及腺体来源的癌会表达EMA。同样的,UUS 在鉴别子宫内膜未分化癌时,EMA 也是一个有鉴别诊断意义的标记。
3.4 治疗和预后 ESS 的预后与肿瘤细胞的分化呈正比。复发和致死率与肿瘤的分期有关,也取决于初次手术类型。原则上即便是FIGO 分期为I期的肿瘤,也是要求全子宫+双侧附件切除。肿瘤超出子宫外时,一并切除。术后使用孕激素可能有一定的稳定和抑制肿瘤复发或转移的影响,放疗可能改善局部控制[7]。

