热风干过程中风干肉水分的迁移
饶伟丽 魏相茹 王振宇 潘 腾 陈炳辉 张德权
(1 中国农业科学院农产品加工研究所/农业农村部农产品加工重点实验室,北京 100193;2辅仁大学食品科学系,中国 台湾 24205)
热风干是目前风干肉加工采用的主要风干方式[1-2],但低温(35℃)热风干时风干时间长、能耗高[3-4]。 因此,非常有必要研究35℃低温热风干下的水分迁移机理,从而为缩短加工时间,降低生产能耗提供新思路。
19 世纪末20 世纪初,国内外学者初步明确了低场核磁共振中弛豫吸收峰对应肉中水分的存在形式及其空间位置,并在近年来开始运用低场核磁共振来研究加工过程中水分存在形式的改变[5-6]。 研究学者使用氢质子低场核磁共振技术(1H Low Field Nuclear Magnetic Resonance,1HLF-NMR)对生鲜肉中水分的分布和迁移进行了广泛研究,认识到LF-NMR 的检测信号不仅包含肉中水分的存在形式及其相互转换,还包含蛋白质与水分相互作用的信息[7-10]。 如Bertram等[8]发现LF-NMR 可以很好地预测猪肉加工过程中产品的保水性;McDonnell 等[9]、Liu 等[10]的研究结果同样表明,LF-NMR 可以很好地检测猪肉在腌制过程中肉中蛋白质对水分的保持能力,并发现横向弛豫时间T2和保水性显著相关。 但目前1HLF-NMR 用于风干过程中水分迁移的案例较鲜见[11-12]。 因此,本试验利用1HLF-NMR 研究了低温(35℃)热风干中水分的状态和迁移及水-蛋白的相互作用,初步解析风干过程中水分迁移机制,以期为调控风干过程中水分迁移速度提供理论依据。
1 材料与方法
1.1 材料与试剂
小尾寒羊和德美肉羊杂交8月龄公羊,内蒙古草原宏宝有限公司;石英砂(分析纯),上海沪试实验室器材股份有限公司;乙醇(75%),上海沪试实验室器材股份有限公司。
1.2 主要仪器与设备
D/GDWJB-100L 风干箱,上海典和实验仪器厂;NMR-2011 低场核磁共振仪,上海纽迈电子科技有限公司;DH-101 烘干箱,天津中环实验仪器有限公司;Digital Thermometer TP-3001,天津Cheerman 科技有限公司;FCR1000-UF-E 超纯水机,青岛富勒姆科技有限公司。
1.3 试验方法
1.3.1 原料肉处理 选取小尾寒羊和德美肉羊杂交8月龄公羊6 只,清真屠宰后取后腿米龙,放于自封袋(2 300 mL O2·m-2·24 h-1,0℃)中,冰箱中7℃排酸。排酸至宰后24 h 时,把每个米龙肉顺纤维切成2 cm×2 cm×7 cm 的8 个肉条,放于4℃冰温箱中至宰后48 h时,再放入风干箱进行风干。
1.3.2 热风干处理 采用温度35±0.5℃、湿度60%±2%的风干箱进行低温热风干,风速为3 m·s-1。 把肉条穿到曲别针上,保持肉条垂直,风干总时长为600 min,且分别于风干100、200、300、400、500、600 min 时取出每只羊的1 个肉条,用于测定样品的氢质子低场核磁共振波谱图。
1.3.3 风干肉氢质子低场核磁共振波谱的测量 用取样器取出风干肉的内部,取样器的直径为风干肉横截面直径的一半,然后分别对内部和外部进行氢质子低场核磁共振波谱测定。 测量参数为:磁场强度0.5 T、主频23 MHz、偏移频率286.781 3 kHz;90°脉冲时间17 μs、180°脉冲时间35 μs;采样点数54 996,重复时间3 000 ms,累加次数4 次,回波数2 000,核磁管直径60 mm。 利用Carr-Purcell-Meiboom-Gill 脉冲序列测定样品中的横向弛豫时间T2。 样品的氢质子低场核磁共振波谱图的信号强度除以样品的干物质重为最终氢质子低场核磁共振波谱图。
1.3.4 风干肉水分含量的测定 取3 g 左右已被绞碎的原料肉或风干肉,加入10 g 石英砂和5 mL 乙醇,搅拌均匀后于103℃烘箱中烘干20 h。 按照公式计算样品的水分含量:

1.3.5 风干肉表面和中心温度的测量 将热电偶插到肉条的表皮和中心,放到风干箱中固定好,热电偶对表皮和中心的温度每隔2 min 记录一次。
1.3.6 数据统计 应用统计分析系统(statistic analysis system,SAS)对数据进行分析。 每试验设立3个重复。 不同风干时间的样品间差异用单因素方差分析,显著水平0.05,数据以平均值±标准偏差表示。
2 结果与分析
2.1 风干过程中风干肉内外部水分的存在形式
由图1可知,风干过程中风干肉内部和外部的氢质子低场核磁共振T2在1~1 000 ms 的弛豫时间内均分布有3 个峰。 按照Pearce 等[13]学者的理论,这3 个峰分别对应风干肉中3 种存在形式的水:第1 个峰为与大分子紧密结合的水—结合水(T2b),弛豫时间在1~7 ms 之间;第2 个峰为肌原纤维中的水—不易流动水(T21),弛豫时间在40~50 ms 之间;第3 个峰为肌原纤维网络外水—自由水(T22),弛豫时间在280 ~340 ms 之间[13-14]。 该研究结果与Bertram 等[8,15]的研究结果相似。
2.2 风干过程中风干肉内外部的结合水(T2b)变化
T2b的变化是风干过程中水-肉蛋白相互作用发生改变的直接结果[7,16]。 因为水分和蛋白质中的质子可以相互交换,且这种交换受到蛋白质变性和聚集的影响[17-18]。 研究证实,随着蛋白质中水分含量的增加,蛋白质的α-螺旋和β-转角含量增加,β-折叠含量下降,这会导致分子内氢键强度减弱,会使蛋白质表面的质子更容易与水中的质子进行交换[19],最终影响T2b的弛豫时间和吸收面积。 由表1可知,风干过程中风干肉内部的T2b峰顶点时间没有显著变化;风干肉内部的T2b峰面积呈逐渐升高趋势,结合水含量在风干500 min 时升高,但无显著差异。 由表2可知,当风干时间超过400 min 后,风干肉外部的T2b峰顶点时间显著下降;当风干时间超过200 min 后,风干肉外部的T2b峰面积显著升高,并于风干500 min 时达到最大值38.82,表明风干过程中风干肉内部和外部中水-蛋白相互作用不同,这可能是外部水分脱除快,水-蛋白相互作用变化更剧烈导致的。
2.3 风干过程中风干肉内外部的不易流动水(T21)变化
由图1可知,与内部相比,风干过程中风干肉外部的T21弛豫随着风干时间的延长,峰变宽,这主要是由于风干肉在风干过程中内外部水-蛋白相互作用多样化导致的。 风干过程中水分由外向内脱除(图2),风干肉表面水分快速脱除形成一层硬壳,而接近硬壳部位的水分含量还保持较高水平,在本试验的取样过程中,外部包含硬壳和接近硬壳部分,水分含量不均匀,造成水-蛋白相互作用多样化[20]。
由表1、2 可知,风干过程中风干肉、内外部的不易流动水(T21) 变化不同。 随着风干时间的延长,
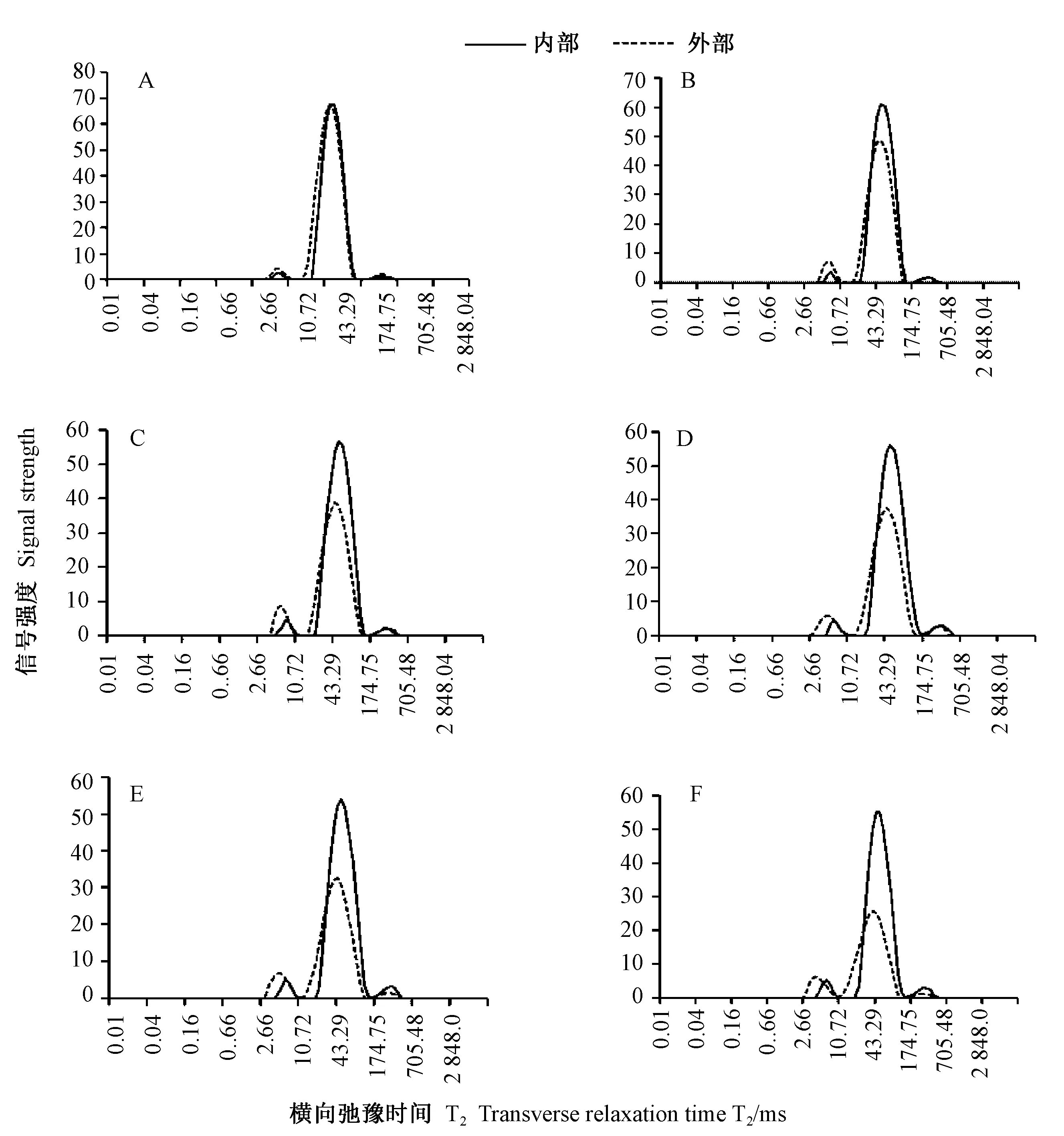
图1 风干过程中风干肉内部和外部弛豫时间T2 的变化Fig.1 Distribution of LF-NMR T2 relaxation of inner and external part of dried meat during air drying

表1 风干过程中风干肉内部弛豫时间T2 的峰顶点时间和峰面积Table1 The relaxation times and area of all water populations of T2 of inner part of dried meat
风干肉内部的T21峰顶点时间呈下降趋势,并在风干600 min 时达到最低;风干肉内部的T21峰面积逐渐下降,400 min 时略有上升,随后下降并在风干结束时达到最小值398.60。 而风干肉外部,当风干时间达到500 min 时,风干肉外部的T21峰顶点时间下降明显,但无显著差异;当风干时间超过200 min,风干肉外部T21峰面积就显著降低,并于风干结束时达到最小值226.64。
2.4 风干过程中风干肉内外部的自由水(T22)变化
由表1可知,风干过程中风干肉内部的T22峰顶点时间和峰面积均没有显著变化。 由表2可知,风干肉外部的T22峰顶点时间随着风干时间的延长呈下降趋势,在风干500 min 时,不易流动水含量降低明显,但无显著差异;风干肉外部的T22峰面积呈先长高后下降的趋势,在风干600 min 时达到最低。 按照Pearce等[13]的理论,T22峰面积的减小表明风干肉外部中自由水在风干后期显著减小;同时T22峰顶点时间的显著下降表明肌原纤维外的空间减小,这符合实际风干中风干肉发生纤维横向收缩的现象。

表2 风干过程中风干肉外部弛豫时间T2 的峰顶点时间和峰面积Table2 The relaxation times and area of all water populations of T2 of external part of dried meat
2.5 风干过程中风干肉中心和表皮水分含量的变化
由图2可知,风干100 min 时,风干肉中心水分含量略低于表皮,随着风干时间的延长,风干肉表皮的水分含量显著下降,而风干肉中心的水分含量下降缓慢,造成风干肉从内到外的水分梯度。 35℃风干过程中,风干肉表面的水分快速脱除,而内部的水分迁移慢,造成了表面硬壳的形成。

图2 风干过程中风干肉中心和表皮水分含量的变化Fig.2 Moisture content of inner and external part of dried meat during air drying
2.6 风干过程中风干肉表皮和中心温度变化
由图3可知,风干肉内部起始温度低于表皮温度,随着风干时间的延长,与表皮相比,风干肉中心温度快速上升,且逐渐趋于平衡,这是由于加热介质将热量传给风干肉表面,风干肉本身又将热量以传导形式传向肉中心,形成自中心向外的温度梯度,导致水分从高到低传递,这符合传质传热规律。

图3 风干过程中风干肉表皮和中心温度Fig.3 Temperature of inner and external part of dried meat during air drying
3 讨论
本研究结果表明,风干过程中风干肉氢质子低场核磁共振T2在1~1 000 ms 的弛豫时间内分布有3 个峰,分别对应存在于风干肉中的3 种形式的水,即大分子紧密结合的水—结合水(T2b)、肌纤维中的水—不易流动水(T21)和肌纤维网络外水—自由水(T22)[13,21]。在风干过程中,这3 种状态水分的弛豫时间均显著降低。 本研究中,T2b和T22的峰顶点弛豫时间大于Bertram 等[15]在生鲜肉研究中的峰顶点弛豫时间(T2b的峰顶点时间在0 ~4 ms 范围内,T22的峰顶点时间在140~350 ms 范围内),这是因为T2的弛豫时间受很多因素的影响[22],如冷冻方式(液氮冷冻、鼓风冷冻和小型冻结间冷冻)、冷冻条件(-10 或-20℃冷冻5 d、8 d或18 周)等[23-24]。 因此,本试验中风干肉T2b和T22的峰顶点弛豫时间大于前人研究[15]结果,这可能是由于本研究中使用的原料肉是经解冻后风干,原料肉存在差异。
在风干过程中由于肌球蛋白头部发生变性,肌原纤维蛋白表面疏水性增加,溶解性降低,导致水-肌原纤维蛋白相互作用减弱,这是风干过程中不易流动水向自由水迁移的一个重要因素。 Pearce 等[13]学者认为,在生鲜肉中T21时间常数的变化意味着肌纤维内空间的改变,而T22时间常数表示肌纤维膜和肌纤维外空间的变化,即T21时间的增加表示肌纤维之间空间的增加或者肌节的缩短,T22时间的增加表示肌纤维外区域空间的增加。 本研究结果表明,T2分布的峰面积同样受水-蛋白相互作用的影响。 在生鲜肉的研究中,大都认为是肌原纤维内质子(基本上是水,还有部分脂肪,本试验中脂肪不会引起质子数量的变化)数量的增加导致T21吸收强度或峰面积的增加[25-26];肌原纤维外质子数量的增加导致T22吸收强度或峰面积的增加[27];蛋白大分子表面紧密结合的质子数量的增加导致T2b吸收强度或峰面积的增加[28]。 但以上并不能很好地解释本研究的结果。 本研究中,当水分含量从65%下降至60%时,风干肉T21、T2b和T22的峰面积均未显著降低。 因此,可认为除受样品中水分含量的影响外,风干肉的T2吸收强度或峰面积还受到水-蛋白相互作用的影响。 但是,风干肉中的蛋白质在风干过程中变性程度如何,以及对水合能力有何影响,仍有待进一步研究。
4 结论
低场核磁共振波谱T2的弛豫时间和信号强度改变,表明风干肉35℃风干过程中水-蛋白相互作用模式发生了改变,这是水分迁移速度变化的重要原因。相比于内部,风干肉外部的水分更容易脱除,水-蛋白相互作用模式多样。 35℃风干过程中风干肉表面的水分快速脱除,而内部的水分迁移慢,造成了表面硬壳的形成,硬壳中结缔组织的收缩很可能是肌纤维间孔隙减小的原因。 此外,风干肉收缩导致内部孔隙直径减小,会影响风干过程中水分的迁移。 本研究为调控风干过程中水分迁移速度,实现风干肉工业化加工提供了理论依据。

