蓝细菌光驱固碳合成蔗糖技术的发展与展望
郗欣彤,张杉杉,毛绍名,栾国栋,罗泉,吕雪峰
蓝细菌光驱固碳合成蔗糖技术的发展与展望
郗欣彤1,2,张杉杉2,毛绍名1,栾国栋2,罗泉2,吕雪峰2
1 中南林业科技大学 生命科学与技术学院,湖南 长沙 410004 2 中国科学院青岛生物能源与过程研究所 中国科学院生物燃料重点实验室,山东 青岛 266101
生物炼制技术体系是缓解能源和环境危机,推动社会可持续发展的重要选择,而充足的糖原料供应是生物炼制的基础。蓝细菌光驱固碳合成蔗糖是一种潜力巨大的新型糖原料供应路线。基于高效的蓝细菌光驱固碳细胞工厂,可以在单平台上以太阳能为驱动将二氧化碳和水直接转化为蔗糖,过程简单、产品明确、易于提取,而且可以同时达到固碳减排和供应糖原料的效果,具有重要的研究和应用价值。本文回顾了蓝细菌光驱固碳合成蔗糖技术的发展现状,从合成机制、代谢工程策略、技术延伸应用等层面对其最新进展和所遇到的问题进行了总结介绍,并对该技术未来发展方向进行了展望。
蓝细菌,蔗糖,光合作用,代谢工程,盐胁迫
当今世界,人类社会高度繁荣的物质文明是在石化资源炼制体系的基础上建立起来的,然而这种发展模式正面临着来自资源和环境两方面的危机。以微生物发酵与转化为核心的生物炼制技术体系,通过天然或人工设计、改造的微生物细胞工厂,将各类可再生资源以环境友好型方式转化为各类化学品,可以为社会可持续发展提供新的基础和动力[1]。对于大肠杆菌、枯草芽孢杆菌、酿酒酵母等模式化的异养微生物细胞工厂而言,糖原料是其生物炼制过程的基础和保障[2]。目前,糖原料的获取主要有3种途径:淀粉类粮食作物 (如玉米等)[6-7]、纤维类生物质 (如秸秆等)、蔗糖类植物 (如甘蔗等)。尽管上述3种途径都有很大的发展潜力,但同样都面临着一些瓶颈问题:淀粉类粮食作物制备糖原料存在“与人争粮”的问题,纤维类生物质制备糖原料存在预处理酶水解糖化成本过高的问题,蔗糖类植物存在种植区域限制的问题[3]。因此,开发高效的糖类合成技术、拓宽糖类供应来源,建立可持续、低成本、不受区域限制的原料糖制备新路线,对于降低原料成本、促进生物炼制技术体系产业化进程具有重要意义。
蓝细菌是一类进行放氧光合作用的原核微生物,能利用光能和二氧化碳自养生长,广泛分布于海洋、陆地、淡水等各种生态环境中[4]。相比较于高等植物和真核微藻,蓝细菌具有结构简单、生长迅速而且易于进行遗传操作的特点,通过天然代谢途径的修饰或异源代谢途径的引入,可以实现对其胞内碳流、能量流的重新分配,促进各种天然或非天然代谢产物的合成[5-6]。糖类物质是蓝细菌中重要的碳水化合物存在形式,也是具有代表性的蓝细菌光合生物合成产品[7]。蓝细菌天然地可以合成从葡萄糖、果糖等单糖,蔗糖、海藻糖等二糖,到糖原等大分子多糖的众多类型的糖类物质。蔗糖是广泛研究的、也是最具代表性的蓝细菌糖类代谢产物。大多数淡水蓝细菌藻株在面临盐胁迫时,会在胞内合成并富集蔗糖作为相容性溶质,以维持胞内外渗透压平衡[8]。而通过代谢工程改造,已经成功地在部分工程藻株中实现了蔗糖从胞内向胞外的高效分泌,使其可以在培养液中积累,大幅度提高了蓝细菌蔗糖的产量[9],有效提升了蓝细菌光驱固碳产糖技术的工程化应用潜力。
相比于传统的糖原料制备技术,特别是与各种植物生物质糖化过程相比,使用蓝细菌进行蔗糖分子的合成和分泌,不需要高能耗、高成本的原料预处理过程,即实现从二氧化碳和太阳能向简单而明确的糖组分的直接转化,在工艺和成本上将更具优势,是一种极具潜力的糖原料生产路线。本文将从蓝细菌合成蔗糖的生理和代谢机制、光驱固碳产糖细胞工厂的代谢工程开发策略、光驱固碳产糖技术的扩展应用等方面对该技术的发展现状和所面临的问题进行总结,并对其未来前景和发展方向进行展望。
1 蓝细菌蔗糖合成的生理、遗传和代谢背景
1.1 蓝细菌蔗糖合成的生理意义
蓝细菌广泛分布在各种生态环境中,需要面临各种类型环境因子和营养条件的波动[4]。高浓度盐离子 (Na+、K+等) 造成的盐胁迫是一种常见而典型的环境胁迫作用。盐胁迫条件下,蓝细菌细胞需要面临复合的胁迫因子刺激,既有高的盐离子浓度 (离子胁迫),也有强的溶液渗透压(渗透胁迫),会对胞内蛋白质和膜系统的结构稳定与功能保持造成严重威胁。为了适应高盐条件下的渗透胁迫,蓝细菌普遍进化出了胞内快速合成并积累相容性溶质以维持胞内外渗透压平衡的适应性生存策略。相容性溶质是指微生物细胞在高渗透压环境下,为了提高胞内水活度而合成,并通过高浓度积累来维持细胞体积和膨压,而且对细胞正常代谢活性不造成影响的一类小分子代谢物[10]。不同蓝细菌藻株中,合成和积累的相容性溶质的类型与藻株的盐胁迫耐受能力密切相关。通常意义上,盐耐受能力在0.6 mol/L NaCl以下的藻株被称为低耐盐藻株,一般合成海藻糖或/和蔗糖作为相容性溶质 (例如鱼腥藻PCC 7120、聚球藻PCC 7942等);盐耐受能力在1.7 mol/L NaCl以下的藻株归为中度耐盐藻株,通常合成甘油葡萄糖苷为相容性溶质 (例如集胞藻PCC 6803);盐耐受能力达到3 mol/L NaCl及以上的藻株为高度耐盐藻株,则主要合成甜菜碱或谷氨酸甜菜碱作为相容性溶质 (例如盐泽螺旋藻、盐生隐杆藻等)[8,11-12]。蔗糖是淡水藻株和部分海水藻株中最具代表性的相容性溶质,已经发现了至少60株蓝细菌藻株能在胞内合成蔗糖作为相容性溶质以抵抗高渗透压胁迫[8]。
除了作为抵抗盐胁迫的相容性溶质进行应激性合成外,蔗糖在部分蓝细菌藻株中还作为辅助性的碳汇途径存在。作为蓝细菌适应昼夜节律、应对环境变化的重要机制,在光照条件下通过卡尔文循环固定的碳往往处于“溢出”状态,超出细胞生长和复制所需;而这部分溢出的碳以“碳汇”的形式储存于糖原等多糖大分子和甘油葡萄糖苷、蔗糖等小分子溶质中,可以支撑蓝细菌在黑暗条件、饥饿条件下细胞生存和生长的需要[13-15]。在正常条件下,糖原代谢是最主要也是最重要的碳汇机制,而蔗糖、甘油葡萄糖苷合成机制的存在则为蓝细菌碳汇网络的可塑性和柔性提供了保证。在聚球藻PCC 7002中发现,当糖原合成途径被阻断时,突变株细胞内蔗糖含量会显著增加,以作为“溢出”碳流的重新分配的重要途径[16-17]。当糖原合成能力缺失的PCC 7002藻株处于黑暗环境下时,其胞内增加的蔗糖含量可以为细胞呼吸和自发酵等异化作用提供底物支持,部分替代糖原的作用[16]。
1.2 蓝细菌蔗糖合成的代谢机制
蓝细菌中的蔗糖合成代谢途径已经被清楚揭示 (图1),与植物中的蔗糖合成途径相同,蓝细菌细胞中的蔗糖合成主要由蔗糖磷酸合成酶 (Sucrose-phosphate synthase,SPS,EC 2.4.1.14) 和蔗糖磷酸磷酸化酶 (Sucrose phosphatase,SPP,EC 3.1.3.24) 两个酶顺序催化完成。首先是,UDP-葡萄糖和果糖-6-磷酸在蔗糖磷酸合成酶作用下合成蔗糖-6-磷酸并释放一个UDP分子;进而,蔗糖-6-磷酸在蔗糖磷酸磷酸化酶的作用下水解生成蔗糖并释放一个无机磷酸分子。除了上述SPS-SPP途径外,一些丝状蓝细菌中 (如鱼腥藻PCC 7120、PCC 7119、ATCC 29413) 还存在另一条蔗糖合成途径,由蔗糖合成酶 (Sucrose synthase,SuS,EC 2.4.1.13) 催化从UDP-葡萄糖 (或ADP-葡萄糖) 和果糖到蔗糖和UDP (或ADP) 的可逆转化。但在生理状态下,SuS途径主要催化蔗糖的水解过程而非合成过程[18-20]。在蔗糖合成途径之外,能进行蔗糖合成的蓝细菌藻株的基因组上通常还会有蔗糖水解酶 (Invertase,INV,EC 3.2.1.26) 的编码基因,该酶催化蔗糖的降解过程,将蔗糖水解为葡萄糖和果糖,而与SuS不同的是,invertase催化的蔗糖水解反应为非可逆反应。
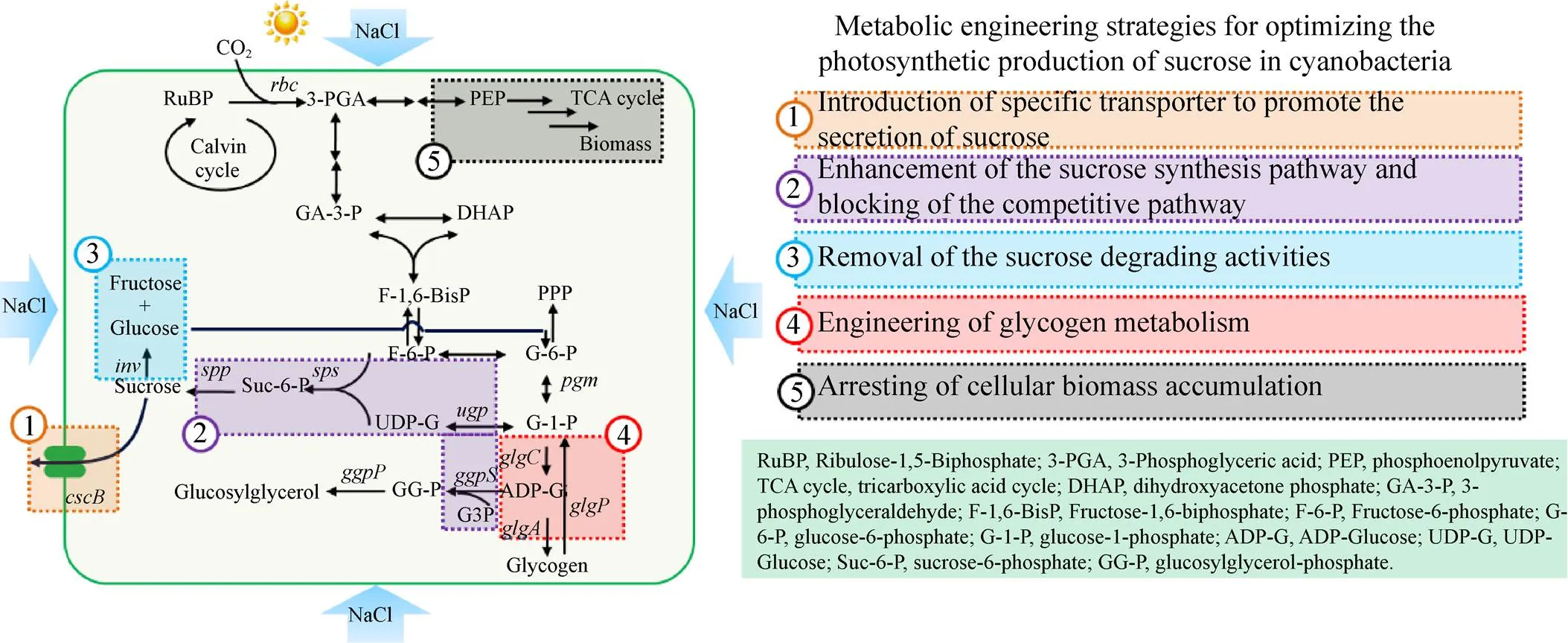
图1 蓝细菌蔗糖合成和代谢网络以及针对性的代谢工程改造策略
1.3 蓝细菌蔗糖合成的调控机制
与清晰的蔗糖合成和降解途径形成鲜明对比的是,现阶段对蓝细菌蔗糖合成调控机制方面知之甚少,具体体现在盐胁迫信号感知方式、信号传递途径以及蔗糖合成诱导机制等3个层面上。首先对产糖蓝细菌感知盐胁迫的机制仍有疑问。如前所述,盐胁迫条件下,蓝细菌所面临的是复合的胁迫环境,既有高浓度的盐离子胁迫,又有强渗透压胁迫,而已有证据表明高浓度盐离子和强渗透压对细胞是两种不同的胁迫信号。日本的Murata研究组发现集胞藻PCC 6803在面对盐胁迫 (高浓度NaCl) 和渗透胁迫 (高浓度山梨醇) 时,其基因转录图谱差别极大,意味着这两种胁迫引发了不同基因系列转录的调控[21]。该研究组在对聚球藻PCC 7942的研究中同样发现,能产生相同渗透势的渗透胁迫 (高浓度山梨醇) 与盐胁迫 (高浓度NaCl) 对细胞体积造成的影响差异显著,前者使细胞收缩了55%,而后者仅收缩了15%。这两种胁迫对PCC 7942细胞生理、生化的影响也有很大差异,强渗透压胁迫下,聚球藻PCC 7942细胞迅速失水,光系统会快速但可逆地失活,而其活性会在细胞重新回到等渗溶液时恢复;而高浓度NaCl胁迫首先通过强渗透压引发光系统快速而可逆的失活,继而由盐离子 (Na+) 对光合作用系统引发不可逆的损伤和失活[22-23]。上述结果表明盐胁迫中强渗透压胁迫和高盐离子浓度胁迫对细胞造成的影响有显著区别,而这两种因素在诱导蔗糖合成上的具体作用仍有待揭示。
盐胁迫信号被产糖蓝细菌感知后,如何在细胞内级联传递,并引发系列的基因表达调控也并不完全清楚。微生物细胞中感知、传导并响应各种环境变化的典型信号转导系统有单元 (丝氨酸/苏氨酸蛋白激酶,STK) 和双元 (组氨酸激酶-响应调节蛋白,Hik-Rre) 两类。蓝细菌中,响应盐胁迫、渗透压胁迫、金属离子胁迫、温度、光强等环境变化的双元信号系统已经陆续被鉴定[24-26]。在集胞藻PCC 6803中,已经鉴定到至少4组双元信号转导系统 (Hik33-Rre31、Hik34-Rre1、Hik16-Hik41-Rre17和Hik10-Rre3) 和一个单元信号蛋白 (SpkG) 可能与盐胁迫和高渗透压胁迫感知传导相关[27]。而在鱼腥藻PCC 7120中,双元信号蛋白OrrA (Alr3768) 已经被证实参与了蔗糖合成的调控[28]。但是,在现阶段对绝大多数产糖蓝细菌而言,对盐胁迫信号更加具体、精确的感知和传导途径的认识仍然是空白。
理论上,盐胁迫信号在蓝细菌细胞中的传导最终需要引发蔗糖合成途径的调控,而已有的研究表明,这种调控可能同时发生在转录、翻译、酶活等多个维度上。在集胞藻PCC 6803中,蔗糖合成关键基因的转录在盐胁迫后迅速上调,在0.5 h达到最大值[29];而聚球藻PCC 7002在盐胁迫24 h后,和转录信号也显著提高[30]。在翻译水平上,免疫印迹分析表明,鱼腥藻PCC 7120的SPS蛋白在盐胁迫6 h后,表达量明显提高,而将细胞重新置于正常环境时 (非盐胁迫条件),SPS杂交信号则又降低到背景水平。与之对应的是,非胁迫条件下SPS酶活处在相对较低的水平,在加入80 mmol/L NaCl胁迫6 h后,SPS酶活提高了3倍。当把胁迫后的细胞重新置于基本培养基中,SPS酶活则下降到基础水平[31]。然而,如前所述,盐胁迫信号在感知和传导途径上认识的缺失,也进一步限制了对蔗糖合成途径调控机制的精确揭示。SPS、SPP、INV等蔗糖合成和降解途径的关键蛋白在盐胁迫条件下是如何从蛋白丰度和蛋白活性上发生快速而精细变化的?离子胁迫和渗透胁迫是如何引发这些变化的?这些问题的回答和解决将是深入理解蓝细菌蔗糖合成机制、解除现有光合固碳产糖对盐胁迫的依赖、最终提升蓝细菌工程藻株产糖效能的关键。
2 蓝细菌光驱固碳合成蔗糖的代谢工程策略
天然蓝细菌藻株中,蔗糖的合成主要作为相容性溶质以抵御高盐胁迫导致的渗透压失衡,当胞内积累的蔗糖浓度足以使细胞内外渗透压重新平衡时,蔗糖浓度就不会进一步提高,其合成和降解将处于动态平衡状态,这种天然的蔗糖代谢调控模式从根本上限制了蓝细菌蔗糖产量的提升。如图1所示,通过代谢工程改造,打破盐胁迫条件下蓝细菌蔗糖合成和调控的天然调控模式,是加强蔗糖合成能力、提升蓝细菌光驱固碳合成蔗糖技术应用潜力的重要选择。
2.1 蔗糖转运蛋白的导入
解除蓝细菌蔗糖合成能力瓶颈的关键在于实现蔗糖的胞外分泌,而开发蓝细菌光驱固碳合成蔗糖细胞工厂开发取得的最具突破性的进展就是通过蔗糖转运蛋白的导入而实现的。2012年Ducat等将来自大肠杆菌的基因导入聚球藻PCC 7942,首次实现了蔗糖的胞外分泌[9]。CscB蛋白是一种蔗糖透性酶 (Sucrose permease),可以完成质子/蔗糖的同向转运。在大肠杆菌细胞中,CscB蛋白通常促进细胞从酸性环境中吸收蔗糖和质子;而蓝细菌的培养环境通常偏碱性,有利于盐胁迫下合成的蔗糖与质子的同时泵出。Ducat等采用IPTG诱导型的P启动子控制基因的表达,在150 mmol/L NaCl胁迫和1 mmol/L IPTG诱导条件下,聚球藻工程藻株蔗糖合成效率达到了28 mg/(L·h),168 h盐胁迫条件培养后产量达到2.7 g/L[9]。
2016年本实验室使用一株在高温高光条件下能够快速生长的速生聚球藻UTEX 2973进行蔗糖合成研究时发现,基因的导入也可以促进UTEX 2973中蔗糖的分泌[32]。UTEX 2973是近期发现的一种极具工程化应用潜力的蓝细菌藻株。该藻株在基因组上与聚球藻PCC 7942具有高达99.8%的相似性 (差异仅包括55个SNP、一个188.6 kb大片段的位置翻转以及一个片段缺失),而该藻株却表现出了显著提高的环境胁迫适应性和生长速度,在500 μmol photons/(m2·s) 高光和41℃高温培养条件下,其代增时间只有2.1 h,远远超过此前报道过的各种模式藻株[33]。研究还发现,该藻株具有极强的碳水化合物合成潜力,其250 μmol photons/(m2·s)光照和38 ℃的温度条件下,糖原积累量可以达到干重的50%左右;而受到盐胁迫时,该藻株同样在胞内合成并积累蔗糖作为主要的相容性溶质。通过将基因导入UTEX 2973基因组,在盐胁迫条件下工程藻株中合成的蔗糖中95%以上会分泌至胞外;当使用KCl替代NaCl作为胁迫物时,因为K+对细胞的毒性弱于Na+,蔗糖合成速率可以进一步提高到35.5 mg/(L·h),而单批次培养的蔗糖产量达到3.5 g/L。该部分研究中还发现,以KCl为胁迫盐时,UTEX 2973-CscB藻株细胞可以通过离心收集-重悬培养的模式进行半连续式蔗糖合成,经过7次采集 (每次3 d),累计蔗糖产量可达8.7 g/L[32]。
值得注意的是,蓝细菌中蔗糖转运蛋白的表达受到宿主遗传、生理和代谢背景的影响。本实验室将基因导入集胞藻PCC 6803时,发现该基因无法正常表达和发挥功能,工程藻株中合成的蔗糖无法有效分泌至胞外[34]。这就意味着在未来高效光驱固碳合成蔗糖细胞工厂的开发过程中,分泌蛋白与底盘藻株之间的适配性也是需要考虑的问题,通过资源挖掘和酶工程改造提高蔗糖分泌蛋白在特定的蓝细菌底盘藻株中的表达和活性,将成为提升蔗糖分泌、强化蔗糖合成的重要策略。
2.2 蔗糖合成途径的强化和降解途径的阻断
除了解决蔗糖分泌的瓶颈问题之外,对蓝细菌中直接参与蔗糖合成和降解代谢的节点基因进行改造,也是提高蔗糖合成效率的重要策略,主要包括蔗糖合成途径的强化和降解途径的阻断两方面。本实验室在针对集胞藻PCC 6803的蔗糖合成能力强化研究中发现,增强蔗糖合成途径关键基因的表达对提升蔗糖产量有重要意义[34]。通过蔗糖合成酶、蔗糖磷酸合成酶以及UDP葡萄糖焦磷酸酶三个基因的共同表达,可以将工程藻株的蔗糖产量提升2倍;而阻断蔗糖合成竞争途径甘油葡萄糖苷合成的关键基因,可以将藻株蔗糖产量提升1.5倍;当两种策略结合时,获得的工程藻株相比PCC6803野生型藻株的蔗糖产量提升了4倍[34]。本实验室对聚球藻PCC 7942的改造中同样发现,在导入了基因的工程藻株中,过量表达PCC 7942自身的蔗糖合成酶基因,可以将工程藻株的蔗糖产量提高74%;而在和共同过量表达的藻株中,的过量表达可以使单位细胞的蔗糖合成能力提高3倍 (590 mg/L提高至超过1 760 mg/L)[35]。对于处于盐胁迫状态的蓝细菌藻株而言,当具有足够的碳源供应时,蔗糖合成途径的催化活性成为蔗糖合成的限速步骤,强化合成途径关键蛋白的表达可以有效提升蔗糖的生产效率和实际产量。
如前所述,蔗糖作为蓝细菌细胞中天然的相容性溶质,其自身代谢存在内源性的平衡机制,蔗糖水解酶invertase的存在可以将过度积累的蔗糖迅速降解为葡萄糖和果糖,继而经过磷酸化后进入中心代谢。2012年,Ducat等的工作中首次证明在导入了基因的PCC7942藻株中敲除水解酶基因,可以将蔗糖产量进一步提升15%。当把的敲除与糖原合成节点基因的敲除相结合时,最终蔗糖产量得到25%的提高[9]。还有研究发现,在蔗糖合成途径得到强化的PCC 6803工程藻株[34]中敲除水解酶基因,可以将蔗糖产量进一步提高40%[36]。
2.3 糖原代谢的扰动
光合微藻的一个普遍特征是胞内存在天然的碳汇机制,以储存卡尔文循环固定的、超出细胞正常生长所需的碳源和能量,蓝细菌中最重要、最具代表性的碳汇机制是糖原的代谢。糖原代谢的存在对于蓝细菌抵抗环境胁迫、适应营养物质动态变化具有重要意义,然而对于化学品的光驱固碳合成而言,糖原合成被普遍地视为一种主要的竞争途径[37]。Xu等针对聚球藻PCC 7002的研究发现,通过敲除两个糖原合成酶基因 (和) 可以彻底阻断PCC 7002细胞的糖原合成和积累;当糖原合成能力缺失的突变株遇到盐胁迫时,胞内积累的蔗糖和甘油葡萄糖苷含量均有所提升,其中蔗糖含量大约提高3倍[38]。Ducat在导入了基因的PCC 7942工程藻株中,敲除糖原合成的限速酶ADP-葡萄糖焦磷酸化酶编码基因,使工程藻株的蔗糖产量提高了5%–10%[9]。但是需要注意的是,基因的敲除,对细胞的生理鲁棒性造成了显著的影响,面对盐胁迫时,工程细胞的生长代时从12 h延长至43.5 h,即使经过驯化后,仍然达到20 h[9],从光驱固碳产糖全过程的综合效益来考量,通过基因敲除来阻断糖原合成是否合理仍有待评价。
2018年,本实验室对糖原代谢和蔗糖合成的关系取得了新的认识。在同样导入了基因的PCC 7942工程藻株中,使用一个茶碱调控的核糖开关控制GlgC蛋白的丰度,进而实现了对糖原含量的人工调控。然而,在该系统下我们发现当工程藻株中糖原量减少时,盐胁迫条件下蔗糖含量不但没有提升反而有所降低,而且在调控范围内,蔗糖产量与糖原含量成正相关。进一步的研究表明,当在和同时过量表达的工程藻株中,使用强启动子P过量表达,将糖原含量占细胞干重比从30%提高至50%时,藻株的蔗糖合成能力提升了30%–70%,盐胁迫2 d内,蔗糖产量从335 mg/L (7 mg/(L·h)) 提高至超过1 170 mg/L (24.4 mg/(L·h))[35]。
在本实验室的工作[35]和Ducat等的研究工作[9]中,糖原合成-积累与蓝细菌蔗糖合成能力表现出不同的关系,而这种不同可能是由培养模式造成的。在Ducat实验中,NaCl胁迫从培养初期就存在,也就是说工程藻株中蔗糖合成与细胞生物质积累是同步、偶联的,在这种模式下,阻断糖原积累,将迫使细胞将“溢出”的碳流和能量流分配给蔗糖合成这一“替代性”碳汇途径,因此蔗糖合成会有所增加;而本实验室所采用的是先将藻株培养至对数末期,然后进行盐胁迫,此时工程藻株的生物量积累已经基本停止,而已经存储在糖原中的碳源可以作为“储备碳库”,为蔗糖合成提供卡尔文循环以外的补充碳流,因而也能提高蔗糖的合成。前后两组研究的对比也说明,在蓝细菌光驱固碳细胞工厂的设计和开发过程中,针对不同环境、生理和代谢状态,提高细胞天然碳汇机制与人工碳汇途径之间的适配程度,合理优化碳流分配具有重要意义。
2.4 生物量积累阻断策略
与糖原代谢扰动策略类似,最大限度地阻断细胞生物质的积累,以使光合碳流尽可能地向目标代谢产物分配是最近提出的一种蓝细菌光驱固碳细胞工厂设计策略。Ducat研究组在聚球藻PCC 7942中通过对一种重要响应性调控因子RpaB (Regulator of phycobilisome-associated B) 的过量表达,实现了工程藻株细胞生物质积累的有效阻滞,意味着通向细胞生物质合成途径的光合碳流被阻断;而在此条件下,突变株细胞的光合作用会受到严重的反馈抑制,光合效率极大降低;在过量表达藻株中,同时进行蔗糖合成酶的诱导性过量表达时,由于光合碳流重新获得新的“出口”,工程藻株中光合作用的反馈抑制即可消除,而蔗糖合成效率得到2倍的提升[39]。近期,荷兰代尔夫特理工大学的研究人员将相似策略用于乙醇细胞工厂的开发中,也取得了很好的效果,证明通过限制生物量积累来优化碳流的控制和分配在蓝细菌光驱固碳细胞工厂开发中具有良好的应用前景[40]。
2.5 蓝细菌产糖代谢工程策略展望
对微生物细胞工厂开发而言,代谢流的控制和优化是极为重要和有效的策略。增强碳流、能量流向目标代谢产物的分配,提高整条合成路线的原子经济性是提高生物合成、生物炼制技术体系经济竞争力的关键。然而,从代谢流的角度上看,目前合成水平较高的蓝细菌蔗糖细胞工厂 (速生聚球藻UTEX 2973中过量表达蔗糖转运蛋白CscB),分配向蔗糖合成的光合碳流可以达到光合固碳总量的60%左右,用于细胞生物量合成的碳流比率只占40%左右;而在细胞生物量中可动员潜力较大的碳水化合物储备-糖原合成占细胞干重比率一般在30%–50%之间,在光合固碳总量中占比则在5%–20%范围内[32]。从这个角度看,对蓝细菌光驱固碳合成蔗糖技术而言,未来以进一步提升蔗糖合成水平、增强技术的可应用潜力为目标,其关键在于“开源”而非“节流”。仅仅通过碳源分配模式层面的优化,很难使蔗糖合成水平获得质的提高,而且可能会影响细胞正常生长和代谢的鲁棒性和适切性,以生长速度和光合活性降低为代价而片面强调目标产品碳流占比的提高,其结果往往是整个光驱固碳合成过程的效率的降低。蓝细菌光驱固碳产糖技术合成水平的突破更应该着眼于整体提升蓝细菌底盘藻株和工程藻株的光驱固碳效能,探索从根本上突破限制天然光合固碳系统效率和活性的机制性瓶颈,将蔗糖合成代谢网络的“源头加宽、池子挖深”,通过光合作用中固定的碳流的整体强化实现蔗糖产量的大幅提高。
3 基于蓝细菌光驱固碳合成蔗糖技术的人工合成光驱共生系统
3.1 人工合成光驱共生系统的概念验证
如前所述,蔗糖分泌蛋白的导入推动了高效的蓝细菌光驱固碳合成细胞工厂的成功开发,实现了基于光合微藻单一平台的、由环境中的太阳能和二氧化碳向蔗糖的直接合成和分泌。然而,蔗糖的有效分泌也同样提升了蓝细菌工程藻株培养体系被异养微生物污染的风险。除了采用严格的生物污染控制策略、减少杂菌入侵和增殖概率的策略之外,模拟自然条件下地衣等自养-异养生物共生体系,将蓝细菌产糖藻株和能以蔗糖为碳源的异养微生物细胞工厂共同培养,人工构建光驱共生合成系统以进行蔗糖的原位利用,成为另一种可行的选择。
2012年,Ducat等向聚球藻PCC 7942导入基因,实现了盐胁迫条件下蔗糖的合成和分泌后,首先探索了以蓝细菌光驱固碳产糖系统支撑经典模式异养微生物——酿酒酵母生存和生长的可能性。研究人员首先证实,向培养聚球藻PCC 7942的BG11培养基中补充部分氮源和2%的蔗糖后,就可以用于酿酒酵母的培养;进而又发现,在产糖蓝细菌藻株 (导入并诱导表达了基因的聚球藻PCC 7942) 的培养体系中,直接接种酿酒酵母,蓝细菌细胞所合成并分泌的蔗糖可以维持酵母细胞生存并进行至少两次分裂[9]。上述研究初步证实了以蓝细菌光驱固碳产糖体系为基础,维持人工合成共生体系运行的可行性。
3.2 人工光驱共生合成体系的开发和应用
Ducat实验室进而探索了蓝细菌光驱固碳合成蔗糖细胞工厂与3种经典的异养工业微生物 (大肠杆菌、枯草芽孢杆菌、酿酒酵母) 分别进行共培养的可行性[41]。研究结果表明,以蓝细菌光驱固碳产糖为能量和物质基础的共生体系能够较为稳定地维持数周到数月的时间,而且面对不同的光照强度和光照节律表现出很强的鲁棒性。共培养体系中,异养微生物的生长和代谢完全依赖于蓝细菌合成并分泌的蔗糖,令人惊讶的是异养微生物的生长甚至可以反向促进蓝细菌产糖细胞的光合固碳和生长,并因此进一步增强了共生系统的稳定性和鲁棒性。如图2所示,当使用进行了代谢工程改造的异养微生物细胞工厂替代其野生型菌株后,人工合成的光合共生系统还可以支撑高附加值化学品的生物合成 (枯草芽孢杆菌合成淀粉酶、大肠杆菌合成聚羟基丁酸酯)[41]。
近期,该研究组对蓝细菌光驱固碳产糖支撑的人工合成共生体系进行了优化,主要内容是使用海藻酸钠为基质对产糖蓝细菌细胞进行包覆,这种包覆对蓝细菌细胞的存活和产糖活性影响不大,却能够很大程度上限制细胞的复制,从而能够使光合碳流更多定向于蔗糖的合成上,与浮游状态的细胞相比,海藻酸钠包覆的细胞蔗糖单位生产效率得到了2–3倍的提高[42]。将海藻酸钠包覆的蓝细菌产糖细胞与一种天然的PHB合成微生物——玻利维亚盐单胞菌共培养,所形成的光驱共生系统对环境扰动和生物污染表现出极强的抵抗能力,可以在长达5个月的培养时间中维持整体生物量 (主要是) 和目标产品PHB的持续增长,在此期间不需要外源添加任何抗生素和其他选择性策略。此外,与浮游的蓝细菌细胞相比,海藻酸钠包覆体与细胞在沉降系数上差异更大,意味着包含PHB的细胞生物量可以更便捷地从共生培养系统中进行选择性采集。研究人员还证实这种海藻酸钠包覆体同样可以用于能够合成PHB的大肠杆菌工程菌株共培养,表明这一策略具有较好的普适性[42]。
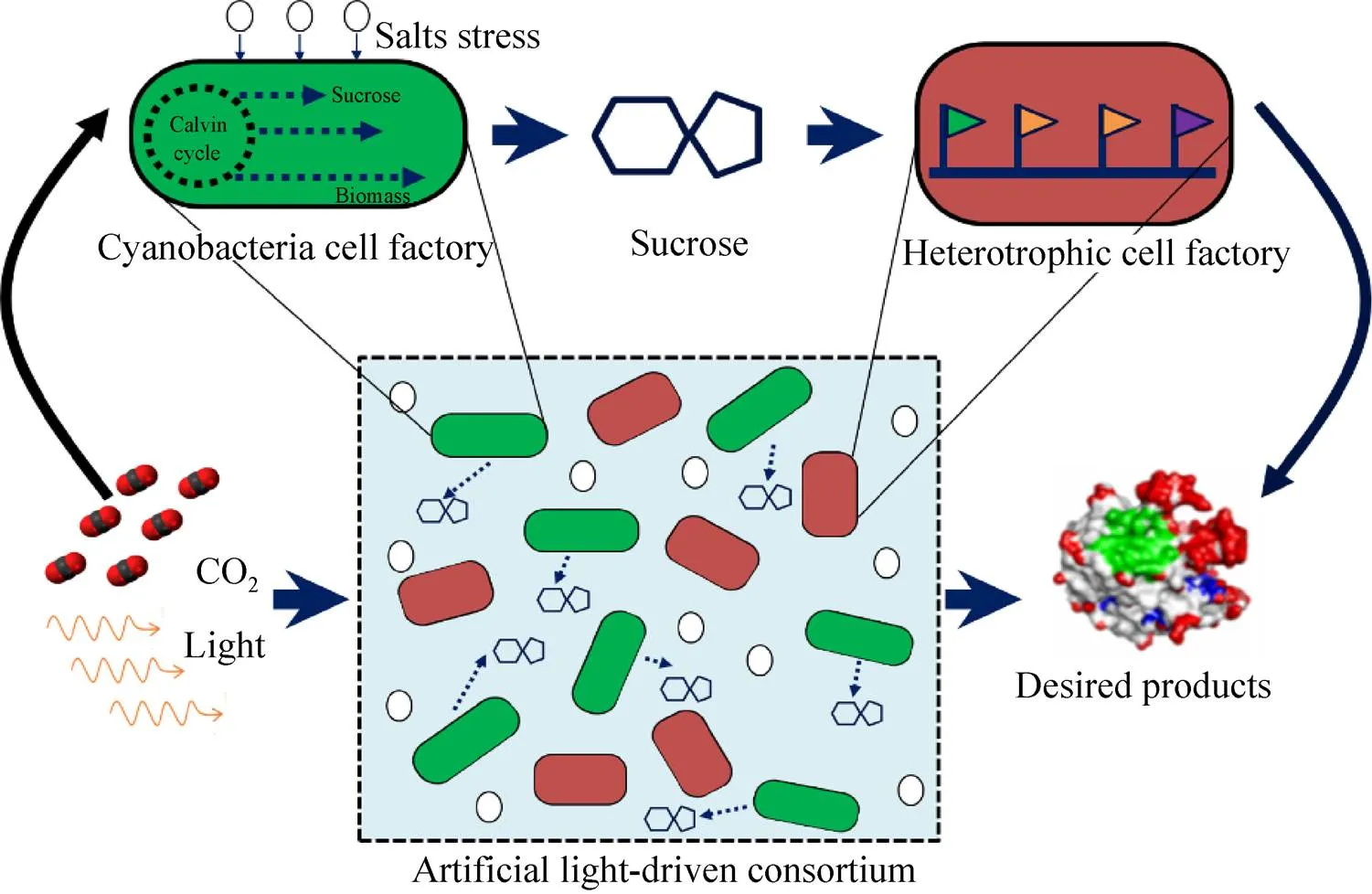
图2 基于蓝细菌光驱固碳合成蔗糖技术的人工合成光驱共生系统的设计和工作原理
值得注意的是,以现有的蓝细菌光驱固碳合成蔗糖技术为基础的人工合成光驱共生合成系统,要求所采用的异养微生物细胞工厂必须具备蔗糖的利用能力,而对于天然无法利用吸收-代谢蔗糖的微生物菌株则需要进行针对性改造。与前面介绍的其他异养微生物相比,具有很强的逆境胁迫耐受能力的恶臭假单胞菌对产糖蓝细菌所用的培养基的适应性最好,只需要很小的营养补充,非常适合于共培养[43]。但是该菌无法利用蔗糖,Lowe等为了提高的蔗糖利用能力,向该菌中导入了系统,其中CscA能够将胞外多糖水解为葡萄糖和果糖,而CscB则可以促进糖类的吸收,最终构建了可以进行PHB合成的人工合成光驱共生系统[43]。
3.3 人工光驱共生合成体系的概念扩展和机制研究
从设计上看,目前大多人工构建的光驱共生系统都是以单向支撑的,完全以蓝细菌的光驱固碳合成蔗糖为系统维持运行的能量和物质供应基础。近期,Smith等设计了一种双向互通式共生系统,利用广泛应用的产糖聚球藻藻株 (导入了的聚球藻PCC 7942) 和一种固碳微生物——棕色固氮菌,人工构建了一种新的互利型共生体[44]。在这个共生体系中,产糖蓝细菌藻株在盐胁迫条件下,利用光合作用固碳合成蔗糖并分泌至胞外,提供给棕色固氮菌有机碳源;而棕色固氮菌则利用蔗糖生长代谢,进而反向为产糖蓝细菌提供有机氮源。与此前报道的人工光驱共生体系相比,这种双向互利式光驱共生体可以在最基本的营养条件下自我维持,不需要额外添加任何有机氮源和碳源就可以进行有价值的代谢物的合成[44]。
蓝细菌光驱固碳合成蔗糖细胞工厂和合成高附加值化学品的异养微生物细胞的共培养系统,是模拟自然条件下自养-异养生物共生体系而构建的人工合成共生模式[45],实现从无机CO2向高附加值有机产物的全链条转化。与单一平台的合成模式相比 (直接在蓝细菌中构建目标化学品的合成途径),这种共生系统通过将具备多样化代谢和生理特性的不同微生物组分有机整合,对复杂的、涉及大量催化步骤的反应途径造成的代谢和生理负担进行分流和缓冲,有利于实现稳定、可持续的生物合成过程。虽然理论上,蓝细菌光合作用固定的碳流中一大部分会被重新定向于共生的异养微生物生物量的积累,并因此造成可进行光合作用的细胞数量降低;但这种损失可以通过共生体系中,异养微生物代谢对蓝细菌生长的“反哺”式有利作用来部分弥补。已有的研究表明,向微藻培养体系中接种来自其自然生长环境中的异养微生物能有效地促进微藻细胞的光合生长和代谢活性[46-47];而在人工合成光驱共生体系的开发过程中也发现,与异养微生物 (包括大肠杆菌、枯草芽孢杆菌和酵母) 的共培养对蓝细菌细胞光合生长有显著的生长促进和胁迫保护作用[41,45]。关于这种促进和保护作用具体机制的解析仍处于探索阶段。Li等在研究产蔗糖蓝细菌和胶红类酵母菌的共培养时发现,蓝细菌在高密度培养下,其活跃的光合作用会导致培养体系中大量积累活性氧并导致蓝细菌生长的抑制;而共培养的酵母细胞可以有效清除活性氧,减轻蓝细菌的生理负担并促进其生长[45]。在未来,为了实现光合自养微生物和异养微生物之间的最优平衡,需要进一步探索设计原则和有效调控方案,从而实现合成共生体内部的代谢互补和互利[48]。
4 总结和展望
全球范围内,蓝细菌通过高效的光合作用提供了生物圈内20%左右的有机碳源,是极为重要的初级生产力[49-50]。基于合成生物学和代谢工程技术发展,已经可以通过基因、蛋白、途径层面上使这一过程集约化、可控化,以光能为驱动将光合自养细胞中二氧化碳和水直接转化为含能有机分子。而光合生物制造技术的发展方向则是在此基础上,实现大尺度时空范围下,定制化的蓝细菌和微藻细胞群体中,能量和物质的高效、高通量、定向转化。蓝细菌光驱固碳合成蔗糖技术是一项具有代表性的光合生物制造技术,也是极具潜力的新型糖原料供应路线。相比较于传统的“植物种植-生物质采集-原料预处理-糖类提取”的路线,“微藻培养-糖类合成”的技术模式过程简单、产物明确,而且可以依托盐碱地、滩涂等边际土地进行工程应用,既“不与人争粮”、又“不与粮争地”,可以同时达到固碳减排和促进绿色生物经济模式发展的效果。以目前的36 mg/(L·h)的蔗糖合成水平计算,如果在规模化培养体系下成功地等效放大,其估算效益可以达到每公顷土地年产蔗糖55吨的水平,远远超过同等种植面积的甘蔗的蔗糖生产能力,技术和模式的发展前景非常可观[9]。然而,要真正推动蓝细菌光驱固碳产糖技术的工程化、规模化应用,有待解决的问题还很多。
首先,蓝细菌盐胁迫响应型蔗糖合成的调控机制仍不清楚。目前,蓝细菌蔗糖合成仍依赖于高浓度盐胁迫,通过合成生物学和代谢工程改造来实现“非盐胁迫型”蔗糖合成的设想尚未实现。这在一定程度上增加了光驱固碳产糖技术的复杂性和应用难度。从遗传调控和生理生化角度上,揭示蔗糖合成途径在“盐胁迫”/“非盐胁迫”两种模式下的活动机制,进而重构调控模式,实现“人工控制信号”替代“盐胁迫信号”进行蔗糖合成的诱导,将是简化蓝细菌光驱固碳产糖条件、提高该技术成熟度的重要发展方向。
其次,蓝细菌底盘藻株和产糖工程藻株的逆境胁迫耐受性仍有待提高。与实验室内理想而稳定的环境条件相比,微藻规模化培养中可能会遇到高温、高光、高pH等胁迫因素;而产糖藻株的培养过程中,分泌到胞外的蔗糖进一步增加了生物污染的风险,为了控制、抑制生物污染而采取的各种选择性策略和条件对蓝细菌的鲁棒性也提出了更高的要求。现阶段,光驱固碳产糖细胞工厂普遍以集胞藻PCC 6803、聚球藻PCC 7942等模式藻株为底盘进行开发,其生理鲁棒性和适切性难以满足未来规模化培养环境的需求。筛选、开发具有更强逆境适应能力的底盘藻株,或者系统应用合成生物技术提升现有藻株的逆境适应能力,将是下一阶段蓝细菌产糖细胞工厂开发所必须考虑的方向[48]。
第三,蓝细菌光驱固碳产糖体系中蔗糖的高效分离和采收技术研究仍是空白。如前所述,虽然通过开发人工合成光驱共生体系等策略可以在一定程度上解决分泌到胞外的蔗糖容易引发杂菌污染的问题,但着眼于未来更大规模、更广范围的光驱固碳合成糖类技术的开发应用,蔗糖为代表的糖类产品如何快速、有效地从培养体系中分离出来仍然是亟待解决的问题,强效的、特异性的树脂吸附、膜分离技术的开发将有望为这一问题的解决提供助力。
未来,通过系统运用合成生物学、系统生物学、过程工程科学的策略和手段,深入解析蓝细菌产糖的遗传和代谢机制,解除太阳能驱动下胞内物质和能量向蔗糖转化的机制性瓶颈,结合适配性的工艺和设备,光驱固碳产糖技术的开发和应用必将取得新的突破。
[1] Zhang YP, Zhu Y, Zhu Y, et al. The importance of engineering physiological functionality into microbes. Trends Biotechnol, 2009, 27(12): 664–672.
[2] Dien BS, Cotta MA, Jeffries TW, et al. Bacteria engineered for fuel ethanol production: current status. Appl Microbiol Biotechnol, 2003, 63(3): 258–266.
[3] Rastogi RP, Pandey A, Larroche C, et al. Algal green energy-R & D and technological perspectives for biodiesel production. Renew Sustain Energy Rev, 2018, 82: 2946–2969.
[4] Waterbury JB, Watson SW, Guillard RR, et al. Widespread occurrence of a unicellular, marine, planktonic, cyanobacterium. Nature, 1979, 277(5694): 293–294.
[5] Lu XF. A perspective: photosynthetic production of fatty acid-based biofuels in genetically engineered cyanobacteria. Biotechnol Adv, 2010, 28(6): 742–746.
[6] Melis A. Photosynthesis-to-fuels: from sunlight to hydrogen, isoprene, and botryococcene production. Energ Environ Sci, 2012, 5(2): 5531–5539.
[7] Hays SG, Ducat DC. Engineering cyanobacteria as photosynthetic feedstock factories. Photosynth Res, 2015, 123(3): 285–295.
[8] Hagemann M. Molecular biology of cyanobacterial salt acclimation. FEMS Microbiol Rev, 2011, 35(1): 87–123.
[9] Ducat DC, Avelar-Rivas JA, Way JC, et al. Rerouting carbon flux to enhance photosynthetic productivity. Appl Environ Microbiol, 2012, 78(8): 2660–2668.
[10] Brown AD, Simpson JR. Water relations of sugar-tolerant yeasts: the role of intracellular polyols. J Gen Microbiol, 1972, 72(3): 589–591.
[11] Mackay MA, Norton RS, Borowitzka LJ. Organic osmoregulatory solutes in cyanobacteria. J Gen Microbiol, 1984, 130: 2177–2191.
[12] Reed RH, Stewart WDP. Osmotic adjustment and organic solute accumulation in unicellular cyanobacteria from freshwater and marine habitats. Mar Biol, 1985, 88(1): 1–9.
[13] Damrow R, Maldener I, Zilliges Y. The multiple functions of common microbial carbon polymers, glycogen and PHB, during stress responses in the non-diazotrophic cyanobacteriumsp. PCC 6803. Front Microbiol, 2016, 7: 966.
[14] Nakamura Y, Takahashi J, Sakurai A, et al. Some cyanobacteria synthesize semi-amylopectin type α-polyglucans instead of glycogen. Plant Cell Physiol, 2005, 46(3): 539–545.
[15] Ball SG, Morell MK. From bacterial glycogen to starch: understanding the biogenesis of the plant starch granule. Annu Rev Plant Biol, 2003, 54: 207–233.
[16] Guerra LT, Xu Y, Bennette N, et al. Natural osmolytes are much less effective substrates than glycogen for catabolic energy production in the marine cyanobacteriumsp. strain PCC 7002. J Biotechnol, 2013, 166(3): 65–75.
[17] Hendry JI, Prasannan C, Ma F, et al. Rerouting of carbon flux in a glycogen mutant of cyanobacteria assessed via isotopically non-stationary13C metabolic flux analysis. Biotechnol Bioeng, 2017, 114(10): 2298–2308.
[18] Curatti L, Porchia AC, Herrera-Estrella L, et al. A prokaryotic sucrose synthase gene () isolated from a filamentous nitrogen-fixing cyanobacterium encodes a protein similar to those of plants. Planta, 2000, 211(5): 729–735.
[19] Porchia AC, Curatti L, Salerno GL. Sucrose metabolism in cyanobacteria: sucrose synthase fromsp. strain PCC 7119 is remarkably different from the plant enzymes with respect to substrate affinity and amino-terminal sequence. Planta, 1999, 210(1): 34–40.
[20] Curatti L, Giarrocco L, Salerno GL. Sucrose synthase and RuBisCo expression is similarly regulated by the nitrogen source in the nitrogen-fixing cyanobacteriumsp. Planta, 2006, 223(5): 891–900.
[21] Kanesaki Y, Suzuki I, Allakhverdiev SI, et al. Salt stress and hyperosmotic stress regulate the expression of different sets of genes insp. PCC 6803. Biochem Biophys Res Commun, 2002, 290(1): 339–348.
[22] Allakhverdiev SI, Sakamoto A, Nishiyama Y, et al. Inactivation of photosystems I and II in response to osmotic stress incontribution of water channels. Plant Physiol, 2000, 122(4): 1201–1208.
[23] Allakhverdiev SI, Sakamoto A, Nishiyama Y, et al. Ionic and osmotic effects of NaCl-induced inactivation of photosystems I and II insp. Plant Physiol, 2000, 123(3): 1047–1056.
[24] Giner-Lamia J, López-Maury L, Reyes JC, et al. The CopRS two-component system is responsible for resistance to copper in the cyanobacteriumsp. PCC 6803. Plant Physiol, 2012, 159(4): 1806–1818.
[25] Liu ZX, Li HC, Wei YP, et al. Signal transduction pathways insp. PCC 6803 and biotechnological implications under abiotic stress. Crit Rev Biotechnol, 2015, 35(2): 269–280.
[26] Narikawa R, Suzuki F, Yoshihara S, et al. Novel photosensory two-component system (PixA-NixB-NixC) involved in the regulation of positive and negative phototaxis of cyanobacteriumsp. PCC 6803. Plant Cell Physiol, 2011, 52(12): 2214–2224.
[27] Liang CW, Zhang XW, Chi XY, et al. Serine/threonine protein kinase SpkG is a candidate for high salt resistance in the unicellular cyanobacteriumsp. PCC 6803. PLoS ONE, 2011, 6(5): e18718.
[28] Ehira S, Kimura S, Miyazaki S, et al. Sucrose synthesis in the nitrogen-fixing cyanobacteriumsp. strain PCC 7120 is controlled by the two-component response regulator orra. Appl Environ Microbiol, 2014, 80(18): 5672–5679.
[29] Desplats P, Folco E, Salerno GL. Sucrose may play an additional role to that of an osmolyte insp. PCC 6803 salt-shocked cells. Plant Physiol Biochem, 2005, 43(2): 133–138.
[30] Cumino AC, Perez-Cenci M, Giarrocco LE, et al. The proteins involved in sucrose synthesis in the marine cyanobacteriumsp. PCC 7002 are encoded by two genes transcribed from a gene cluster. FEBS Lett, 2010, 584(22): 4655–4660.
[31] Salerno GL, Porchia AC, Vargas WA, et al. Fructose-containing oligosaccharides: novel compatible solutes incells exposed to salt stress. Plant Sci, 2004, 167(5): 1003–1008.
[32] Song K, Tan XM, Liang YJ, et al. The potential ofUTEX 2973 for sugar feedstock production. Appl Microbiol Biotechnol, 2016, 100(18): 7865–7875.
[33] Yu JJ, Liberton M, Cliften PF, et al.UTEX 2973, a fast growing cyanobacterial chassis for biosynthesis using light and CO2. Sci Rep, 2015, 5: 8132.
[34] Du W, Liang FY, Duan YK, et al. Exploring the photosynthetic production capacity of sucrose by cyanobacteria. Metab Eng, 2013, 19: 17–25.
[35] Qiao CC, Duan YK, Zhang MY, et al. Effects of reduced and enhanced glycogen pools on salt-induced sucrose production in a sucrose-secreting strain ofPCC 7942. Appl Environ Microbiol, 2018, 84(2): e02023–17.
[36] Kirsch F, Luo Q, Lu XF, et al. Inactivation of invertase enhances sucrose production in the cyanobacteriumsp. PCC 6803. Microbiology, 2018, 164(10): 1220–1228.
[37] Zhou J, Zhu TC, Cai Z, et al. From cyanochemicals to cyanofactories: a review and perspective. Microb Cell Fact, 2016, 15: 2.
[38] Xu Y, Guerra LT, Li ZK, et al. Altered carbohydrate metabolism in glycogen synthase mutants ofsp. strain PCC 7002: Cell factories for soluble sugars. Metab Eng, 2013, 16: 56–67.
[39] Abramson BW, Lensmire J, Lin YT, et al. Redirecting carbon to bioproduction via a growth arrest switch in a sucrose-secreting cyanobacterium. Algal Res, 2018, 33: 248–255.
[40] Shabestary K, Anfelt J, Ljungqvist E, et al. Targeted repression of essential genes to arrest growth and increase carbon partitioning and biofuel titers in cyanobacteria. ACS Synth Biol, 2018, 7(7): 1669–1675.
[41] Hays SG, Yan LL, Silver PA, et al. Synthetic photosynthetic consortia define interactions leading to robustness and photoproduction. J Biol Eng, 2017, 11: 4.
[42] Weiss TL, Young EJ, and Ducat DC. A synthetic, light-driven consortium of cyanobacteria and heterotrophic bacteria enables stable polyhydroxybutyrate production. Metab Eng, 2017, 44: 236–245.
[43] Löwe H, Hobmeier K, Moos M, et al. Photoautotrophic production of polyhydroxyalkanoates in a synthetic mixed culture ofand. Biotechnol Biof, 2017, 10: 190.
[44] Smith MJ, Francis MB. A Designed–coculture for chemical photoproduction from air, water, phosphate, and trace metals. ACS Synth Biol, 2016, 5(9): 955–961.
[45] Li TT, Li CT, Butler K, et al. Mimicking lichens: incorporation of yeast strains together with sucrose-secreting cyanobacteria improves survival, growth, ROS removal, and lipid production in a stable mutualistic co-culture production platform. Biotechnol Biof, 2017, 10: 55.
[46] Morris JJ, Kirkegaard R, Szul MJ, et al. Facilitation of robust growth ofcolonies and dilute liquid cultures by “helper” heterotrophic bacteria. Appl Environ Microbiol, 2008, 74(14): 4530–4534.
[47] Nascimento MD, De Los Angeles Dublan M, Ortiz-Marquez JCF, et al. High lipid productivity of anartificial consortium. Bioresour Technol, 2013, 146: 400–407.
[48] Luan GD, Lu XF. Tailoring cyanobacterial cell factory for improved industrial properties. Biotechnol Adv, 2018, 36(2): 430–442.
[49] Rousseaux CS, Gregg WW. Interannual variation in phytoplankton primary production at a global scale. Remote Sens, 2014, 6(1): 1–19.
[50] Flombaum P, Gallegos JL, Gordillo RA, et al. Present and future global distributions of the marine cyanobacteriaand. Proc Natl Acad Sci USA, 2013, 110(24): 9824–9829.
Cyanobacteria based photosynthetic production of sucrose: development and prospect
Xintong Chi1,2, Shanshan Zhang2, Shaoming Mao1, Guodong Luan2, Quan Luo2, and Xuefeng Lü2
1 College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China 2 Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong, China
Biorefinery technologies provide promising solutions to achieve sustainable development facing energy and environment crisis, while abundant sugar feedstock is an essential basis for biorefinery industries. Photosynthetic production of sucrose with cyanobacteria is an alternative sugar feedstock supply route with great potentials. Driven by solar energy, cyanobacteria photosynthetic cell factory could directly convert carbon dioxide and water into sucrose, and such a process could simultaneously reduce carbon emissions and supply sugar feedstocks. Here we introduced the history and updated the state-of-the-art on development of cyanobacteria cell factories for photosynthetic production of sucrose, summarized the progress and problems on mechanisms of sucrose synthesis, metabolic engineering strategies and technology expansions, and finally forecasted the future development direction in this area.
cyanobacteria, sucrose, photosynthesis, metabolic engineering, salt stress
January 14, 2019;
January 31, 2019
Supported by: National Natural Science Foundation of China (Nos. 31600034, 31770092), Key Scientific Research Projects of Education Department of Hunan Province (No. 15A198).
Shaoming Mao. Tel: +86-731-85623497, E-mail: msm526@163.com Guodong Luan. Tel: +86-532-80662711, Email: luangd@qibebt.ac.cn.
国家自然科学基金 (Nos. 31600034, 31770092),湖南省教育厅科研重点项目 (No. 15A198) 资助。
2019-06-20
http://kns.cnki.net/kcms/detail/11.1998.Q.20190620.1123.001.html

郗欣彤, 张杉杉, 毛绍名, 等. 蓝细菌光驱固碳合成蔗糖技术的发展与展望. 生物工程学报, 2019, 35(8): 1411–1423.Chi XT, Zhang SS, Mao SM, et al. Cyanobacteria based photosynthetic production of sucrose: development and prospect. Chin J Biotech, 2019, 35(8): 1411–1423.
(本文责编 郝丽芳)

