SMARCC1对人乳腺癌细胞增殖及端粒酶活性的影响
柯少波 石薇 陈佳梅 邱虎 陈永顺
武汉大学人民医院肿瘤中心(武汉430060)
我国乳腺癌发病率占女性恶性肿瘤发病率的首位,而且呈现为年轻化的趋势,深入研究乳腺癌发病机制及治疗手段具有重要科学价值和社会意义[1-2]。本课题组在前期研究中发现[3],下调人乳腺癌细胞(MCF-7)的高迁移率族蛋白B1(high mobility group box 1,HMGB1)基因,能抑制MCF-7的增殖和侵袭转移,然而,这一作用能被过表达的SMARCC1基因所逆转,因此,HMGB1可能通过靶基因SMARCC1调控了乳腺癌细胞的生存和转移。
MCF-7细胞是从女性乳腺癌患者胸腔积液中分离而建立的细胞系,保留了多个乳腺上皮特性,是很好的乳腺癌细胞模型。但是,SMARCC1对乳腺癌生物学功能的作用和机制仍不明确。SMARCC1(BFA155)蛋白是 SWI/SNF复合体的亚基,最早在酵母菌中被发现,可改变螺旋酶和ATP酶相关基因周围的染色质结构,调控其转录。SMARCC1基因编码的蛋白质是重要的ATP依赖性染色质重塑因子,富含调控转录因子的亮氨酸序列,通过调控染色质的结构调控基因表达[4]。SMARCC1在前列腺癌中高表达,与病理分级、肿瘤分级和复发时间呈正相关[5]。此外,有研究表明[6-7],SMARCC1参与了端粒酶活性的调控,端粒酶是合成端粒(真核生物染色体的天然末端多重复区域)的逆转录酶。端粒酶的激活是恶性肿瘤细胞无限增殖及侵袭转移的重要机制之一,端粒酶活性与乳腺癌病理类型、肿瘤分化程度、患者病程等存在相关性[8]。
本研究拟进一步探讨SMARCC1基因对乳腺癌增殖和端粒酶活性的影响和可能的机制,揭示人端粒酶逆转录酶(hTERT)参与SMARCC1调控端粒酶活性的的分子机制是本研究的创新点。本研究可能为研究乳腺癌发病机制及相关基因治疗手段提供新的思路。
1 材料与方法
1.1 材料与细胞培养MCF-7细胞系购自武汉大学细胞典藏中心,DMEM培养基、双抗和胰蛋白酶、胎牛血清等(武汉爱生源生物有限公司),Trizol试剂和Lipofectamine2000试剂(美国Invitrogen公司),SMARCC1-siRNA及其对照物(广州锐博生物),25 cm2细胞培养瓶、6孔板、24孔板、96孔板、MTT试剂(武汉谷歌生物公司),凋亡试剂盒(碧云天公司)。
1.2 实验分组与转染MCF-7细胞采用DMEM培养基(含有10%胎牛血清和1%青霉素-链霉素)置于37℃5%CO2及饱和湿度的恒温培养箱中培养。本研究将细胞系分为两组,SMARCC1下调组(转染SMARCC1-siRNA)和对照组(转染siRNA阴性对照物),将细胞置于6孔板中培养,当细胞融合达到70%左右时进行转染,转染操作按照Lipofectamine 2000说明书进行,转染最终浓度为50 nmol/L,每孔液体体积为2 mL。
1.3 MTT检测细胞增殖转染24 h后,将细胞接种于96孔板中,每孔4 000个细胞且体积为设置100 μL,每组设置5个复孔,同时设置空白对照孔,培养24、48、72及96 h后采用MTT法检测各组细胞增殖情况。MTT检测步骤概括为:去除培养板中培养基后,在96孔板每孔中加入5 mg/L的MTT溶液,置于37℃下4 h后,弃掉培养基,每孔加入150 μL的DMSO孵育10 min,振荡器上微震荡15 min,用空白对照孔进行调零操作,采用酶标仪检测各组的吸光度值(OD值),绘制调零后各组吸光度值曲线。
1.4 流式细胞术检测细胞凋亡流式细胞仪检测细胞凋亡:转染48 h后,收集细胞约1×106个/mL,PBS洗涤1次、离心、弃上清,然后将细胞悬浮液重悬于1 mL孵育缓冲液中。取100 μL细胞(约1×105个)加5 μL的PI试剂和5 μL的AnnexinV-FITC试剂,置于室温下避光孵育15 min。最后加400 μL的孵育缓冲液,一般在1 h内上流式细胞仪机检测。FCM激发波长为488 nm,采用波长515 nm的通带滤器检测FITC的荧光,另一波长>560 nm的滤器检测PI。
1.5 ELISA法检测端粒酶活性采用ELISA法检测各组细胞端粒酶活性,分为实验组和对照组。首先以标准品浓度(单位为TPG)为横坐标,以450 nm处吸光值为纵坐标,绘制标准品端粒酶活性曲线,将标准品稀释成5个浓度点,每个点设置10个复孔,每孔加入50 μL标准品,设置空白孔(加入50 μL蒸馏水,不加标准品及酶标试剂),设置待测细胞样品孔,在酶标包被的板上的待测样品孔中先加入样品稀释液40 μL,再加入10 μL的待测样品。将试剂盒汇总的浓缩洗涤液用蒸馏水稀释30倍后待用;用封板膜封板后置于37℃温箱中孵育30 min,然后小心去掉封板膜,吸去液体每孔加满洗涤液,用洗涤液洗涤5次,然后每孔中加入50 μL的酶标试剂,空白孔中不加酶标试剂,温育30 min后,用洗涤液再次洗涤5次,加入显色液体,先加入50 μL显色液A,在加入50 μL显色液B,震荡混匀,37℃下避光孵育15 min,然后每孔中加入50 μL的终止液终止反应,15 min后上酶标仪及其测定,用空白孔调零,于450 nm波长处测定各孔的吸光度值(OD值)。将样品吸光度值带入标准曲线方程,计算样品端粒酶活性。
1.6 RT-PCR检测mRNA表达Trizol法提取细胞的总RNA,检测RNA浓度和纯度是否达标,按照TagMan RNA逆转录试剂盒(美国ABI公司)说明书进行逆转录,获得cDNA。采用SYBR Green PCR master mix试剂盒(日本TAKARA公司)进行qRT-PCR。采用2-△△Ct方法进行定量分析,以β-actin作为内参,计算Caspase-3、hTERT相对表达量。
1.7 WesternBlot检测蛋白表达提取细胞总蛋白 配置SDS-PAGE分离胶和浓缩胶,加样,电泳,浓缩胶80 V电泳35 min,分离胶100 V电泳90 min,分离蛋白,注意marker蛋白设置。采用湿转法进行转膜,350 mA,转膜120 min,将蛋白转至PVDF膜上。然后进行免疫杂交操作。取出PVDF膜,用BSA封闭1 h,兔抗人一抗孵育过夜(4℃条件下)。Caspase-3抗体购自三鹰公司(19677-1-AP),稀释比为1∶500,hTERT一抗购自Abcam公司(ab32020),抗体稀释比为1∶1 000,actin一抗购自三鹰公司(23660-1-AP)抗体稀释比为1∶3 000;TBST系膜3次,每次5 min,二抗(山羊抗兔)孵育1 h,二抗为HRP标记山羊抗兔IgG,购自三鹰公司(SA00001-15),抗体稀释比为1∶5 000,TBST洗膜,每次5 min,化学发光法显影,在暗室中进行曝光操作,扫描胶片上蛋白条带并用软件分析蛋白条带灰度值。
1.8 统计学方法采用SPSS 17.0软件进行统计分析,组间比较采用独立t检验,计量资料以均数±标准差表示,计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 下调SMARCC1对MCF-7细胞增殖及凋亡作用MTT实验结果表明,转染后24、48、72和96 h,SMARCC1下调组的MCF-7细胞增殖均低于对照组(P<0.05),且随着时间增加,SMARCC1下调组的MCF-7细胞增殖被抑制程度越大,具有时间依赖性,见图1。Annexin V-FITC/PI法检测细胞凋亡结果表明,SMARCC1下调组晚期凋亡率(6.8%±0.5%)高于对照组晚期凋亡率(0.9%±0.1%)(P<0.01)。见图2。
2.2 下调SMARCC1对MCF-7细胞端粒酶活性影响转染24及48 h后检测两组细胞端粒酶活性,结果显示,转染24及48 h后SMARCC1下调组MCF-7细胞端粒酶活性均低于对照组,差异有统计学意义,见表1。
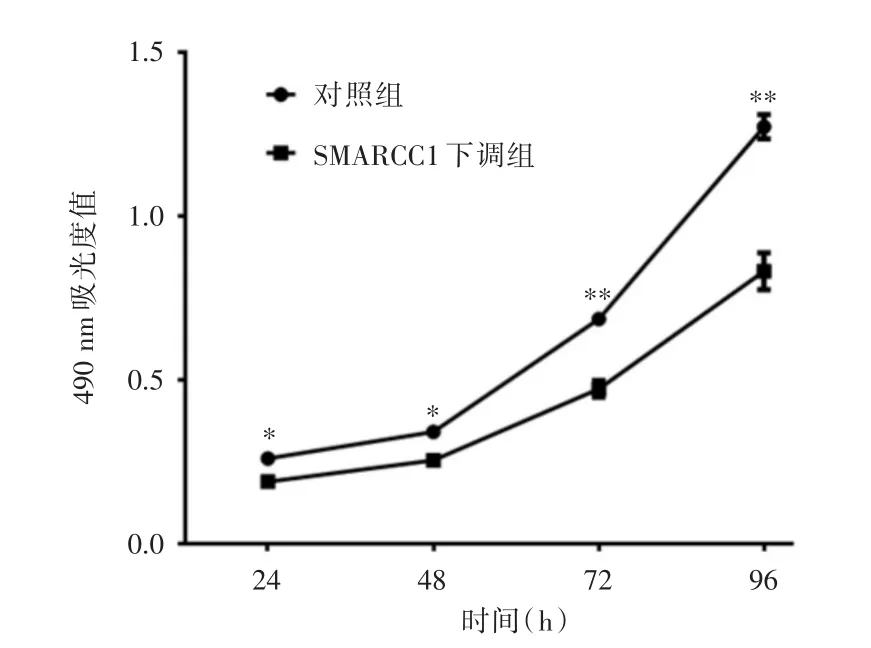
图1 MTT实验结果Fig.1 Detection of proliferation by MTT assay
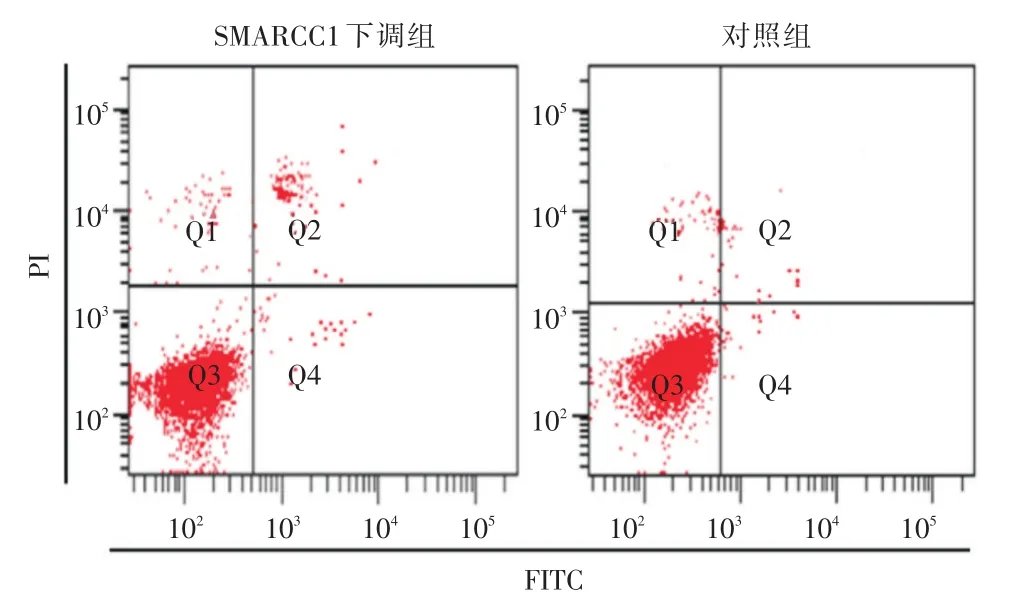
图2 Annexin V-FITC/PI法检测细胞凋亡Fig.2 Detection of apoptosis by Annexin V-FITC/PI
表1 各组端粒酶活性(TPG)Tab.1 Telomerase activation in each group ±s

表1 各组端粒酶活性(TPG)Tab.1 Telomerase activation in each group ±s
组别SMARCC1下调组对照组t值P值24 h 103.1±4.2 145.0±4.5 6.71 0.003 48 h 72.70±2.4 104.8±3.2 8.04 0.001
2.3 下调SMARCC1对MCF-7细胞Caspase-3、hTERT的mRNA及蛋白的影响RT-PCR实验结果表明,SMARCC1下调组(0.804±0.014)的MCF-7细胞Caspase-3 mRNA表达水平高于于对照组[(0.478 ± 0.005),t=5.781,P<0.01];SMARCC1下调组(0.395±0.010)的MCF-7细胞hTERT mRNA表达水平低于对照组[(0.739±0.008),t=6.203,P<0.01]。Western Blot实验结果表明,SMARCC1下调组的MCF-7细胞Caspase-3蛋白表达水平高于于对照组,P<0.01;SMARCC1下调组MCF-7细胞的hTERT蛋白表达水平低于对照组,P<0.01,见图3。
3 讨论
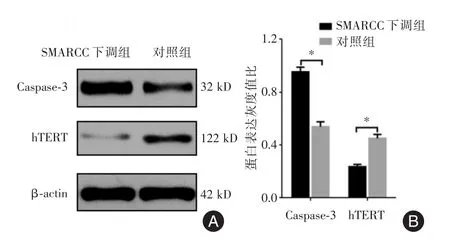
图3 Western Blot实验结果Fig.3 Protein results detected by Western Blot
核小体染色质重塑是表观遗传学的重要机制之一,主要通过改变染色质空间结构的疏松程度,影响基因的转录表达,从而调控细胞表型[9]。SWI/SNF复合体及其介导的核小体染色质重塑是肿瘤研究的焦点。卵巢癌、胃癌、肝细胞癌、膀胱癌、肾癌、髓母细胞瘤及乳腺癌等肿瘤中,SWI/SNF亚基基因高频突变[10]。SWI/SNF在肿瘤发生、发展中有着重要作用,而且可能是一种普遍机制。SWI/SNF复合体有多个核心亚基,研究表明[11-12],核心亚基SNF5在人和小鼠中表现为一种抑癌基因,SNF5在肝癌组织中表达低于癌旁组织,其表达量与肝癌细胞分化程度有关,SNF5在肝细胞肝癌中呈现为低表达,并且其低表达与肝细胞肝癌的低分化程度显著相关。SMARCC1(BFA155)蛋白同样是SWI/SNF复合体的核心蛋白组成部分之一,本课题组的前期研究[3]表明,SMARCC1的过表达能阻断下调HMGB1基因对乳腺癌细胞增殖的抑制作用,HEEBOLL等[13]研究表明 SMARCC1在前列腺癌中均呈现高表达,且细胞实验表明内源性的高表达SMARCC1促进了肿瘤细胞的增殖和侵袭,因此,SMARCC1可能是一种癌基因,然而,SMARCC1对乳腺癌细胞的生物学作用需要深入探讨。
本研究表明,沉默MCF-7细胞的SMARCC1基因,能抑制乳腺癌的增殖及促进其凋亡。这与最近有关SMARCC1在其他肿瘤中的作用相一致,KE等[14]发现过表达SMARCC1能促进结肠癌细胞的增殖,而miR-202-5p能通过靶向下调SMARCC1来抑制结肠癌细胞的增殖活性。同样的,IWAGAMI等[15]研究表明,SMARCC1的高表达与胰腺癌的预后较差和复发密切相关,miR-320c/SMARCC1是胰腺癌发生发展及耐药的关键信号通路。Caspase-3是一种蛋白酶,在恶性肿瘤细胞凋亡中起着不可替代的作用[16]。本研究显示,沉默乳腺癌细胞的SMARCC1基因能促进其凋亡,并且凋亡相关基因Caspase-3的表达显著上调。Caspase家族成员的失活是肿瘤发生的重要机制之一,而认为活化Caspase-3能促进肿瘤细胞凋亡,而它参与肿瘤细胞凋亡主要是通过诱导CTL细胞杀伤[17]。因此,SMARCC1作为重要的染色体重塑相关蛋白之一,在乳腺癌的生物学功能中发挥重要作用。
染色质重塑过程可能受到端粒酶调控,有研究发现[18],在正常人的细胞中,端粒酶hTERT的过表达可通过影响DNA甲基转移酶的活性,参与细胞表观遗传学修饰或染色质结构的调控过程,从而影响染色质重塑。本研究中,染色质重塑相关基因SMARCC1的下调能抑制细胞端粒酶活性,且端粒酶亚单位基因表达水平显著被抑制。本研究有以下创新之处,一是丰富了对乳腺癌细胞中染色质重塑与端粒酶相互调控作用认识,二是从抑制端粒酶活性的角度解释SMARCC1调控乳腺癌细胞增殖活性的现象。正常人体细胞的端粒酶活性受到严格的调控,hTERT处于被抑制状态,然而,在绝大多数恶性肿瘤中,hTERT呈现高表达,通过其启动子在转录水平激活端粒酶活性,细胞内遗传物质无限制的复制,导致无限增殖的恶性肿瘤细胞的出现。研究表明,沉默hTERT基因能显著抑制乳腺癌增殖和迁移,促进其凋亡发生[19]。IFN-α处理乳腺癌细胞后,能抑制hTERT启动子的活性,通过负性调节元件区域结合NF-κB,NF-κB通过磷酸化激活核因子而抑制hTERT的活性,同时增强Fas系统介导的细胞凋亡。
总之,沉默SMARCC1基因能抑制乳腺癌肿瘤细胞的生物学活性,其机制可能与促进Caspase-3相关凋亡途径及抑制端粒酶活性相关。然而,本研究尚无法证实SMARCC1是否直接作用于端粒酶亚单位hTERT,SMARCC1也可能间接调控了端粒酶活性,这需要更深入实验来探讨。此外,本研究尚缺乏乳腺癌模式动物的相关实验研究。

