亚硫酸二甲酯对铜腐蚀性能的研究
(连云港碱业有限公司,江苏 连云港 222042)
铜在有色金属中产量排名第二,被广泛应用于各行各业,其优点是质地坚硬,不易腐蚀,且耐高温、耐高压,被认为是耐腐蚀的金属之一。但是实际情况中,由于一些苛刻的使用条件以及长时间使用,铜也不可避免地会被腐蚀,例如铜在加工过程中会接触某些有机酯,而酯类中的硫元素会明显侵蚀铜表面形成铜绿,严重影响铜的性能和美观,因此解决铜的腐蚀问题已经成为国内外学者研究的重点。马玉红[1]等人研究指出烃类物质并不会对铜产生腐蚀,其他非烃类物质如酸、硫化物以及水在许多过程中不可避免地会腐蚀铜。王吉会[2]研究表明S2-和NaCl的混合介质对铜有一定的腐蚀行为,其中S2-通过改变铜的表面结构从而能够加剧腐蚀。Brumis V[3]和K. P. FitzGerald[4]的研究表明铜在SO2的作用下会生成铜绿,生成的铜绿会转化成(Cu4SO4(OH)6)碱式硫酸铜,其中内层的Cu2O和水层也会反应成碱性硫酸铜。Aastrup T[5]和Zakipou[6]的研究表明强氧化力的O3也会导致SO2和NO2的协同反应,因此在SO2和NO2的气氛中形成的酸会严重侵蚀铜的表面。
本文重点研究铜在生产和使用过程中存在的腐蚀行为,其中亚硫酸二甲酯的成分和结构类似于腐蚀铜的有机酯、润滑油等物质,且含有硫结构的亚硫酸二甲酯对铜有一定的侵蚀能力,故选取将铜片浸泡在亚硫酸二甲酯水解溶液中,并观察其腐蚀现象。最后通过光学显微镜、扫描电镜SEM、能谱EDS现代分析测试技术获取其微观的腐蚀形貌以及腐蚀区域的元素组成,对铜在不同酸碱度溶液中的腐蚀性能进一步分析研究,探讨铜的腐蚀机理和腐蚀性能。
1 试验部分
1.1 试验原料
本试验所采用的原材料为99.97 wt%的商业高纯紫铜,铜板紫铜呈砖红色,其物理性能见表1;亚硫酸二甲酯无色透明液体,分子式是C2H6O3S,99%分析纯,厂家上海阿拉丁生化科技股份有限公司,亚硫酸二甲酯溶解于NaOH水溶液中,使其反应生成Na2SO4和Na2SO3,其性能见表2;助剂:NaOH,分析纯,上海化学试剂有限公司;有机溶剂:无水乙醇,分析纯,上海迪凯化学试剂有限公司。

表1 铜的主要物理性能

表2 亚硫酸二甲酯的主要物理性能
1.2 试验制备工艺和方法
1.2.1 水解溶液制备
在圆底烧瓶(如图1)中加入10 mL亚硫酸二甲酯和10 mL NaOH(0.5 mol/L)水溶液,连通冷凝管及冷凝装置,冷凝管上端用气球密封,防止气体泄漏,利用调温电热器加热,加热温度控制在70~100 ℃,加热约2 h后冷却至室温。
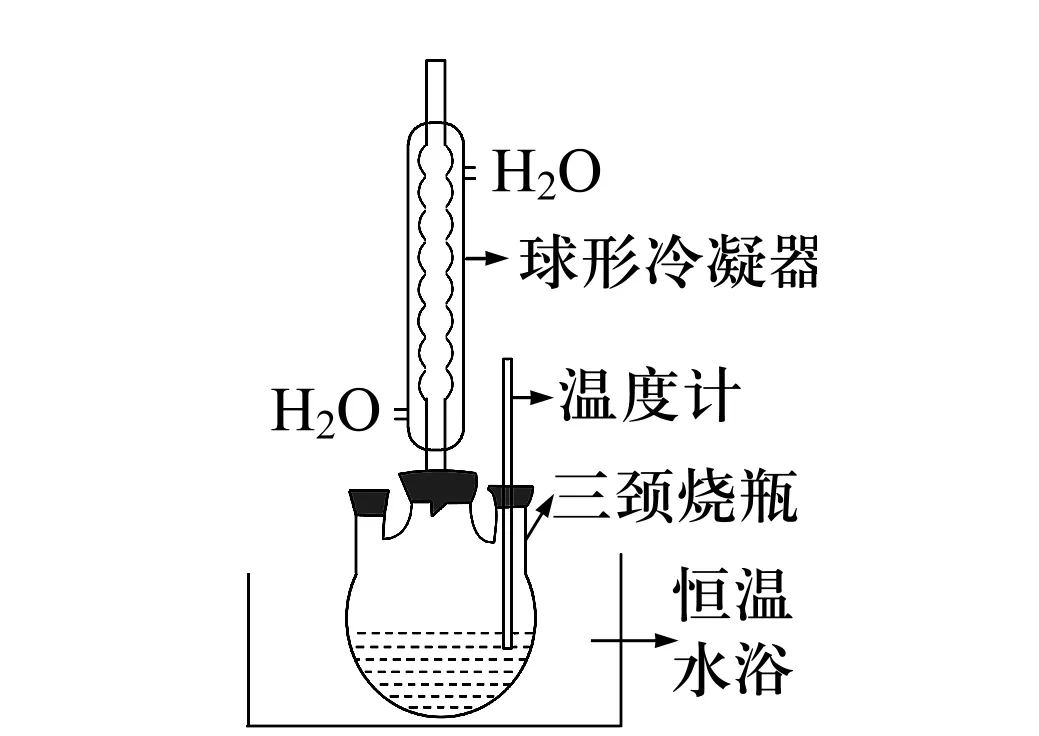
图1 制备水解溶液装置图
1.2.2 试样铜制备
线切割截取8×8 mm的紫铜,用镶嵌机进行镶嵌,利用600~1 200目的砂纸在打磨机上打磨,抛光机抛光至镜面。
1.2.3 试样SEM观察
试验采用日本电子公司生产的JSM-5900型扫描电镜进行显微观察,通过SEM观察样品的产物和形貌。扫描电压为15 kV,分辨率为3~6 nm。
1.2.4 试样X-射线衍射仪分析
采用美国热电公司ARLX′TRA型X射线衍射仪。仪器的技术指标及性能特点为:2.2 kW,Cu Kα靶、步进0.02°。仪器工作参数:管电压45 kV,管电流30 mA。扫描速率为10°/min。
1.3 试验方案
试验是将铜片按标准制样,进行打磨、抛光,将制得的样品放入到亚硫酸二甲酯的水解溶液中进行浸泡,利用光学显微镜OM、扫描电镜SEM观察其腐蚀形貌,通过能谱EDS分析腐蚀区腐蚀产物的成分,对其在不同酸碱度溶液中的腐蚀性能进一步分析研究,如图2。
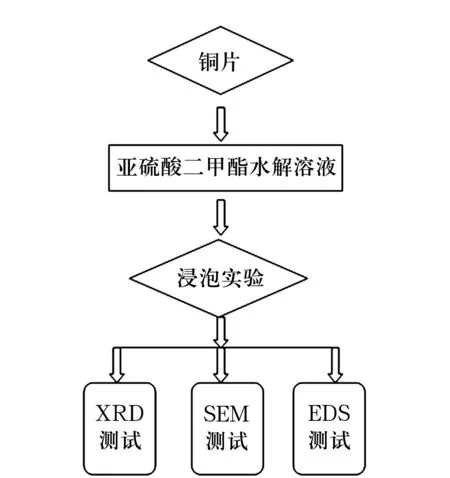
图2 试验过程示意图
其中腐蚀介质为制备得到的水解溶液,将制备的铜样品放入水浴锅中进行热循环浸泡试验(40 ℃恒温加热16 h、25 ℃恒温加热8 h),浸泡20 d后取出紫铜试样,利用用光学显微镜OM观察和扫描电镜SEM观察其腐蚀形貌,利用能谱EDS分析腐蚀产物的成分。
2 结果与讨论
2.1 腐蚀产物性能与表征
通过上述试验工艺和方法,将铜片浸泡在不同酸碱度亚硫酸二甲酯水解溶液中,15 d的腐蚀形貌如光学显微镜图3和图4所示。

图3 铜片在碱性水解溶液中的腐蚀图
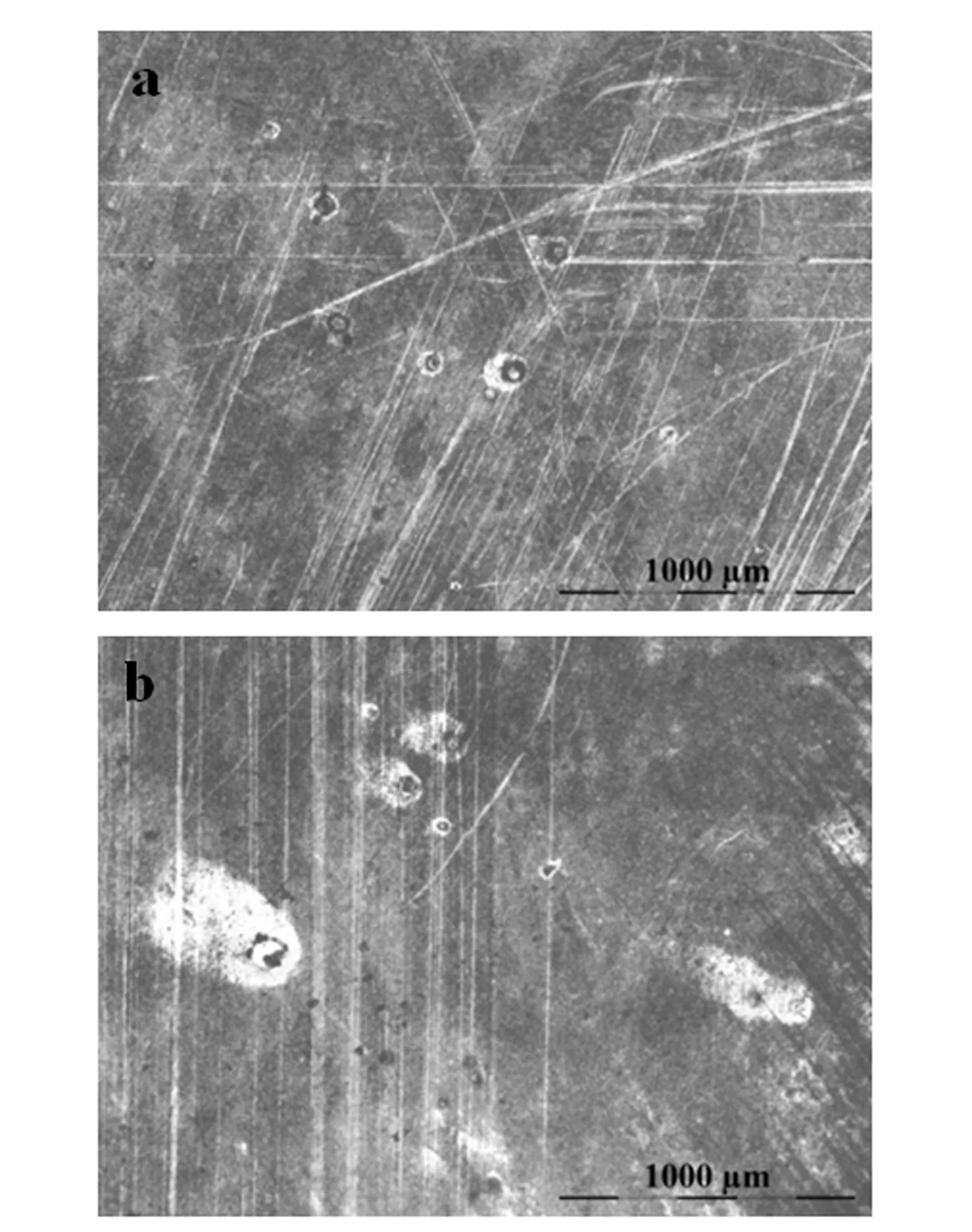
图4 铜片在中性水解溶液中的腐蚀图
通过图3(a)中可以明显观察到铜片表面中局部腐蚀区域且颜色变深,同时在图3(b)也可以观察到铜片腐蚀面积增加,其腐蚀趋势是愈加密集且右半部分中变色更加明显,这表明碱性亚硫酸二甲酯对铜有一定的侵蚀能力,对比图3(a)中闭合环状的腐蚀痕迹和图3(b)自上而下的痕迹,这说明铜在该溶液中的腐蚀主要以点蚀和局部腐蚀为主,且随着点、线延续腐蚀区域和腐蚀产物也会逐渐增加,而铜片在使用过程中受到的腐蚀经常是杂乱无章的,见图4。
通过图4可以观察到:中性条件下亚硫酸二甲酯腐蚀能力高于碱性条件,具体表现在中性条件下铜片表面腐蚀区域更严重范围更广。从图4可以看到中性溶液的腐蚀表面有较多的点、线,表面腐蚀严重,开合环状的腐蚀痕迹无规律的分布在铜的表面,腐蚀形貌更加明显,同时在腐蚀区域会观察到铜表面会产生其他颜色腐蚀物。
2.2 XRD分析
将铜片浸泡在不同酸碱度亚硫酸二甲酯水解溶液中15 d和20 d,得出XRD图谱见图5和图6。
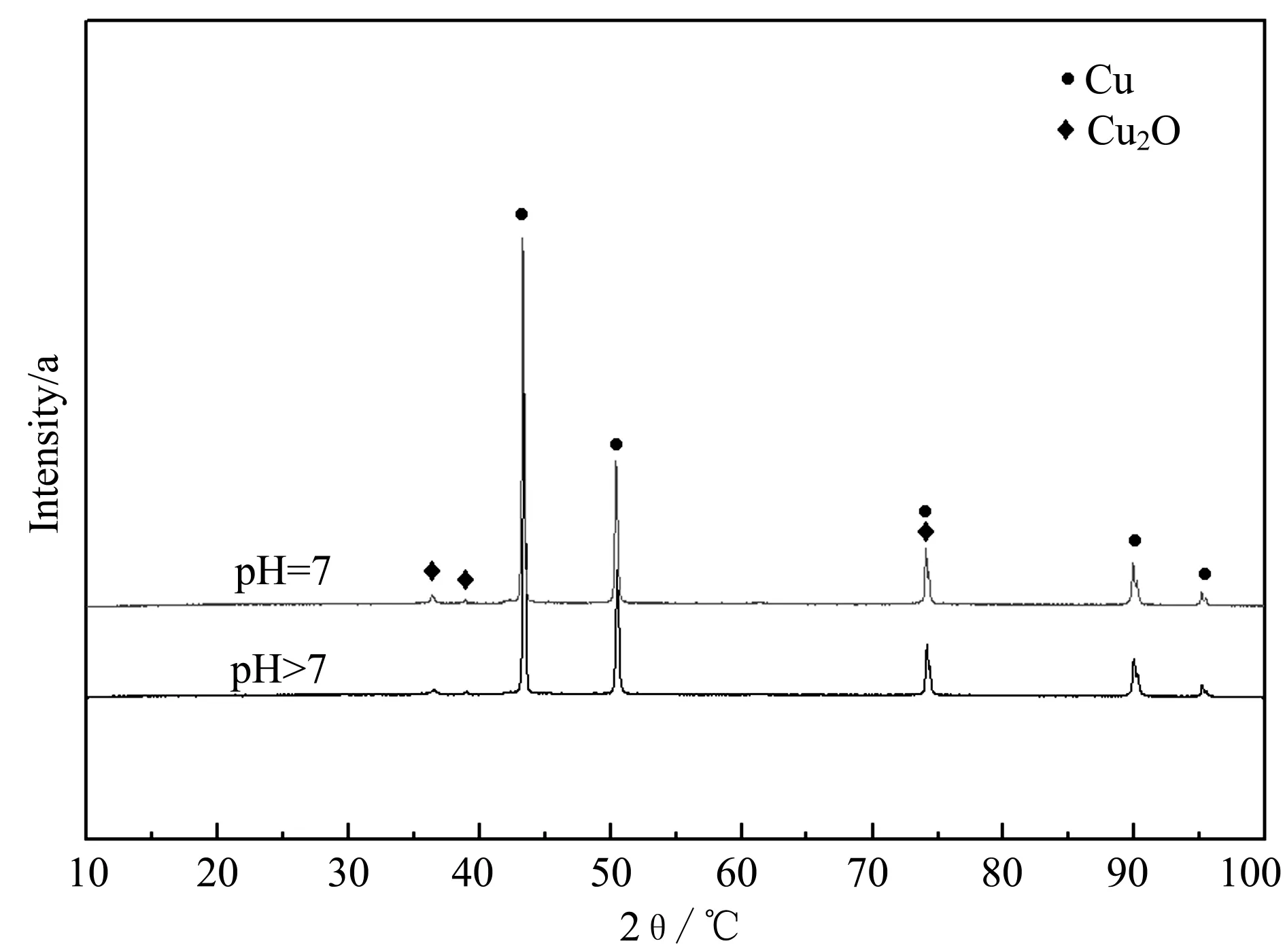
图5 铜在水解溶液(碱性+中性)浸泡15 d后的XRD图谱
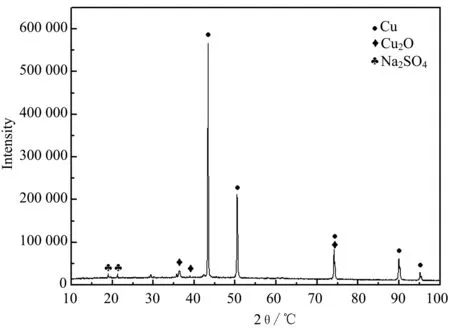
图6 铜在水解溶液中浸泡20 d后XRD图谱
通过图5可以看出,铜在碱性和中性的亚硫酸二甲酯水解溶液中的产物无明显差异,均以Cu2O为主,而从图6可以看出,铜在浸泡20 d后,除了铜和氧化亚铜外,在溶液中还检测到了Na2SO4。根据试验过程,可以推测:水解溶液中硫的存在形式为亚硫酸根,但是亚硫酸根不稳定,易被水中O2氧化,进而进一步形成了稳定的硫酸根,发生的化学反应如下所示:
2.3 SEM与EDS分析
将铜分别浸泡在碱性和中性亚硫酸二甲酯水解溶液中15 d后,得出SEM图(见图7、图8)和EDS图(见图9、图10及图11)。

图7 铜在碱性水解溶液中浸泡后的SEM图
通过图7可以观察到铜表面除了有几处明显的腐蚀坑外,其余部分主要以点蚀坑为主,而且在点蚀坑周围可以看到许多浅色的颗粒状腐蚀产物。为能准确的了解腐蚀区域的腐蚀产物,利用EDS能谱仪分析腐蚀微区的成分,分别选取如下3点:点蚀坑内;腐蚀产物颗粒的周围;腐蚀坑内。背散射电子扫描结果见图8。

图8 铜在碱性水解溶液中浸泡后的EDS图

编号CuOSi区域169.4319.3411.22区域272.1817.6510.17区域354.9126.0319.06
根据表3所示,3处区域的元素组成,除了铜元素外,都以氧元素居多,这表明腐蚀产物以铜的氧化物为主,而三处的Si主要来自于试验中所用到的玻璃器皿中的SiO2。除去SiO2中的氧元素,点3处氧元素最多,点1处其次,点2处最少,这表明铜的氧化物主要分布在铜表面未被腐蚀处。

图9 铜在中性水解溶液浸泡15 d后的SEM图
从图9可以观察到,铜在中性水解溶液中浸泡15 d后,相比在碱性溶液中铜在中性条件下表面腐蚀范围更广,区域内出现大面积的腐蚀。具体表现形式为:铜表面不仅存有腐蚀坑洞外,还出现了裂缝腐蚀,严重破坏了铜的表面。为进一步研究腐蚀区域的腐蚀与S元素是否有关,试验中分别对腐蚀区域进行EDS能谱分析如图10所示,得出表4。

图10 铜在中性溶液中腐蚀表面1

编号CuOS区域188.359.522.13区域290.957.511.55
根据图10、表4可以明显看出:铜在中性溶液中的腐蚀发现了硫元素,且1处腐蚀区域比2处表面含量多,同时腐蚀区域氧含量也比表面多,1处的腐蚀率达到了11.65%,比2处高出2.59%,可以得出结论S元素的增加加速了铜的腐蚀。
为论述试验结果,本文进一步选取了不同的腐蚀区域和未腐蚀区域进行EDS能谱分析如图11所示,得出表5,结果如下。

图11 铜在中性溶液中腐蚀表面2
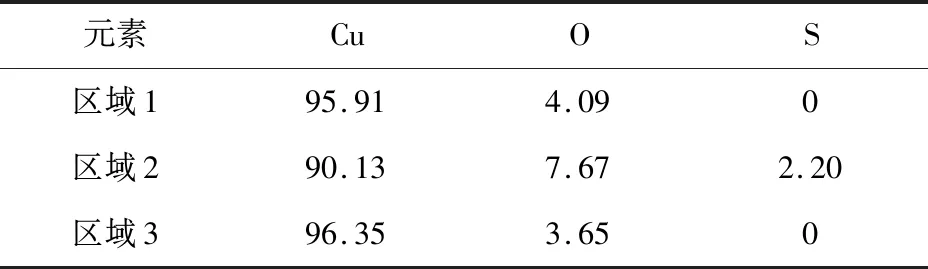
元素CuOS区域195.914.090区域290.137.672.20区域396.353.650
从图11可以看出图中腐蚀区域2处要比1处腐蚀面积大将近一倍。而根据表5中的数据来看,在2处的腐蚀区域腐蚀率达到了9.87%,分别比腐蚀区域1处和未腐蚀区域3处腐蚀率高出5.78%和6.22%。而且只在2处发现了S元素且氧含量比1处和3处都多,说明S元素的存在确实加快了2处的腐蚀。
3 结 论
1)亚硫酸二甲酯在碱性条件下水解的产物是亚硫酸盐和甲醇,铜在亚硫酸二甲酯水解的腐蚀产物是Cu2O,与水解溶液的酸碱性无关。
2)铜在碱性水解溶液中的腐蚀以点蚀和局部腐蚀为主,且与S元素无关,腐蚀产物主要分布在未被腐蚀的表面处;铜在中性水解溶液中腐蚀以裂缝腐蚀为主,腐蚀面积大,且S元素加快腐蚀率。
3)随着的碱性的增加,铜的耐蚀性性能降低,腐蚀速率加快,在中性溶液中的腐蚀速率最快,腐蚀率可达到了11.65%,且铜的耐蚀性能随着浸泡时间增长有所提高。

