淹水胁迫下外源激素对甜瓜幼苗根系生理特性的影响
刘达潍 刘诗琴 易鹏程 银辉 谢波 刘泽发

摘要:以甜瓜高代自交系M10-03为材料,在2叶1心期对甜瓜苗模拟淹水处理,在外源激素IAA、GA、ABA、NPA、PP333、STD诱导下对甜瓜不定根生理特性的影响进行分析。结果表明,随激素处理浓度升高,幼苗不定根数经IAA处理后先降后升,在浓度为1.0 ng/L时达到峰值;GA处理甜瓜幼苗不定根的生根数和发生区域均大于CK,且呈下降趋势,NPA对不定根发生区域的影响不大;PP333处理甜瓜幼苗不定根生根数及发生区域先升高后降低,在浓度为100 mg/L时达到峰值;ABA处理后甜瓜幼苗不定根数先降后升,在25 ng/L时为低值;STD处理呈先升后降趋势,在 25 ng/L 处达到峰值,不定根发生区域长度为对照的1.85倍。激素及激素抑制剂均能增强甜瓜幼苗根系活力,IAA和STD处理甜瓜幼苗根系活力均升高;施加GA和PP333时,甜瓜幼苗根系活力先升后降,在浓度100 mg/L时达到峰值。甜瓜幼苗真叶叶绿素a、叶绿素b的含量均呈下降趋势,PP333(100 mg/L)及STD(25 ng/L)处理甜瓜幼苗真叶叶绿素a和叶绿素b含量最低;ABA处理对叶绿素影响不明显。甜瓜幼苗真叶类胡萝卜素含量经IAA处理后升高,NPA、PP333、ABA、STD处理后先高后低,GA处理后呈降低趋势。
关键词:甜瓜;外源激素;不定根;淹水胁迫;生理指标;形态指标
中图分类号: Q945.78;S652.01文献标志码: A
文章编号:1002-1302(2019)09-0182-04
涝害是世界上许多国家的重大自然灾害,水灾是造成损失最严重的自然灾害,占所有灾害损失的40%,世界上16%的肥沃土地遭受涝渍危害。我國是一个涝害比较严重的国家,据统计,我国涝渍性土地面积约66万km2,占国土陆地面积的6.6%,居世界第4位。这些涝渍土地主要分布于黄淮平原和长江中下游地区,占全国受灾面积3/4以上。减少涝渍损失是涝渍危害严重地区农业生产需要重点考虑的问题之一[1-2]。甜瓜(Cucumis melon L.)为葫芦科(Cucurbitaceae)黄瓜属(Cucumis)具有重要经济价值的蔬菜作物,在国内外广泛栽培,中国是世界上甜瓜栽培面积最大的国家,包括黄淮平原和长江中下游在内的东部多雨湿润的大片季风气候区是重要的甜瓜生产区,该区春季常阴雨连绵、夏季多暴雨,洪涝灾害频繁发生,在苗期会影响甜瓜植株的生长,在坐果期会影响正常开花坐果,导致甜瓜产量降低,雨涝成为影响该区甜瓜生产的重要因子。因此提高甜瓜应对淹水胁迫的能力对于甜瓜生产具有重要意义。
涝渍胁迫是植物主要的非生物胁迫之一,一般会限制植物正常生长,严重时候导致植物死亡,主要的影响是减少了土壤中的气体交换,也是低氧胁迫。不同植物应对淹水胁迫响应不同,具有基因型差异,水稻是比较耐涝的作物。在旱地作物中,不同作物及作物的不同品种表现出耐涝差异性,如已有研究表明大豆、花生、辣椒的不同品种耐涝能力差异明显[3-5]。另外,植物不定根发生形态一般与耐涝能力有关,一般在近水面或形态学下端的受伤部位残生,常具有较多通气组织,有利于快速吸收和运输O2,提供给受淹或者受伤部位[6-8]。植物激素如生长素(auxin,IAA)、乙烯(ethylene,ETH)、细胞分裂素(cytokinin,CTK)、赤霉素(gibberellin,GA)、脱落酸(abscisic acid,ABA)等[9-13]导致植物一系列的反应,这些反应包括偏上性或偏下性生长、茎伸长、通气组织形成和不定根形成等,通过这些适应性反应,植物能避开缺氧环境或者改善淹水组织的氧气供给状况。已有的对淹水胁迫相关研究主要集中在水稻、花生、辣椒、玉米、芝麻和蓼科等植物上,对甜瓜等瓜类作物研究应用较少,为此,本试验以甜瓜高代自交系M10-3为试验材料,研究不同外源激素处理在淹水条件下对甜瓜幼苗根系生理和耐涝特性的影响,为育种及生产应用提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为厚皮甜瓜与薄皮甜瓜种间杂交后代选出的耐涝自交系M10-3,由湖南人文科技学院园艺教研室提供。挑选种粒饱满的M10-3种子500颗放在纱网袋中,置于28 ℃清水中浸泡4 h后甩干并将装有种子的纱网袋平放在经高温消毒的湿润毛巾上,塑料膜装好放入25 ℃恒温培养箱中培养24 h,待种子萌芽约1 cm时,播种到装有基质(珍珠岩 ∶蛭石=1 ∶1)的6.5 cm×6.5 cm(口径×高度)底部有排水孔营养钵中,待真叶长出2叶1心时作为试验材料备用。
试验于2017年3月至2018年6月在湖南人文科技学院校内科研基地及农业与生物技术学院实验室进行。
1.2 试验设计
采用套杯模拟淹水(将2叶1心甜瓜苗营养钵套入塑料杯中)进行淹水试验处理,塑料杯为8.2 cm×7.2 cm×4.6 cm(杯高×杯口直径×杯底直径),每个塑料杯中放1株。在塑料杯中注入清水,使水面高于育苗钵1 cm,标记好水面高度,定时补充清水以保持水位一致。
试验采用随机区组设计,每种激素与激素抑制剂各设置3个浓度处理,每个处理20株,处理设置4个重复,以清水为对照,NPA(1-N-naphthylphthalamic acid)为IAA抑制剂,PP333(Paclobutrazol)为GA抑制剂,STD(Sodium Tungstate Dehydrate)为ABA抑制剂。各试剂处理浓度为:IAA(0.01、1.0、100 ng/L),NPA(0.01、1.0、100 ng/L),GA(50、100、200 mg/L),PP333(50、100、200 mg/L),ABA(2.5、25、250 ng/L),STD(2.5、25、250 ng/L),清水为对照(CK)。
每隔24 h喷洒真叶1次,每次定量喷洒3 mL,处理7 d后统计数据。利用累积计数方法测不定根,对主根上不定根发生区域进行测量,量取从形态学上端到下端发生不定根的区间长度,单位为cm。
1.3 测定项目与方法
于处理后第7天进行取样,每次随机取样5株,将带有基质土的幼苗轻轻取出,用水冲洗栽培基质后将地上部与根系从茎基部分开,用于进行形态指标测量与生理指标测定。
1.3.1 形态指标 清水漂洗后,用分离器将不定根分离开,擦拭干后摊平,以每个幼苗个体不定根的数量为指标,观察统计不定根的发生数;在显微镜下观察并测定主根周围1 cm区域以及侧根周围1 cm区域的不定根生根情况;株高、最长根长用刻度直尺测量;地上部与地下部干质量用烘干称质量法测定。
1.3.2 生理指标 根系活力测定采用TTC法,常温提取TF并在485 nm处测定吸光值[14],建立标准曲线;光合色素含量的测定方法采用80%丙酮浸提法[15-16]。
1.4 数据处理
试验数据采用Excel 2007软件进行处理,结果取平均 值±标准差,统计分析采用SPSS 17.0软件,进行Duncans新复极差法进行多重比较。
2 结果和分析
2.1 施用外源激素对甜瓜幼苗不定根生根数及不定根发生区域的影响
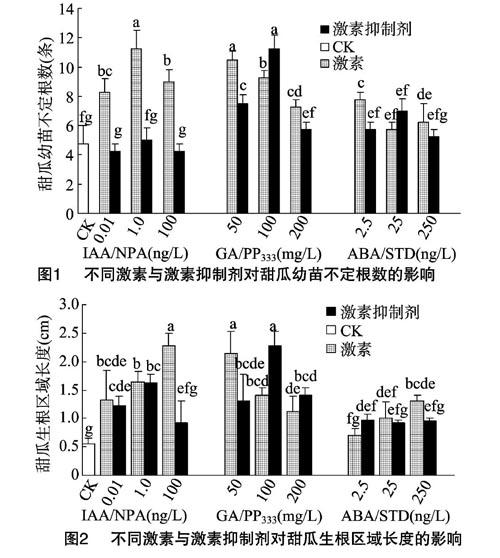
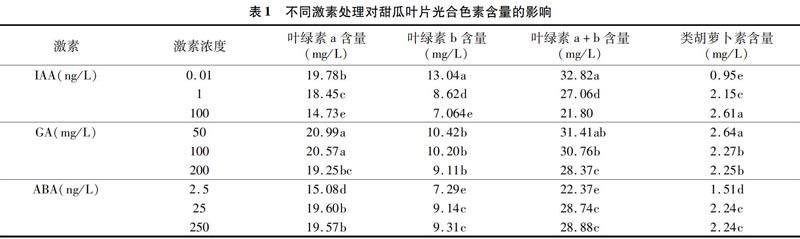
甜瓜幼苗淹水环境下用不同激素与激素抑制剂喷雾处理,对甜瓜不定根生根数及不定根发生区域的影响如图1、图2所示。由图1可见,外源施加IAA,随着施加浓度的加大,对不定根先促进后抑制,并在浓度为1.0 ng/L时达到峰值,与CK相比,其总体表现为促进。而在使用NPA进行处理时,甜瓜幼苗不定根数目未发生显著变化。由图2可见,外源施加IAA,不定根发生区长度随浓度升高而增加,NPA对不定根发生区长度的影响是先高后低,在浓度为1.0 ng/L时达到峰值,100 ng/L时与CK差异不显著。由图1、图2可见,不同浓度GA处理甜瓜不定根的生根数和发生区域均大于CK,且在P<0.05水平上差异显著,但随浓度的升高,生根数和发生区长度均呈下降趋势;PP333生根数及發生区长度随浓度的升高呈先升后降的趋势,并在浓度为100 mg/L时,不定根生根数和不定根发生区长度达到峰值。由图1可见,不定根发生过程中ABA激素处理下,甜瓜幼苗下胚轴基部不定根数呈先减后增的趋势,在25 ng/L达到最低值,抑制剂STD和ABA趋势相反,在25 ng/L处达到峰值。由图2可见,甜瓜幼苗在ABA激素处理后随浓度增加后不定根发生区域长度显著增加,最高浓度的区域长度为对照区不定根发生区域长度的1.85倍,STD处理生根的区域长度均大于CK,随浓度升高生根区域长度差异不显著。
由上述可知,外源施加IAA对甜瓜幼苗不定根数及不定根发生区域均有显著促进效应,表明了外源施加IAA能促进甜瓜幼苗不定根的发生。外源施加NPA对甜瓜幼苗不定根数无明显影响,对不定根发生区域有一定的促进效应,表明外源施加NPA对不定根发生区域有促进效应。GA在不定根形成过程中对生根数和发生区域均起抑制作用,PP333在浓度为100 mg/L时促进效果最显著。STD和ABA在促进不定根发生数以及发生区域方面有显著的促进作用,并且ABA在促进不定根发生区域方面作用更加显著。
2.2 外源激素对甜瓜幼苗根系活力的影响
根是植物的主要吸收器官,根的生长状况和活力水平与植物的生长、营养、产量息息相关。根系活力可以直观表现出植物根系的状态。在研究外源激素及激素抑制剂对甜瓜幼苗根系的影响时,根系活力可作为一个重要的综合指标。
由图3可见,在外源施加IAA和STD时,甜瓜幼苗根系活力均表现为随激素浓度升高而增加;施加GA和PP333时,甜瓜幼苗根系活力均表现出先促进后抑制,在浓度100 mg/L时达到峰值;外源施加ABA,甜瓜幼苗根系活力随激素浓度升高而增加,在使用STD进行处理时,其效应与ABA相同,且在低浓度时促进效应强于ABA,与CK相比,均表现为促进。
由上述可知,3种激素及激素抑制剂均能增强甜瓜幼苗根系活力,表明在合理控制浓度的情况下,外源施加激素及激素抑制剂都能有效增强甜瓜幼苗的根系活力。
2.3 外源激素处理对甜瓜幼苗光合色素的影响
2.3.1 外源激素处理对甜瓜幼苗叶片叶绿素a和叶绿素b含量的影响 由表1可见,不同激素处理下各个甜瓜幼苗真叶光合色素含量均存在显著差异,试验组中叶绿素a含量均大于叶绿素b含量,叶绿素a在甜瓜幼苗光合作用中起主导作用。IAA、NPA、GA激素处理甜瓜幼苗,随处理浓度的增加,叶绿素a和叶绿素b的含量均呈下降趋势。由表2可见,激素抑制剂PP333、STD在中间处理浓度(PP333=100 mg/L,STD=25 ng/L)时,叶绿素a和叶绿素b含量最低。
2.3.2 外源激素处理对甜瓜幼苗叶片类胡萝卜素的影响 由表1、表2可见,在IAA处理下,类胡萝卜素含量随施加浓度的升高而上升,在IAA处理最高浓度(100 ng/L)下,类胡萝卜素含量为最低浓度IAA(0.01 ng/L)处理时的2.75倍,表明IAA显著促进了甜瓜幼苗类胡萝卜素的合成。经NPA、PP333、ABA、STD等4种激素及激素抑制剂处理,其类胡萝卜素含量均呈先升高后降低的趋势,表明1.0 ng/L NPA、25 mg/L PP333、25 ng/L ABA和25 ng/L STD处理对类胡萝卜素的合成有促进作用;类胡萝卜素随GA处理浓度升高含量降低,合成受到抑制。
3 讨论
生长素(IAA)、乙烯(ETH)、细胞分裂素(CTK)、赤霉素(GA)、脱落酸(ABA)等激素能够对不定根的发生产生影响,生长素被证实可与其他内源因子或环境刺激互作,在不定根发育过程中扮演核心角色[17]。生长素在不定根发生中所起的关键作用在实践中有很多应用, 如在植物再生培养或扦插育苗中,施一定浓度的生长素可调控根系的发生。烟草不定根突变体rac的外植体对NAA不敏感,不能形成不定根,说明不定根形成与生长素有很大的关系。水稻CRL/ARL1和CRL4/GNOM1的突变体分别与生长素的信号和转运相关,导致不定根原基起始阶段产生缺失[18-20]。水稻WOX11的突变导致不定根原基大大减少,该突变体参与生长素和细胞分裂素信号,并且在不定根发育过程中调控RR2基因的表达[21]。生长素信号因子(ARF17)负调控拟南芥不定根形成,过量表达ARF17的拟南芥的不定根数目明显比野生型少。Gutierrez等研究了拟南芥microRNA对不定根的影响,发现miR160负调控靶基因ARF17,miR167正调控靶基因ARF6和ARF8,从而影响不定根发生表型[22],张丹凤在玉米中也进行了类似的研究[23]。本试验表明外源施加IAA对甜瓜不定根数的影响表现为先促进后抑制,并在浓度为 1.0 ng/L 时达到峰值,这进一步证明了生长素与甜瓜不定根的形成密切相关,生长素可以调控甜瓜不定根的发生。
参考文献:
[1]雷加富. 中国林业资源报告[M]. 北京:中国林业出版社,1996.
[2]谈广鸣,胡铁松. 变化环境下的涝渍灾害研究进展[J]. 武汉大学学报(工学版),2009,42(5):565-571.
[3]王彩洁. 黄淮海地区主栽大豆品种耐涝性比较[J]. 农家顾问,2016(8):24.
[4]禹华芳,李益得,刘高永,等. 苗期水涝胁迫对不同花生品种生长性状及产量的影响[J]. 分子植物育种,2016(1):233-238.
[5]郑佳秋,郭 军,梅 燚,等. 辣椒幼苗形态及生理特性對涝害胁迫的响应[J]. 西南农业学报,2016,29(3):536-540.
[6]Chen H J,Qualls R G,Miller G C. Adaptive responses of Lepidium latifolium to soil flooding:biomass allocation,adventitious rooting,aerenchyma formation and ethylene production[J]. Environmental and Experimental Botany,2002,48(2):119-128.
[7]Shimamura S,Yoshida S,Mochizuki T. Cortical aerenchym formation in hypocotyl and adventitious roots of Luffa cylindrical subjected to soil flooding[J]. Annals of Botany,2007,100(7):1431-1439.
[8]王文泉,郑永战,梅鸿献,等. 不同耐渍基因型芝麻在厌氧胁迫下根系的生理与结构变化[J]. 植物遗传资源学报,2003,4(3):214-219.
[9]Li S W,Xue L,Xu S J,et al. Hydrogen peroxide acts as a signal molecule in the adventitious root formation of mung bean seedlings[J]. Environmental and Experimental Botany,2009,65(1):63-71.
[10]Steffens B,Wang J,Sauter M. Interactions between ethylene,gibberellin and abscisic acid regulate emergence and growth rate of adventitious Roots in deep-water rice[J]. Planta,2006,223(3):604-612.
[11]Jackson M B,Saker L R,Crisp C M,et al. Ionic and pH signaling from roots to shoots of flooded tomato plants in relation to stomatal closure[J]. Plant and Soil,2003,253(1):103-113.
[12]Visser E J W,Voesenek L A C J. Acclimation to soil flooding-sensing and signal-transduction[J]. Plant and Soil,2005,254(1/2):197-214.
[13]Sairam R K,Kumutha D,Ezhilmathi K,et al. Physiology and biochemistry of waterlogging tolerance in plants[J]. Biologia Plantarum,2008,52(3):401-412.
[14]张志勇,卜晶晶,王素芳,等. 冠菌素对不同钾水平下TTC法测定的棉花根系活力的影响[J]. 植物生理学报,2015,51(5):695-701.
[15]明 华,胡春胜,张玉铭,等. 浸提法测定玉米叶绿素含量的改进[J]. 玉米科学,2007(4):93-95,99.
[16]张立军,樊金娟. 植物生理学实验教程[M]. 北京:中国农业大学出版社,2007:94-96.
[17]Pagnussat G C,Lanteri M L,Lamattina L. Nitric oxide and cyclic GMP are messengers in the indole acetic acid-induced adventitious rooting process[J]. Plant Physiology,2003,132:1241-1248.
[18]Liu H,Wang S,Yu X,et al. ARL1,a LOB-domain protein required for adventitious root formation in rice[J]. The Plant Journal,2005,43(1):47-56.
[19]Kitomiy Y,Ogawa A,Kitanoh I,et al. CRL4 regulates crown root formation through auxin transport in rice[J]. Plant Root,2008,2:19-28.
[20]Liu S P,Wang J R,Wang L,et al. Adventitious root formation in rice requires OsGNOM1 and is mediated by the OsPINs family[J]. Cell Research,2009,19(9):1110-1119.
[21]Zhao Y,Hu Y F,Dai M Q,et al. The WUSCHEL-Related homeobox gene WOX11 is required to activate Shoot-Borne crown root development in rice[J]. The Plant Cell,2009,21(3):736-748.
[22]Gutierrez L,Bussell J D,Pacurar D I,et al. Phenotypic plasticity of adventitious rooting in Arabidopsis is controlled by complex regulation of AUXIN RESPONSE FACTOR transcripts and MicroRNA abundance[J]. Plant Cell,2009,21(10):3119-3132.
[23]张丹凤. 淹水胁迫下microRNA介导的玉米不定根生长及抗氧化机制研究[D]. 保定:河北农业大学,2009.

