子痫前期高危孕妇阿司匹林抵抗与基因多态性相关性
张艳红,李洁,苏婧,李增彦
子痫前期严重危害母婴健康,目前治疗效果较差,预防其发病成为主要手段。改善微循环以预防血栓发生有明确效果且已用于临床。2018年国际妊娠期高血压研究学会(ISSHP)指南及中国妊娠期高血压疾病诊治指南(2015)推荐可以在妊娠早中期给予小剂量阿司匹林以预防子痫前期[1-2]。阿司匹林作为一种抗血小板聚集药物也广泛应用于心脑血管病的一级及二级预防中。但随着对阿司匹林预防血栓疾病相关研究的深入,发现部分患者在接受规范阿司匹林治疗后,仍不能达到预期效果,此现象称为阿司匹林抵抗(aspirin resistance,AR)[3]。对于部分阿司匹林无应答患者使用其他抗血小板聚集药物如氯吡格雷可改善疗效。目前对AR的定义尚未统一,分为两种——临床抵抗和实验室抵抗[4]。临床抵抗是指阿司匹林不能按预期预防患者发生缺血性事件;实验室抵抗是指经体外血小板活性检测,阿司匹林不能有效抑制血小板聚集。流行病学研究显示AR的发生有1/3是由基因所决定的[5]。现对AR与基因多态性的最新研究进展进行综述,以期指导高危产科人群的个体化用药。
1 子痫前期的发病机制和阿司匹林的应用
子痫前期的发病机制至今尚未完全阐明,目前公认的发病机制为二阶段学说,即认为子痫前期是一种胎盘源性疾病,其发生、发展可分为两个阶段:第一阶段为病理生理变化形成过程,以滋养细胞浸润异常、螺旋动脉重铸不良和胎盘血流灌注减少为特点;第二阶段为器官受损阶段,导致各种临床征象发生。高危孕妇血液系统处于血栓前状态,滋养叶细胞缺血,从而导致滋养细胞对子宫螺旋动脉重铸障碍,胎盘循环血量减少,微循环障碍进一步加重,形成微血栓。阿司匹林作为一种抗血小板聚集药物可预防血栓的形成。研究表明,高危孕妇妊娠早期小剂量阿司匹林(60~150 mg/d)可以显著降低子痫前期、早产和胎儿生长受限的发生风险,患病率分别降至24%、14%和20%[6-7]。最近有证据表明,在经过严格筛选的高危孕妇中,阿司匹林的应用可能会降低50%早发型子痫前期的发生率[8]。2018年ISSHP指南推荐对于子痫前期高风险人群,孕16周前给予小剂量阿司匹林预防子痫前期[1]。中国妊娠期高血压疾病诊治指南(2015)推荐可以在妊娠早中期(孕12~16周)开始服用小剂量阿司匹林,可维持到孕28周以预防子痫前期[2]。然而,有研究发现阿司匹林可能并没有统一的抗血小板作用或临床效果,即AR[9]。妊娠是一种血小板代谢增强的状态,未成熟的血小板更容易激活和聚集,这为妊娠期阿司匹林反应减弱提供了可能的依据。有观察性研究表明阿司匹林无应答与不良妊娠结局之间存在直接联系[10-11]。一项回顾性观察研究将妊娠期使用阿司匹林的270例子痫前期高危孕妇分为2组,即阿司匹林+血小板功能监测(ASP+PFA)组(111例)和阿司匹林组(ASP组,159例),ASP+PFA组孕期利用PFA-100动态监测血小板功能,发现阿司匹林无应答后随时调整阿司匹林剂量,ASP组孕期不监测血小板功能,不调整剂量。结果显示ASP+PFA组和ASP组的子痫前期(15.3%vs.30.8%;aOR=0.36,95%CI:0.19~0.67)、重度子痫前期(3.6%vs.15.1%;aOR=0.22,95%CI:0.07~0.66)发生率差异有统计学意义[10]。Wójtowicz等[11]研究发现AR组的小于胎龄儿(SGA)、胎儿窘迫及子痫前期发生率均高于阿司匹林敏感组(AS组),差异有统计学意义(P分别为0.003、0.014及0.003)。因此,对阿司匹林无应答孕妇发生子痫前期、胎儿生长受限等不良妊娠结局的风险更高。近年预防血栓相关研究发现患者对阿司匹林的反应存在个体差异,心脑血管疾病中有5.5%~60%患者对阿司匹林抵抗[12]。进一步研究表明,参与编码阿司匹林作用机制过程的各种蛋白的基因发生遗传变异,均可能导致活性药物浓度差异,从而导致AR的发生[3]。
2 血小板激活聚集过程、阿司匹林作用机制及基因多态性
血小板受刺激而被激活时,其内的磷脂酶A2被激活,进而裂解血小板膜磷脂,释放花生四烯酸(arachidonic acid,AA),后者在环氧合酶(cyclooxygenase,COX)的作用下可生成前列腺素G2(prostaglandin G2,PGG2)和 PGH2,并进一步在血栓素A2(thromboxane A2,TXA2) 合成酶的作用下合成TXA2。同时激活的血小板也可脱颗粒,释放二磷酸腺苷(adenosine diphosphate,ADP)、TXA2等因子。TXA2及ADP分别与血小板表面的TXA2受体(TXA2R)及ADP受体(P2Y1和P2Y12受体)结合,暴露血小板膜糖蛋白(GP)Ⅱb/Ⅲa位点,通过纤维蛋白原的桥梁作用实现血小板聚集。
阿司匹林通过不可逆乙酰化COX活性部分的丝氨酸残基,使酶失活,抑制AA的代谢,从而减少TXA2的产生,进而抑制血小板聚集。整个代谢和作用过程中,血小板表面与阿司匹林代谢相关的ABC转运蛋白家族基因的多态性、血小板激活途径相关的COX、TXA2受体、ADP受体、GP受体基因的多态性,均可以引起碱基替换及启动子连接部位的变化,改变相关蛋白的构象及功能,影响阿司匹林的血小板抑制作用从而造成AR的发生,见图1。
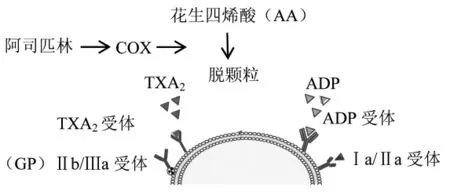
图1 血小板聚集及阿司匹林作用途径
3 AR与基因多态性
3.1 ABC转运蛋白家族基因多态性 ABC转运蛋白是与体内多种物质的跨膜转运有关的一大类ATP依赖蛋白,其中与阿司匹林代谢有关的基因主要是ABCB1。ABCB1也称多耐药基因,编码一种质子泵P糖蛋白(P glycoprotein,P-gp),其能利用 ATP 水解释放的能量将药物泵出细胞外,使细胞内的药物浓度降低而产生药物耐药。目前研究较多的是第26外显子 C3435T(rs1045642)。
王召月等[13]在中国脑卒中患者的研究中得出ABCB1基因中 1236T、G2677T/A、C3435T 3个位点所构建的单倍体(C-T-T,T-G-C,T-T-T)与缺血性脑卒中患者AR发生有关。进一步分析发现C3435T的T等位基因频率在AR组和AS组的分布差异有统计学意义(χ2=9.143,P=0.002),且 AR 组中(CT+TT)基因型频率高于AS组,差异亦有统计学意义(χ2=4.369,P=0.037)。因此 ABCB1基因位点的变异可能影响阿司匹林的吸收而产生阿司匹林耐药现象。由此推测ABC转运蛋白家族基因多态性可能与子痫前期高危孕妇阿司匹林不应答有关。
3.2 COX基因多态性 COX是合成前列腺素途径中的关键限速酶,在人体以2种形式存在,即COX-1和COX-2。阿司匹林为非选择性的COX抑制剂,对两者均有不可逆的抑制作用。
3.2.1 COX-1基因多态性 COX-1基因位于9q32~9q33.3,长度为22 kb,包含11个外显子和10个内含子,共编码576个氨基酸。阿司匹林使COX-1第530位丝氨酸残基不可逆地乙酰化从而阻断TXA2合成。COX-1基因单核苷酸多态性可引起碱基替换及启动子连接部位的变化,改变COX-1的构象及功能,从而使阿司匹林对COX-1敏感性不均一。目前报道的基因位点以A842G(rs10306114)、C50T(rs3842787)和-1676A/G(rs1330344)较多。
有研究证实rs3842788是造成中国慢性稳定型心绞痛患者AR的独立危险因素(OR=8.358,95%CI:2.470~28.286,P=0.001)[14]。然而 Yi等[15]认为 COX-1 C50T及A842G在中国人群中突变率很低,研究意义不大。最近一项针对3 995例患者的Meta分析结果表明,-1676A/G基因多态性差异无统计学意义[16]。故COX-1基因多态性可能与中国人群AR的关系不大。但其与孕妇这类特殊人群AR的相关性还有待进一步研究证实。
3.2.2 COX-2基因多态性 COX-2基因位于1q25.2~q25.3,长度为8.3 kb,包含10个外显子和9个内含子,编码604个氨基酸。COX-2为诱导型酶,生理状态下较少表达,但在多种病理因素(如炎症介质、细胞因子等)诱导下可高表达。阿司匹林使COX-2第516位丝氨酸残基不可逆地乙酰化而阻断TXA2合成。但阿司匹林对COX-2的抑制作用比COX-1弱170倍,故很少量的COX-2也能诱导血小板生成TXA2,因此COX-2的存在可能是产生AR的一个原因[3]。目前研究最多的是-765G/C(rs20417)。
一项Meta分析表明rs20417与AR有关(OR=1.86,95%CI:1.44~2.41,P<0.000 5),且在中国人中更加显著[17]。另有学者也证实在中国老年心脑血管患者中AR组COX-2(G765C)位点突变型等位基因频率明显高于AS组(P=0.039);AR组COX-2 mRNA表达明显高于AS组(P=0.029)及蛋白表达明显高于AS组(P<0.000 1),表明COX-2的表达可能是导致老年心脑血管疾病患者发生AR的遗传学危险因素之一[18]。然而有学者得出不同结论。Yi等[15]研究发现COX-2(G765C)多态性与AR无关,这与Goodman等[19]对2 834例患者的荟萃分析结果一致。研究人群种族、地域、AR定义及检测方法等的不同可能是引起各研究结果不一致的原因,故COX-2基因多态性与AR的相关性仍需要进一步大样本、分层研究证实。这提示在孕妇中研究AR与基因多态性时要充分考虑各种因素。
3.3 TXA2R基因多态性 TXA2R基因位于染色体19p13.3上,长度为15 kb,有3个内含子、3个外显子及1个附加外显子。TXA2与其特异性受体TXA2R结合,暴露GPⅡb/Ⅲa位点,最终引起血小板聚集。TXA2R基因突变可能会增强其与TXA2的亲和力,从而导致高危子痫前期患者对阿司匹林敏感性降低。
Peng等[20]发现TXA2R rs1131882 CC基因型在阿司匹林不敏感组(81.8%vs.62.4%)比AS组更常见,认为其是阿司匹林耐药的危险因素(OR=2.712,95%CI:1.080~6.810),且 AA 诱导的血小板聚集水平较高。许晶晶等[21]在2 881例冠心病患者的研究中发现 TXA2R(rs2238630、rs2238631、rs2238633、rs3786989)基因单核苷酸多态性与AR的发生无明显关系。目前这方面的临床资料较少,且在孕妇中也未见,还需进一步深入研究。
3.4 ADP受体基因多态性 ADP通过与血小板表面的G蛋白耦联受体P2Y连接而促进血小板聚集。ADP受体包括P2Y1和P2Y12两种,两种受体基因均位于3号染色体上。P2Y1基因跨度为4 kb,包括1个外显子。P2Y12基因长约47 kb,包括3个外显子和2 个内含子。P2Y12(i-C139T,rs10935838;i-T744C,rs2046934;i-ins801A,rs5853517;G52T,rs6809699)4种基因多态性为完全连锁不平衡,组成H1和H2两种单倍型。
张文婷等[22]对206例中国汉族首发大动脉粥样硬化性卒中(LAA)患者的研究发现,携带P2Y1 rs701265 G等位基因是LAA患者AR的独立危险因素(OR=2.186,95%CI:1.190~4.016,P=0.012)。一项研究发现冠心病患者P2RY12基因中H2单倍体与阿司匹林耐药性有关(共优势模型:OR=3.75,95%CI为 0.14~99.88,P=0.05;优势模型:OR=2.78,95%CI为 0.11~70.93,P=0.05),且 H2 单倍体突变在冠心病组与健康对照组间差异有统计学意义(χ2=30.3,P<0.05)[23]。由此推测ADP受体基因多态性可能与孕妇AR有关,但尚待进一步研究证实。
3.5 GP受体基因多态性 血小板膜表面包含多种与血小板黏附、激活、聚集有关的GP受体。GPⅡb/Ⅲa通过纤维蛋白原的桥梁作用最终使血小板聚集,其基因多态性位点主要集中在GPⅢa rs5918,包括2种等位基因——PLA1和PLA2,即当GPⅢa基因第2个外显子核苷酸第1 565位胸腺嘧啶被胞嘧啶所取代时,翻译成蛋白质的第33位亮氨酸(Leu)变成脯氨酸(Pro),Leu和Pro的等位基因分别是PLA1和 PLA2。
Floyd等[24]一项纳入11 873例患者的荟萃分析显示,携带PLA2等位基因与成人卒中的发生显著相关(OR=1.12,95%CI:1.03~1.22,P=0.011)。与野生型PLA1的纯合个体相比,PLA2等位基因的纯合个体与缺血性卒中的相关性最强(OR=1.74,95%CI:1.34~2.26,P=0.001)。Floyd 等[25]的另一项纳入 57 项研究包括17 911例患者和24 584例对照的Meta分析表明,PLA2等位基因的携带与心肌梗死显著相关(OR=1.077,95%CI:1.024~1.132,P=0.004),且 PLA2等位基因与心肌梗死的关联程度随受试者年龄的降低而增加(≤45 岁,OR=1.205,95%CI:1.067~1.360,P=0.003)。然而在对1 650例PLA1纯合个体和668例PLA2等位基因携带者进行Meta分析,发现PLA2等位基因携带者对阿司匹林的耐药性OR值为 0.862(95%CI:0.685~1.086,P=0.208)。亚组分析显示,无论是健康的受试者还是心血管疾病患者,PLA2等位基因与AR都无关[26]。故推测可能由于临床AR与实验室AR存在不一致性,导致研究结果存在争议。这提示在孕妇中研究AR与基因多态性时要考虑临床AR及实验室AR不一致的问题。
3.6 基因间交互作用 一项包括426例中国急性缺血性小卒中患者的研究发现,P2Y12(rs16863323)和GPⅢa(rs2317676)基因多态性之间存在交互作用,并且是AR和不良事件(小卒中、心肌梗死、死亡)的独立危险因素[27]。另一项针对850例中国急性缺血性脑卒中患者的研究发现,rs1371097 TT/CT、rs20417 CC和rs2317676 GG/AG这3个基因位点不同基因型之间的交互作用与AR存在相关性(P<0.05)[28]。故基因间交互作用也可能是人群对阿司匹林反应差异性的原因,同样在子痫前期高危孕妇中也适用。
4 结语
综上所述,子痫前期高危孕妇使用低剂量阿司匹林可以预防子痫前期、早产及胎儿生长受限的发生。但患者对阿司匹林的反应性存在个体差异。低反应患者发生胎盘血管收缩、胎盘灌注减少、微血栓形成的风险更高。阿司匹林药物代谢及作用过程中相关的基因多态性与个体对阿司匹林的反应有关,基因检测可能为预防性治疗子痫前期的抗血小板聚集药物的选择提供新的依据,即对于阿司匹林无应答患者使用其他抗血小板聚集药物如氯吡格雷等,给妊娠期高血压的治疗带来新的突破,达到个体化的精准医疗。

