黄酮抗金黄色葡萄球菌感染靶点SrtA的活性研究
林 锐
(江苏医药职业学院,江苏盐城 224000)
1 前言
金黄色葡萄球菌(Staphylococcus aureus),也称“金葡菌”,是常见的革兰氏阳性菌,具有较强的致病力,可引起多种严重感染。最常见的金黄色葡萄球菌引发的感染是局部化脓感染,也可引起肺炎、伪膜性肠炎、心脏内膜炎等,甚至败血症、脓毒症等全身感染。流行病学资料显示,革兰氏阳性菌感染中金黄色葡萄球菌发病率位居首位,是烧伤创面感染、急性肝功能衰竭等疾病的重要病原菌。
感染金黄色葡萄球菌,通常可选用红霉素、新型青霉素、庆大霉素、万古霉素或先锋霉素Ⅵ治疗,但由于抗生素的滥用,出现多种耐受抗生素的新菌株。1961年临床上首次分离出耐甲氧西林金黄色葡萄球菌(mythically-resistant staphylococcus aureus,MRSA),该菌对所有内酰胺类抗生素耐药,并对大环内酯类、氨基糖苷类、氟喹诺酮类等抗菌药物多数耐药,可以抵抗强力的抗生素和药物,并能够引起各种感染,因此也被称为“超级细菌”(Superbug)。细菌的耐药问题使得可用的药物也越来越少,对于高耐药和多药耐药的MRSA,万古霉素、替考拉宁或利奈唑胺成为最后的救命药物。但其他国家已报道有耐万古霉素金黄色葡萄球菌(vancomycin-resistant staphylococcus aureus,VRSA) 检出,利奈唑胺耐药的菌株亦有报道。
面对严峻的抗菌药物用药形势,如何减少耐药菌株的生成和研制新的抗菌药物已是医药领域的热点议题。在寻找新型结构的药物替代现有抗生素的过程中,研究者会考虑几方面的问题。一方面,随着传统的微生物来源的抗生素或其衍生物逐渐失效,植物来源以及天然产物来源的抗生素不失为更好的选择。另一方面,病原菌对抗生素产生耐药机制促使我们需要发掘抗生素杀灭或抑制病原菌的新靶标,去避免新的药物在短时间临床使用中也造成耐药性的情况。
革兰氏阳性菌的表面蛋白与其致病性密切相关,其表面蛋白是在细胞质中合成,通过Sortase的转肽作用进而锚定到菌体细胞壁肽聚糖上[6]。Comfort,Dramsi等对892种表面蛋白的分选信号进行了分析,根据Sortase所识别的分选信号的不同,将Sortase分为A、B、C、D共4类,分别以SrtA,SrtB,SrtC,SrtD加以表示。SrtA识别LPXTG 基序,主要介导与黏附相关的表面蛋白的锚定,是最典型的家族蛋白。
SrtA是一种膜结合巯基转肽酶,由206个氨基酸组成,它的N端部份是一个跨膜区,C端部份则是一个催化区域。SrtA能识别表面蛋白C端所含的保守氨基酸序LPXTG(X指任意的氨基酸),并裂解苏氨酸(T)和甘氨酸(G)间的肽键,产生一个苏氨酸的羰基末端,与细胞壁的五个甘氨酸交联桥的氨基形成酰胺键,从而使表面蛋白被锚定到细胞壁的肽聚糖上。
在金黄色葡萄球菌中,SrtA 将金黄色葡萄球菌的表面蛋白锚定到细胞壁上,进而促进金黄色葡萄球菌对宿主细胞的黏附和定殖,促进对宿主可溶性细胞外基质的黏附,产生致病作用和逃避宿主免疫防御的能力。如果能够阻断SrtA的锚定过程,致病菌就无法表现出强烈的致病性,且易被机体免疫系统所识别。一项对多种革兰氏阳性菌进行SrtA基因敲除实验发现,SrtA的缺乏会使病原菌无法正常将表面蛋白锚定到细胞壁上,从而很大程度降低了病原菌的致病性。因此,SrtA被视为抗金黄色葡萄球菌感染治疗中极值得尝试的抗毒力靶点。近年来,对于SrtA抑制剂的筛选也正成为抗菌药物研发中的热点。
2 材料和方法
2.1 Sortase A 活性测试
所有化合物的抑制活性通过使用Sensolyte®520 Sortase A试剂盒,测定5-FAM/QXL®FRET底物荧光强度来确定。反应在96孔板中进行,每个孔包含10L试验化合物溶液、40L酶溶液和50L Sortase底物溶液。所有化合物溶解在二甲基亚砜(DMSO)中,并用灭菌蒸馏水稀释。DMSO的最终浓度为1%。每种化合物在缓冲液中稀释至试验浓度,并检查其固有荧光。我们使用不含试验化合物的酶作为对照,使用1%二甲基亚砜对照和底物对照。以试剂盒抑制剂4-羟基汞苯甲酸(hmb)为阳性对照。反应在室温下进行1h,并在ex/em=490nm/520nm下进行荧光分析(spectramax gemini xs,ca,usa)。报告数据为三次实验的均值。
2.2 酶的结构的获取
金黄色葡萄球菌Srt A的三维结构文件是从RCSB PDB数据库下载的。水分子被去除,酸性电荷分配给蛋白。配体的化学结构从pubchem数据库中检索得到。使用MarvinSketch 16.11.21(ChemAxon Ltd.,Budapest,Hungary)进行优化。选择化合物:白杨素,大黄素,金雀异黄素,杨梅素,柚皮苷,槲皮素,奎尼酸,大黄酸,芦丁。
2.3 蛋白质-配体相互作用预测
分子对接是使用AutoDock Tools 1.5.6图形用户界面进行的,该界面运行AutoDock VINA 1.1.2软件(Scripps Research Institute,San Diego,CA,USA)。AutoDock VINA是一个对接平台,比以前的对接软件AutoDock 4[14]更快、更精确。这个新的版本产生了蛋白质-配体复合物从最低结合自由能(DG)到最高结合自由能(DG)的九种构象(poses)。
Discovery Studio®Visualizer 2016(Accelerys Software Inc.,San Diego,CA,USA)用于蛋白质配体的三维可视化和二维图的相互作用的可视化。
此外,还使用ligplot plus v.1.4(European Bioinformatics Institute,Cambridge,UK)程序预测了参与疏水相互作用的残基数量。
2.4 抗菌活性测试
使用革兰阳性金黄色葡萄球菌ATCC 6538、金黄色葡萄球菌ATCC 25923、表皮葡萄球菌ATCC 12228,井扩散法和肉汤微量稀释法(iso 20776-1)测定MIC。试验微生物在冷冻条件下保存,并通过营养培养激活,37℃的肉汤培养24h。使用隔夜培养获得接种物,将大量细胞从肉汤转移到含有5ml脱盐水的试管中,直到达到1~2 *108菌落形成单位(CFU)/ml的浊度,相当于0.5 McFarland。在添加5%羊血的营养琼脂上培养接种物的稀释液,以验证无污染和接种物的有效性。
2.5 统计分析
使用Graphpad Prism 5.01版软件(Graphpad Software,Inc.,La Jolla,CA,USA)对Srt A的抑制作用统计分析。采用t检验(p<0.05)对重复试验结果进行分析。
计算抑制率值,并根据浓度对数绘制曲线,使用最小二乘法计算相应曲线。致死浓度(LC50)产生的L%值等于50,通过曲线插值确定。只要获得的结果允许,计算95%置信区间的上下限和相关系数(r2)。
3 结果
3.1 Srt A活性测定
根据Srt A的分子多样性和我们先前研究得出的规则,共选择了9种天然化合物作为Srt A活性的初步筛选。候选分子是小分子,具有低折叠性和至少两个氢键受体。在所检测天然化合物中,有4种化合物对Srt A有明显的抑制作用,其中2种化合物对Srt A有较好的抑制作用。
在初步筛选的基础上,用不同浓度的化合物进行抑菌活性评价。抑制活性定义为与阴性对照组相比,引起Srt A活性(IC50)降低50%的化合物浓度。结果见表1(NC:结果无法计算 NT:低浓度无法检测)。
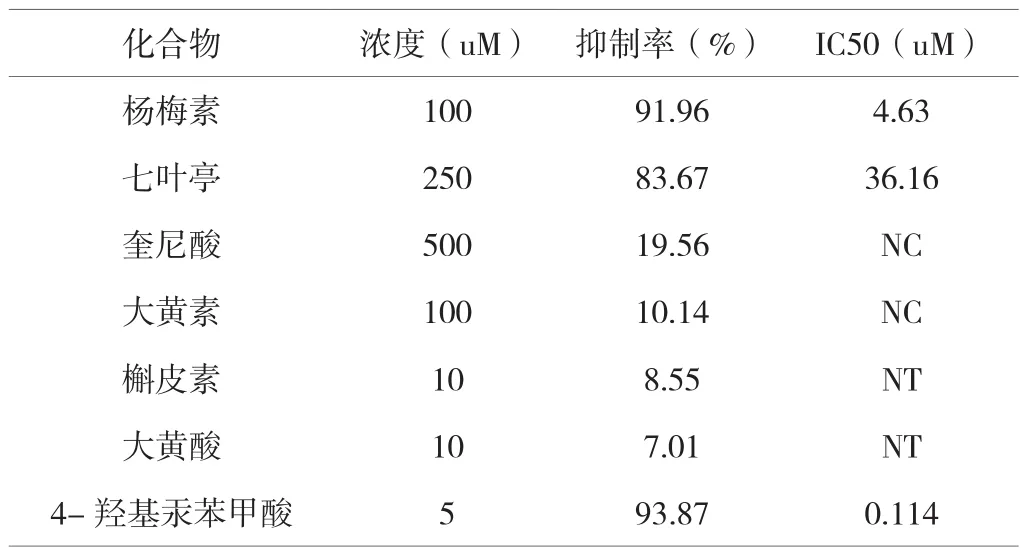
表1 对Srt A的抑制作用
从结果中可以得出杨梅素对SrtA的作用最强,其IC50比七叶亭低8倍。槲皮素和大黄酸在10μM时有很好的抑制效果,但它们在水中的溶解度较低,故无法测得高浓度时的抑制率。
3.2 蛋白配体相互作用
杨梅素具有较高的对SrtA的抑制活性和结合亲和力,这很可能是由于它能与两个极性残基GLU105,ARG197形成氢键。此外,杨梅素还能与GLY167结合。据报道,槲皮素主要通过GLY167残基的亲和产生抑制SrtA活性。杨梅素还与残基SER116、THR180通过范德华力相互作用。蛋白质-杨梅素复合物产生8个疏水残基相互作用和四种π键相互作用。此外,杨梅素的构象还能阻碍酶与其他底物之间的相互作用,从而产生抑制SrtA的活性。与其他化合物相比,杨梅素含有的两个酚羟基使其在SrtA结合位点上以更有效的方式定向。
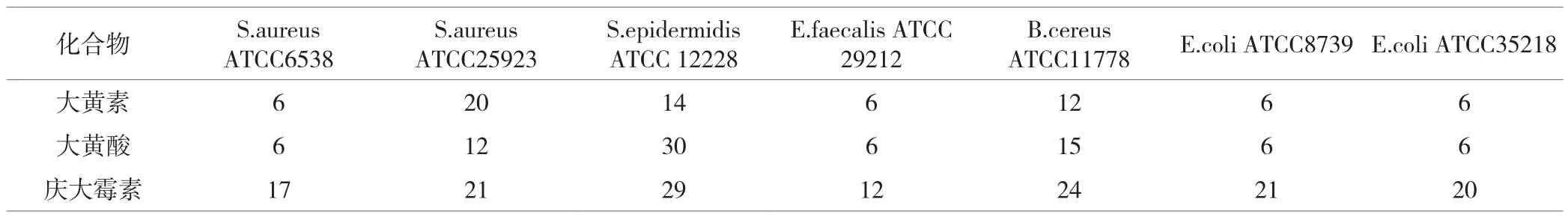
表2 扩散法测定的化合物的抑菌圈直径(mm)
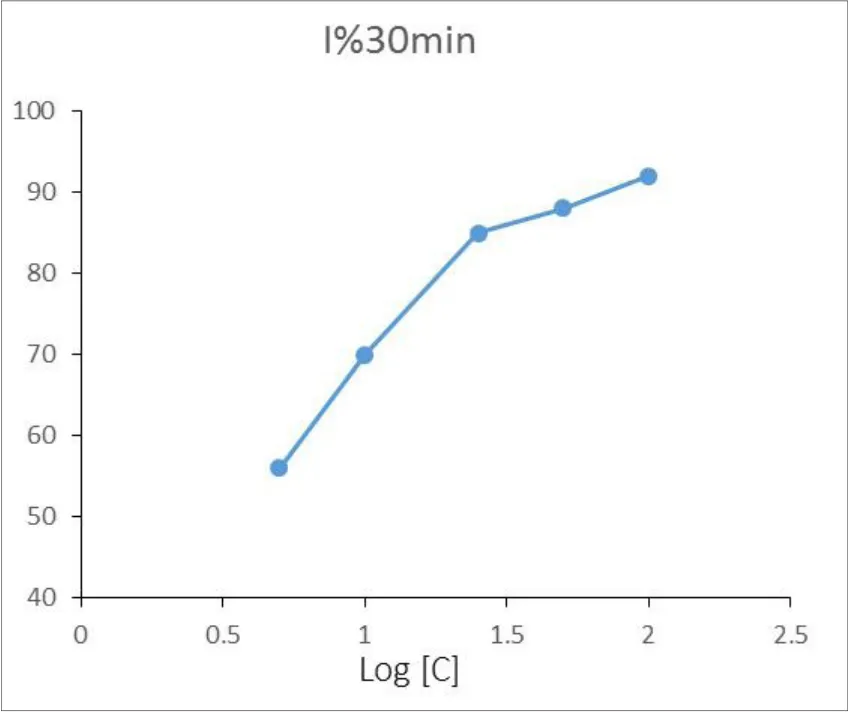
图1 杨梅素作用SrtA 30分钟后的浓度抑制曲线

图2
图2 (A)杨梅素SrtA复合物的对接构象和相互作用;(B)二维结构图预测的相互作用(灰色:蛋白质骨架 绿色:β螺旋红色:α螺旋;相互作用:绿色氢键,紫色π-σ相互作用,浅紫色π-烷基相互作用)
3.3 抗菌活性
化合物的抗菌活性首先通过扩散试验筛选,然后采用肉汤微量稀释法检测。表2显示了大黄素和大黄酸的抑制圈直径。从中可以看出大黄素和大黄酸对革兰氏阳性菌金黄色葡萄球菌ATCC25923,表皮葡萄球菌ATCC12228具有较强的抑制作用。没有一种化合物对革兰氏阴性菌具有抗菌活性。
根据初步分析,只有大黄素和大黄酸产生了显著的抑菌活性。我们测定了大黄素和大黄酸对所选菌株的MIC值。结果显示大黄素比大黄酸具有对所有菌的抑制作用。由此推测可进一步开发含1.8-二羟基蒽醌的衍生物。

表3 化合物的MIC值(μg/mL)
4 讨论
经过初期的筛选,杨梅素和七叶亭因其较好的IC50值,被初步判定为SrtA抑制剂。将这些值与各种已知的SrtA抑制剂进行比较,杨梅素的抑制活性也是相对可以的。杨梅素和槲皮素,芦丁一样,属于黄酮醇,它们都有3-羟基黄酮主链结构。通过体外研究和计算机模拟发现黄酮醇骨架上的羟基的数目和位置对产生SrtA抑制活性是必要的。由于槲皮素在水中的低溶解度,IC50值检测有限。但分子对接分析表明,高浓度的黄酮苷元对SrtA的作用比相应的糖苷强。这个观察与之前关于SrtA抑制剂结构特征中可旋转的数量小于或等于4一致。
七叶亭是咖啡酸分子内环化形成的内酯型肉桂酸的衍生物。它表现出良好的SrtA抑制作用。而咖啡酸及其甲氧基衍生物,反式阿魏酸,没有表现出较好的SrtA抑制活性。产生这种结果差异的原因可能在于化合物的顺反构象,羰基和与ARG197之间氢键作用。七叶苷是七叶亭的6-O-葡萄糖苷,也产生低SrtA抑制作用,因为它缺少一个重要的氢键供体,即6-羟基。

