GSTT1基因缺失、多态性与肺癌易感性的研究
王涛 卜晓波 宋洁
【摘要】 目的:探讨GSTT1基因缺失、多态性与肺癌易感性的关系及其临床意义。方法:选取2016年4月-2017年8月在本院接受治疗的84例肺癌患者為研究组,另选取100例健康人群作为对照组,采用多重PCR技术检测研究对象的GSTT1基因缺陷情况。比较两组GSTT1基因缺陷情况,比较两组中吸烟与不吸烟者的GSTT1基因缺陷情况,比较鳞癌患者与对照组的GSTT1基因缺陷情况。结果:研究组GSTT1(-)型基因缺失情况多于对照组(P<0.05);研究组吸烟者中GSTT1(-)情况多于对照组(P<0.05);鳞癌患者中GSTT1(-)型基因缺失情况多于对照组(P<0.05)。结论:GSTT1基因缺失、多态性与肺癌易感性息息相关,GSTT1(-)基因型有增加患肺癌的可能性,且与吸烟患者存在交互作用,进一步的研究将更好地理解目标基因如何影响肺癌风险,对于肺癌的预防和治疗有重要意义。
【关键词】 GSTT1基因缺失; 多态性; 肺癌易感性; 临床意义
【Abstract】 Objective:To explore the relationship between GSTT1 gene deletion,polymorphism and lung cancer susceptibility and its clinical significance.Method:A total of 84 lung cancer patients treated in our hospital from April 2016 to August 2017 were selected as the study group,and another 100 healthy people were selected as the control group.The GSTT1 gene defect was detected by multiplex PCR.The GSTT1 gene defect was compared in two groups,the GSTT1 gene defects in smokers and non-smokers between two groups were compared,and the GSTT1 gene defect between squamous cell carcinoma patients and control group was compared.Result:The deletion of GSTT1(-)genotype in study group was more than that of control group(P<0.05).The deletion of GSTT1(-)genotype of smokers in study group was higher than that of control group(P<0.05).The deletion of GSTT1(-)genotype in squamous cell carcinoma patients was more than that of control group(P<0.05).Conclusion:GSTT1 gene deletion and polymorphism are closely related to the susceptibility of lung cancer,GSTT1(-)genotype increases the possibility of lung cancer and has interaction with smokers,further research will better understand how target genes affect the risk of lung cancer,which is of great significance for the prevention and treatment of lung cancer.
【Key words】 GSTT1 gene deletion; Polymorphism; Lung cancer susceptibility; Clinical significance
First-authors address:Hongqi Hospital Affiliated to Mudanjiang Medical College,Mudanjiang 157000,China
doi:10.3969/j.issn.1674-4985.2019.07.031
肺癌是发病率和死亡率增长速度最快、严重危害人类健康的恶性肿瘤,严重影响到患者的生活质量,已经成为全国乃至全世界高度重视的社会问题。导致肺癌的发生因子有很多,目前认为吸烟是肺癌最重要的高危因素,烟草中含有的多种化学物质均有较强的致癌活性,激活癌基因,导致癌变[1]。此外,空气污染、工业废气等环境因素也是引发肺癌的重要因素,与遗传也息息相关,相关研究表明,不同的人群对环境致癌剂的易感性存在明显差异,与肿瘤易感性存在紧密关系的有两大类基因:即Ⅰ相与Ⅱ相代谢酶基因,其中,GSTT1是Ⅱ相代谢酶基因的家族成员,对于外源性化学物质具有解毒的重要功能,GSTT1型基因缺失的患者会增加肺癌易感性的可能[2]。本文主要探讨了GSTT1基因缺失、多态性与肺癌易感性的关系及其临床意义,现报道如下。
1 资料与方法
1.1 一般资料 选取2016年4月-2017年8月在本院接受治疗的84例肺癌患者为研究组,另选取100例健康人群作为对照组(正常健康者均按照相应的流程通过体检,体检正常)。(1)纳入标准:①年龄29~80岁;②平均烟龄在7年以上;③患者均确诊为肺癌,且临床表现符合肺癌的诊断标准[3];④患者未有其他肿瘤病变;⑤无传染性疾病;⑥对照组中的健康人群均在本院体检部进行体检,体检结果正常。(2)排除标准:妊娠期、哺乳期女性患者[4]。本研究经过医院伦理委员会批准,且研究对象均知情同意。
1.2 方法
1.2.1 标本的采集 采集过程及具体要求如下:(1)分别取两组外周血2 mL,放入加有EDTA的抗凝试剂管里,如果不立即进行DNA提取,则必须于30 min内置入-80 ℃的低温冰箱里冻存以便备用,采用上海生工生物公司生产的UNIQ-10柱式基因组DNA抽提试剂盒提取[5]。冷冻标本必须先解冻,新鲜标本则可以直接进行基因提取,对其实施电泳检测,并应用核酸蛋白分析仪测量其OD值,提取完成后放入-20 ℃中保存。
1.2.2 PCR扩增 根据480BP片段是否存在判断GSTT1基因是否缺失,GSTT1基因PCR反应体系含100~500 ng模板DNA、0.5 pmol/L引物、200 pmol/L dNTP、2.0 mmol/L MgCl2、0.5 U TaqDNA聚合酶和相应的缓冲液[6]。总反应体积为30 μL。反应条件为94 ℃ 5 min;94 ℃ 1 min、59 ℃ 1 min、72 ℃ 1 min,35个循环;72 ℃ 10 min。反应产物在1.7%琼脂糖凝胶(含0.5 pg/mL溴化乙啶)中電泳约40 min(120 V)后,应用凝胶成像系统观察结果并拍照。对所有取得的结果进行数据分析,并通过对所得数据整理入档案。
1.3 观察指标 统计两组GSTT1基因缺陷情况;比较两组中吸烟者的GSTT1基因缺陷情况;比较鳞癌患者与对照组的GSTT1基因缺陷情况。
1.4 统计学处理 使用SPSS 18.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 对照组男48例,女52例;年龄为31~76岁,平均(53.1±0.4)岁;烟龄3~12年,平均(7.1±0.4)年;吸烟者36例,不吸烟者64例。研究组男51例,女33例;年龄29~80岁,平均(54.2±0.3)岁;病程3~12年,平均(5.2±2.3)年;烟龄5~12年,平均(8.2±0.3)年;吸烟者59例,不吸烟者25例;鳞癌51例,腺癌19例,其他类型的肺癌患者14例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
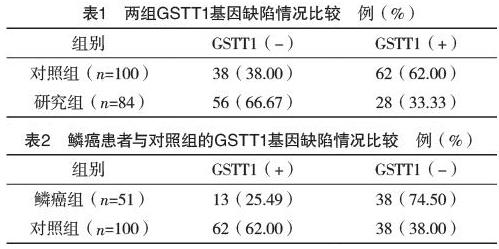
2.2 两组GSTT1基因缺陷情况比较 研究组GSTT1(-)型基因缺失情况多于对照组,差异有统计学意义(字2=15.01,P<0.05),见表1。
2.3 两组吸烟者的GSTT1基因缺陷情况比较 吸烟者中,对照组GSTT1(+)28例(77.78%)、GSTT1(-)8例(22.22%),研究组GSTT1(+)31例(52.54%)、GSTT1(-)28例(47.46%),研究组吸烟者中GSTT1(-)情况多于对照组(字2=6.05,P<0.05)。
2.4 鳞癌患者与对照组的GSTT1基因缺陷情况比较 鳞癌患者中GSTT1(-)型基因缺失情况多于对照组,差异有统计学意义(字2=18.01,P<0.05),见表2。
3 讨论
肺癌是现阶段发病率最高的肿瘤,早期患者会出现胸闷、胸痛、气短、发热、咳嗽以及咳血的症状,致使患者呼吸困难,如果没有得到及时的治疗,病情将会在短时间内持续恶化,最终导致癌细胞扩散,造成患者死亡[7]。临床对于肺癌的诊断并不难,通过支气管检查、X线检查以及细胞学检查等方式即可确诊。经调查研究显示,肺癌患者的死亡率位居所有癌症的首位,且其发病率和死亡率呈逐年上升的趋势[8]。关于肺癌的致病因素有很多,至今尚未完全查明,但经过诊治肺癌的国内外专家的不断研究,发现其与遗传、环境污染、大气污染以及结核病、吸烟、家族史等密切相关,尤其是吸烟,有较长烟龄的患者比不吸烟者患肺癌率要高。如果不及时控制肺癌的恶化,会导致肺癌的播散和转移,主要有直接扩散、血行转移、淋巴道转移等三种途径,一经转移,将很难进行治疗[9]。临床主要是通过手术治疗、化疗以及放射治疗的方式杀死癌变细胞,并没有较好的药物对肺癌进行控制。此外,对于因肺癌而引发的并发症也需要进行积极的治疗,淋巴肿瘤、肺结核、肺部感染等都必须引起重视,在对患者进行肺癌的常规检查时,要仔细检查患者有无身体其他部位的病变,一旦发现,必须进行治疗,防止癌细胞浸润其他器官,降低死亡率[10]。
基因突变是生物进化的重要因素之一,经研究表明,在相同环境中生存的人群,其发病的危险性因个体的差异而有所不同,其发病的易感性与耐受性也不同,而经过不断地研究发现,该种差异是由遗传因素决定的,即基因的多态性。GSTT在机体中对于保护细胞免受急性毒性化学物质的攻击起到重要作用,其通过与DNA大分子共价结合能激发某些肿瘤的形成,使其具有抑制细胞癌变、保护生物大分子不受侵袭的功能,目前对于GSTT基因的研究成为一个热点[11]。外源性致癌物在体内的代谢有两种途径,一条途径可经Ⅰ相代谢酶,与大分子结合启动致癌过程;另一条则是由Ⅱ相代谢酶,与亲电子物质结合,将之转化为亲水性物质,经尿液或胆汁排出体外,这一过程为解毒反应。致癌物能否引起靶细胞癌变很大程度上取决于这两类酶的活性及彼此的平衡关系。经过相关研究表明,不同个体其GSTT1基因缺陷型的频率处在不停波动的范围内,并不是一个定值,GSTT1基因能有效调节遗传毒性物质的生物学效应,其多态性也可能成为影响人类患癌的重要因素之一[12]。在本文的研究中,研究组GSTT1(-)型基因缺失情况多于对照组(P<0.05),说明肺癌患者中,GSTT1基因缺失的有着较高的频率,肺癌与GSTT1型基因的缺失有着一定程度上的关联,GSTT1型基因可能是肺癌的一个重要危险因子,由于该解毒酶基因的缺失导致不能合成相应的酶,当机体受到来自化学致癌物的攻击时,其保护能力有所下降,使DNA损伤更加严重,当DNA损伤到一定程度时,会影响到癌基因或抑制癌基因的表达,但有些研究结果表明GSTT1型基因缺失与肺癌并无太大的关系,所以该结果尚无一致性[13-14]。
本研究结果显示,研究组吸烟者中GSTT1(-)情况多于对照组(P<0.05),该结果已经完全能够证实吸烟与肺癌的相关性。“吸烟有害健康”对于每一个人来说并不陌生,烟草中有上千种化学物质,尤其是多链芳香烃类化合物和亚硝胺等,均有很强的致癌活性,长时间的吸烟可通过多种机制导致支气管上皮细胞DNA损伤,使得癌基因(如Ras基因)激活和抑癌基因(如p53,FHIT基因等)失活,进而引起细胞的转化,最终导致癌变[15]。吸烟被认为是肺癌最重要的危险因素,并在一定程度上可增加患癌率。此外,不同病理类型的肺癌其GSTT1基因缺失的频率也不同,本研究结果显示,鳞癌患者中GSTT1(-)型基因缺失情况多于对照组(P<0.05),由此证明基因的缺失是患肺鳞癌的危险因素[16]。
肺癌是一个多因素共同作用的疾病,研究认为GSTT基因的多态性与肺癌的发生有着密切联系,临床上除了对肺癌患者进行手术、化疗的方式进行治疗,也有一定的预防和控制措施[17]。相关研究表明,通过对环境的保护与吸烟的控制,肺癌的发病率有所下降,首先要从一级防护开始做起:严格控制每天的吸烟量,或禁止吸烟,越早戒烟,肺癌的发病率就越低,其病情发展速度就越慢,由此看来,戒烟是预防肺癌最有效也是最基础的手段和途径[18]。除此之外,大气污染、沉降指数、烟雾指数等暴露剂量与肺癌的发生率成正相关性,保护环境、减少大气污染是降低肺癌发病率的重要措施。多吃蔬菜、水果,不挑食,養成良好的饮食习惯也有利于预防肺癌的发病。多运动锻炼,增强自身免疫力,以积极的心态与肺癌做斗争[19]。对于GSTT1基因缺失、多态性与肺癌易感性的相关性研究,仍需要医学技术人员的不断努力,从细胞学、动物试验等多个方面研究GSTT与肺癌致癌因子的关系[20]。
综上所述,GSTT1基因缺失、多态性与肺癌易感性息息相关,GSTT1(-)基因型有增加患肺癌的可能性,且与吸烟患者存在交互作用,进一步的研究将更好地理解目标基因如何影响肺癌风险,对于肺癌的预防和治疗有重要意义。
参考文献
[1]熊莉华,冯文如,蒋力云,等.MPO和GSTM1、GSTT1基因多态性与儿童急性白血病易感性分析[J].中华疾病控制杂志,2018,22(2):138-141.
[2]安文静,冯喜英,久太,等.谷胱甘肽转移酶T1位点基因多态性与中国人群肺癌易感性的Meta分析[J].中国老年学杂志,2017,37(13):3244-3246.
[3] Malik S S,Masood N,Baig M,et al.The association of GSTM1 and GSTT1 deletion polymorphisms with lung cancer risk:Evidence from an updated meta-analysis[J].Meta Gene,2016,11(C):111-116.
[4]徐秋萍,肖仁栋,熊为旻,等.Notch信号通路相关基因多态性与肺癌易感性的关联研究[J].中华预防医学杂志,2018,52(3):243-252.
[5]胥军,丛支亮,郭亮,等.乳腺癌患者外周血GSTM1、GSTT1基因表达与多西紫杉醇化疗效果的关系[J].山东医药,2016,56(23):90-92.
[6] Yu Y,Xiao L,Chao L,et al.The relationship between GSTA1,GSTM1,GSTP1,and GSTT1 genetic polymorphisms and bladder cancer susceptibility:A meta-analysis[J].Medicine,2016,95(37):e4900.
[7]李志华,王玉琢,刘佳,等.DNA损伤相关遗传变异与中国人群肺癌易感性的关联研究[J].中华预防医学杂志,2016,50(8):721-727.
[8] Masood N,Taseer B,Yasmin A.Association of GSTM1 and GSTT1 deletion with lung cancer development in Pakistani population[J].J Cancer Res Ther,2016,12(2):731-734.
[9]张鑫,林勇,何斐,等.IKBKAP基因多态性与原发性肺癌易感性的病例对照研究[J].中华疾病控制杂志,2017,21(2):136-140.
[10] Gorukmez O,Yakut T,Gorukmez O,et al.Glutathione S-transferase T1,M1 and P1 Genetic Polymorphisms and Susceptibility to Colorectal Cancer in Turkey[J].Asian Pac J Cancer Prev,2016,17(8):3855-3859.
[11]刘志强,蔡琳.miRNA相关SNPs与肺癌遗传易感性关系的研究进展[J].肿瘤防治研究,2016,43(12):1090-1094.
[12]邹雯,陈宇平,谢玲燕.HLA-DP基因多态性与肺癌遗传易感性研究[J].现代预防医学,2016,43(14):2624-2627.
[13] Peddireddy V,Badabagni S P,Gundimeda S D,et al.
Association of CYP1A1,GSTM1 and GSTT1 gene polymorphisms with risk of non-small cell lung cancer in Andhra Pradesh region of South India[J].Eur J Med Res,2016,21(1):17-33.
[14]谭晓刚,王若天,姚舒洋,等.XRCC1基因Arg280His多态与肺癌易感性关系的Meta分析[J].首都医科大学学报,2016,37(6):758-762.
[15]汪君君,谢薇佳,袁帅,等.miRNA基因单核苷酸多态性与非小细胞肺癌易感性的关联研究[J].第三军医大学学报,2017,39(9):904-912.
[16]肖跃海,田源,唐开发,等.谷胱甘肽硫转移酶T1基因多态性与尿道下裂的相关研究[J].中华实验外科杂志,2016,33(11):2580-2582.
[17]何斐,祁琪,李旭,等.室内空气污染、HIF-1α基因单核苷酸多态性与福建汉族肺癌易感性的关系[J].中国肺癌杂志,2017,20(3):149-156.
[18]张莹,王芊芊,屈若祎,等.MTMR3基因多态性与非吸烟者肺癌易感性[J].中华肿瘤防治杂志,2017,24(2):79-83.
[19]韩俊,邵淑娟,孙兵.Fas-670G>A和Fasl-844T>C基因多态性与肺癌易感性关系研究[J].中国癌症杂志,2016,26(7):596-600.
[20]郑名华,孙国栋,张郧樊,等.肿瘤标志物在肺癌诊疗中的研究进展[J].中国医学创新,2016,13(4):145-148.
(收稿日期:2018-07-30) (本文编辑:董悦)

