miRNA与LncRNA相互作用在骨关节炎中的作用
依日夏提·艾海提 许鹏
骨关节炎(OA)是以关节软骨退行性变、软骨下骨硬化及骨质增生为主要特点的慢性退行性关节病变。OA受年龄、性别、外伤史、肥胖、遗传及关节畸形等多重因素影响[1]。OA发病机制尚不明确,目前认为OA中关节软骨退变是由于软骨细胞数量减少,细胞因子及生长因子刺激软骨细胞外基质(ECM)降解所致[2]。随着关节软骨的破坏,患者出现关节疼痛、僵硬,最终丧失活动能力。早期药物缓解症状和中晚期关节置换术是OA的主要治疗手段[3]。然而,这些治疗方法都存在缺陷和不良反应。因此,探索OA发生发展的分子机制对于OA早期诊断标志物和生物治疗靶点研究至关重要。
1 LncRNA
人类基因转录组不仅包括蛋白质编码的mRNA,还包括大量具有调节功能或功能未知的非编码RNA(ncRNA)[2]。其中,长链非编码RNA(LncRNA)是一种长度>200 nt且异构的RNA转录体,缺少有效开放性阅读框(ORF),不编码蛋白质的RNA分子。LncRNA生物化学特性与mRNA相似[4],受RNA聚合酶Ⅱ催化转录合成,被剪接和聚腺苷化,5’段有甲基鸟苷[5]。它主要分布于细胞核,少量存在于细胞质中[6]。LncRNA通常分为5类:正义、反义、双向、基因内及基因间LncRNA[7]。
LncRNA 作为人类基因组中一类重要的表观遗传调控因子,以RNA形式通过表观遗传、转录调控及转录后调控等多种层面调控DNA甲基化、组蛋白修饰和染色质重构,使基因沉默或激活[8]。
LncRNA在转录水平主要影响mRNA生成,也可作为共因子调节转录因子活性。研究发现,小鼠神经细胞转录因子DLX-5/6部分超保守远端增强子区可转录出1条LncRNA-Evf2,后者可与lx-2形成转录复合体,诱导邻近Dlx-5/6基因表达[9]。
LncRNA可直接调控蛋白质翻译。Liu等[10]研究发现,LncRNA β分泌酶1反义转录物(BACE1-AS)是β位点淀粉样前体蛋白裂解酶1(BACE1)分子反义转录产物,并与BACE1 mRNA序列互补结合,增强后者稳定性,促进BACE1蛋白在细胞内的表达,从而参与阿尔斯海默症发生发展。
LncRNA参与广泛的表观遗传过程,包括X-染色体失活、基因组印记、细胞增殖和凋亡[5]及抗体多样性发生过程中基因组重排。X-染色体失活的选择和起始发生在胚胎发育早期,是一种反义链转录调控模式,其中X-失活特异性转录本(Xist)研究最广泛。Zhao等[11]研究发现,Xist中LncRNA重复A(RepA)能直接靶向起始复合体(PRC2),RepA通过招募PRC2至X染色体,促进X染色体失活的启动和传播。
2 miRNA
微小RNA(miRNA)是一类长度18~25 nt且无ORF的非编码短序列RNA,广泛存在于真核生物中[12]。随着研究的深入,miRNA成熟过程及其功能研究已逐渐明确。miRNA与靶mRNA的3’UTR之间形成不完全的碱基互补配对,可抑制靶mRNA表达;miRNA与靶mRNA之间完全互补配对,引起靶mRNA降解[13]。miRNA在人类生命活动的病理生理过程中发挥重要调节作用,如病毒防御,细胞增殖和凋亡,肿瘤发生、侵袭和迁移等[8]。研究表明,miRNA对于维持软骨内环境稳态有重要作用[14]。OA患者软骨细胞与正常人软骨细胞miRNA表达存在显著差异,引起软骨细胞合成与分解代谢失衡,从而导致OA发生发展[1]。这些差异表达的miRNA可能可作为OA的预测生物标志物或靶向治疗潜在靶点。
3 LncRNA与miRNA相互作用
不同种类的ncRNA可能在功能上具有关联性。在生理和病理条件下,它们的相互作用可对细胞表型进行调节[15]。
3.1 LncRNA对miRNA的调控作用
LncRNA可通过竞争性内源性RNA(ceRNA)作用,作为 “miRNA分子海绵”抑制miRNA表达。LncRNA与miRNA之间主要通过miRNA应答元件(MRE)进行调控。LncRNA假基因PTENP1通过PTENP1-miRNA-PTEN的ceRNA网络调控PTEN基因表达,从而在多种恶性肿瘤中发挥其抑癌作用。在胃癌细胞中,PTENP1可通过“诱捕”miR-106b和miR-93,调节抑癌基因PTEN表达[16]。
LncRNA可以通过细胞内剪切作用作为miRNA的前体物质[17]。在胃癌细胞中,LncRNA H19为miRNA-675的前体物质,而miRNA-675高表达能抑制转录因子RUNX1表达水平,促进胃癌细胞增殖、迁移,抑制胃癌细胞凋亡[18]。
LncRNA可与miRNA竞争性结合mRNA。LncRNA通过与miRNA竞争结合靶mRNA的3’UTR,间接抑制miRNA对靶基因的负向调控[17]。在神经系统中正常生理水平的BACE1蛋白对认知、情绪及突触功能和周围神经髓鞘化至关重要[19]。Faghihi等[20]在体外实验研究中发现,mir-485-5p和BACE1-AS在BACE1 mRNA转录本的第6外显子上有1个共同的结合位点,BACE1-AS能竞争性结合BACE1 mRNA,从而减少mir-485-5p对BACE1 mRNA的抑制作用。
3.2 miRNA对LncRNA的调控作用
LncRNA生物学特性与mRNA相似,转录成熟过程(包括RNA剪接、编辑)也与mRNA类似,成熟的LncRNA通常加帽,存有Poly-A,即有 5’ UTR和 3’UTR[18],miRNA可通过调节LncRNA启动子区甲基化调控LncRNA表达。
4 LncRNA与miRNA相互作用在OA中的作用
OA软骨细胞中LncRNA与miRNA相互作用可调控OA发生发展的关键基因,从而决定软骨损伤程度。研究表明,OA患者LncRNA与miRNA的相互作用能发挥重要作用(表1)。
4.1 调控软骨细胞增殖与凋亡
在OA软骨细胞中,LncRNA与miRNA相互作用能调节软骨细胞合成与分解代谢。Li等[23]进行MS2核酸免疫共沉淀、荧光素酶活性和AGO2抗体核酸免疫共沉淀等试验,证实LncRNA PVT1基因可负调控软骨细胞miR-488-3p,抑制miR-488作用于靶基因ZIP-8,促进软骨细胞凋亡。在机械应力刺激下,软骨细胞LncRNA MSR、TMSB4假基因表达显著升高。在OA软骨细胞中TMSB4能间接诱导细胞骨架重塑和MMP产生。因此,LncRNA MSR可通过与miRNA-152竞争调控软骨细胞TMSB4表达。LncRNA MSR是OA软骨细胞退变的启动因子[7]。
LncRNA生长抑制特异物5(GAS5)是许多核仁小RNA(snoRNA)的宿主,作为非编码RNA,它能够发挥抑制肿瘤的作用[34]。在GAS5过表达软骨细胞中,MMP-2、MMP-3、MMP-9、MMP-13和ADAMTS-4等表达水平显著升高,并通过抑制包括BCLN-1、ATG7和LC-3B在内的自噬复合物表达水平抑制软骨细胞自噬反应[25],因此GAS5表达水平增高能促进细胞凋亡。Xu等[33]用白细胞介素(IL)-1刺激雄性SD大鼠膝关节软骨细胞,发现LncRNA MEG3基因表达显著下调。有学者使用RNAi技术特异性敲减软骨细胞中LncRNA MEG3基因,发现凋亡相关蛋白Bax和Bcl2表达水平降低,证实LncRNA MEG3与miR-16 ceRNA作用可调节SMAD7表达,发挥其抗软骨细胞增殖和促凋亡作用。OA软骨细胞中LncRNA SNHG5基因表达上调可促进软骨细胞增殖和迁移[28]。与之相反,LncRNA UFC1基因过表达可通过ceRNA作用抑制miR-34a表达,促进软骨细胞增殖,抑制软骨细胞凋亡[29]。
4.2 调控软骨ECM合成与降解
在OA进展过程中,软骨细胞数量减少伴随着ECM降解,LncRNA与miRNA相互作用在OA软骨ECM降解过程中起至关重要的作用。在OA软骨细胞中LncRNA CIR和LncRNA UCA1表达均升高,两者分别与miR-27b和mir-204-5p通过ceRNA作用负性调节MMP-13表达,促进软骨ECM降解[21-25]。
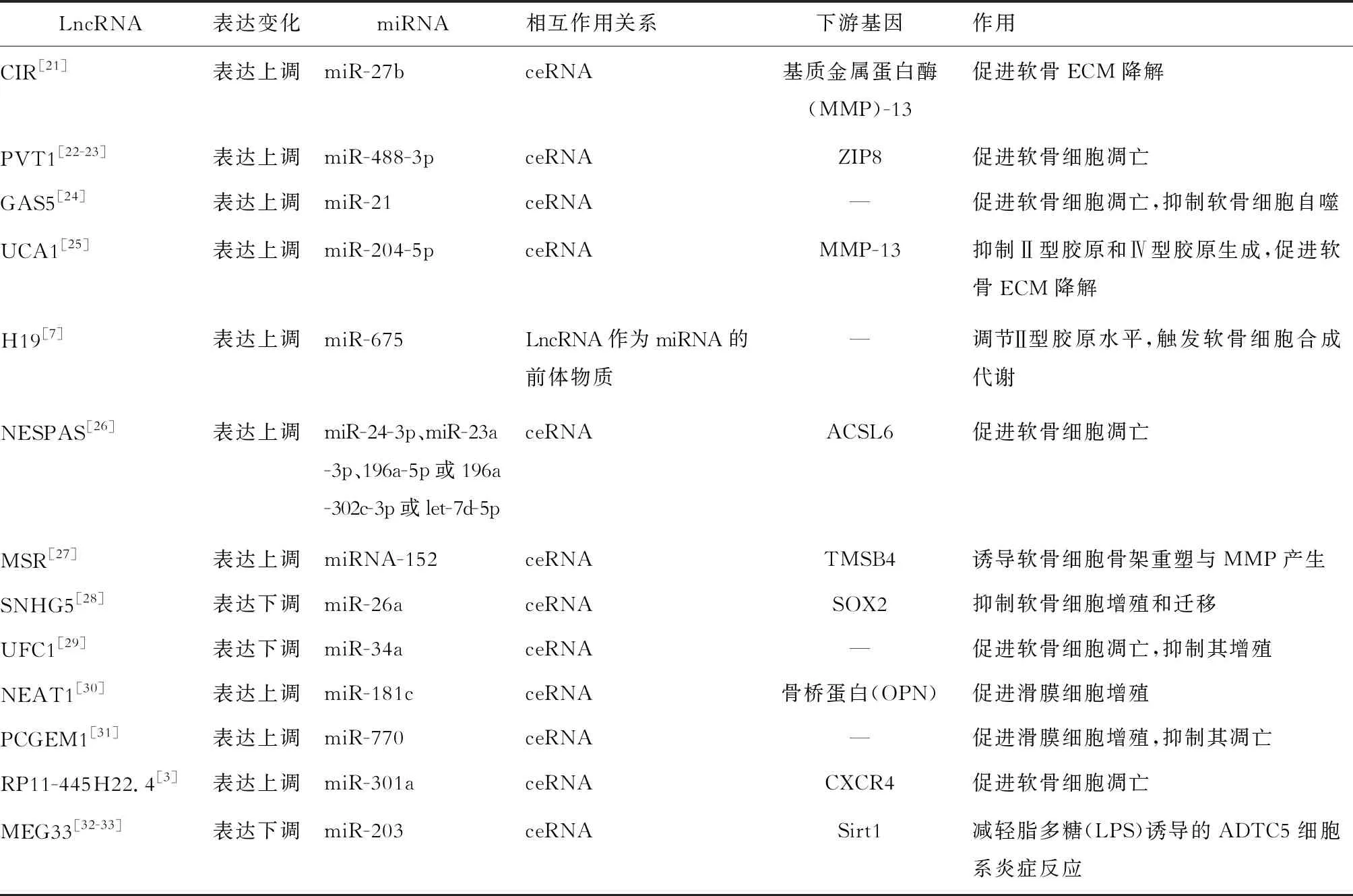
表1 OA中LncRNA与miRNA相互作用关系及其作用
Steck等[7]在OA患者软骨细胞中发现LncRNA H19表达上调可促进ECM合成,此外H19编码的mir-675可能通过1个尚未被识别的靶分子调节Ⅱ型胶原水平。因此,LncRNA H19/miR-675表达上调是OA软骨细胞在凋亡过程中对ECM破坏的代偿。
Park等[26]研究发现,过表达OA软骨细胞LncRNA Nespas可显著提高软骨细胞Ⅰ型胶原和MMP-13水平表达水平并降低Ⅱ型胶原表达水平,同时miR-291a-3p、miR-196a-5p、miR-23a-3p、miR-24-3p和let-7a-5p表达水平显著降低,因此OA软骨细胞中LncRNA Nespas与miR-291a-3p等可能通过ceRNA作用共同调节ACLS6表达以促进OA病理进程。
4.3 对OA滑膜细胞的影响
OA患者膝关节异常应力或细胞因子异常分泌均可引起不同程度的滑膜增生与炎性改变。Kang等[31]研究发现,前列腺癌基因表达标志物1(PCGEM1)在OA小鼠膝关节滑膜细胞表达增加。滑膜细胞中PCGEM1与miR-770通过ceRNA作用促进滑膜细胞增殖。在滑膜细胞中,miR-181c能抑制OPN表达,OPN能调节MMP-13、IL-6和IL-8等炎症因子。在OA滑膜细胞中,LncRNA NEAT1通过与miR-181c的ceRNA作用促进OPN表达和IL-6、IL-8等炎症因子释放,促进滑膜增殖[30]。
4.4 对OA成软骨细胞的影响
Wang等[32]通过LPS刺激ADTC5细胞以体外模拟OA发生过程,发现LncRNA MEG3通过调节miR-203表达来减轻LPS对ADTC5细胞的炎症损伤。CXCR4作为miR-301a的靶基因,其沉默可阻断LPS激活的核因子(NF)-κB和丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)信号通路,缓解OA软骨炎症反应。有研究使用LPS刺激ATDC5细胞,结果LncRNA RP11-445H22.4的表达显著上调,LncRNA RP11-445H22.4可以与miR-301a直接结合,抑制LncRNA RP11-445H22.4同样能显著缓解LPS诱导的细胞损伤,因此猜测LncRNA RP11-445H22.4/miR-301a/CXCR4可能是OA潜在治疗靶点[33]。
5 结语
LncRNA通过表观遗传、转录调控及转录后调控等多种层面调控DNA甲基化、组蛋白修饰和染色质重构,在骨和软骨组织发育中起着关键作用[35]。目前已鉴定的功能性LncRNA数量有限,且LncRNA功能学研究尚处于起步阶段,OA中LncRNA与miRNA其他相互作用方式尚待进一步研究。随着实验技术的进步,人类对LncRNA领域的探索不断加深,可以预期的是,LncRNA与miRNA相互作用关系将会为OA发病机制提供新的思路,为OA治疗提供新的靶点。

