扶正抗癌方通过DNMT1-p21通路对A549细胞增殖的影响
赵越洋,周宇姝,吴万垠
1.广东省中医院血液科,广东 广州 510370;2.广东省中医院肿瘤科,广东 广州 510370
1 材料与方法
1.1 材料
1.1.1 细胞株
肺腺癌细胞株A549购买自中国科学院上海生命科学研究院,其无EGFR基因突变,对EGFRTKI低敏感的细胞株。
1.1.2 药物
扶正抗癌方药材购于广东省中医院药房,组成:太子参15 g、白术15 g、黄芪30 g、炒薏苡仁30 g、甘草10 g、山慈菇30 g、蛇舌草30 g、龙葵30 g、石见穿30 g、八月札30 g、蛇泡簕30 g、莪术15 g。取出药材,加入2L纯水并浸泡30分钟,共煎煮2个小时,煎煮过程中避免药物水蒸气溢出瓶口,煎好后将水煎液移至烧杯中,混匀前后两次药液。
使用冷凝回旋浓缩仪浓缩药液,收集浓缩液。将中药浓缩液转移至100 mm×100 mm的细胞培养皿中,将盖子取掉用保鲜膜封好,放于-80℃冰箱过夜。在扶正抗癌方进行干燥之前将保鲜膜上面留有小孔以排气,培养皿放置于真空干燥仪过夜进行干燥,参数设置如下:先预热20分钟,主干燥24小时;终末干燥2小时;干燥压力为0.165 mbar;温度为4℃。干燥完成后收集中药冻干粉并称量全部冻干粉重量,将冻干粉放在干燥管内进行密闭保存。
1.1.3 主要试剂
RPMI-1640基础培养基、胎牛血清(FBS)、Opti-MEM(1X)培养基、胰酶、噻唑蓝(MTT)、Trypan Blue试剂、二甲基亚砜(DMSO)、吐温20(Tween 20)、异氟烷、3×loading buffer、p21Waf1/Cip1(12D1)RabbitmAb、DNMT1(D63A6)XPRabbitmAb(CST公司);化学发光液。
1.1.4 主要仪器
自动细胞计数板、自动细胞计数仪(美国Count Star公司);涡旋振荡器;脱色摇床;酶标振荡器(IKA公司);离心机(5418);高速冷冻离心机(5702);细胞培养箱(德国Eppendorf公司);酶标仪(TECAN Infinite F500);化学发光成像系统、半干转膜仪(BIO-RAD公司)。
1.2 方法
1.2.1 细胞培养
培养条件为37℃,5%二氧化碳环境,含10%胎牛血清的RPMI-1640培养基培养细胞。当10 cm×10 cm培养皿细胞长至80%左右融合后可以传代,弃原培养基,加入干净的4℃PBS冲洗2~3次,每个培养皿中加入胰酶1 mL,后将培养皿放置于培养箱消化1 min,待细胞皱缩变圆,但尚未完全脱落时移除胰酶,加入3 mL完全RPMI-1640培养基终止消化,轻轻吹打细胞,按1∶3~1∶5比例传代继续培养。
1.2.2 药物配制
开始实验前,取扶正抗癌方冻干粉0.5 g加入无血清RPMI-1640培养基中,涡旋并充分混匀,直到扶正抗癌方颗粒完全溶解,使用10mL注射器吸取溶液,用0.22μm滤器过滤,置于50mL离心管4℃保存,药液尽量在1周内使用。
1.2.3 MTT活力检测
将A549用胰酶消化,用计数仪计数后以每孔5×103细胞数接种于96孔板中,将96孔板放置于培养箱过夜,24 h后分别给予每个孔以不同剂量的扶正抗癌方(0、0.5、1.0、1.5、2.0、2.5、3.0 mg/L),每孔加入含扶正抗癌方的培养液100 μL,均设置3~5个复孔,在24、48、72 h时3个时间点进行测量MTT值,用排枪吸取培养基,后可用PBS清洗一次,然后于每孔加入MTT溶液100 μL,MTT溶液是使用MTT粉配置而成,将96孔板放置于培养箱孵育3~4 h,弃MTT溶液,后于每孔加入100 μL DMSO(非细胞实验用),在振荡仪上充分混匀8-10分钟,使用酶标仪以490或者570 nm波长检测其每孔的吸光值,记录每孔检测数值。其中24 h、48 h、72 h 3个时间点各需要重复3次实验。每一浓度不同组取5~8个复孔的平均值,将对照组细胞存活率设为100%,各个扶正抗癌方加药组细胞存活率计算公式如下:复孔存活率=1-(扶正抗癌方组OD值/对照组OD值)×100%。沉默p21基因表达后扶正抗癌方对A549细胞增殖的影响实验:设置对照组、FZKA组(2.0 mg/L)、p21 siRNA组和FZKA(2.0 mg/L)+p21 siRNA组,余实验步骤同上。本研究中对照组中仅加入1640培养基,不含其他操作。
1.2.4 蛋白质印迹法
将A549用胰酶消化后接种至6孔板,贴壁后加入不同浓度的扶正抗癌方或者其他方式处理,弃原培养基,PBS清洗后,加入30-50 μL细胞裂解液,用细胞刮棒刮下细胞,在4℃,15 000 rpm离心机离心15 min。按5×loading按比例(loading:上清液=1∶4)加入上清液,混匀之后,放置于水浴恒温器中100℃变性5 min,于-80℃保存。将电泳槽、电泳缓冲液、样品准备好,接好电泳槽的正负极,将SDS-PAGE凝胶固定于电泳槽中,将蛋白样品按计算好量左-右顺序等量加入每个梳孔。浓缩胶以恒压80 V电泳0.5 h,分离胶以恒压120 V电泳1.5 h;电泳完毕后取出凝胶,按从下到上“滤纸-PVDF膜-凝胶-滤纸”顺序置于半干转电泳仪中,恒压20 V转膜70 min。转膜完成后,将PVDF膜置于脱脂牛奶中,孵育1 h。一抗抗体床孵育4 h以上,或者4℃过夜。用1×TBST于室温摇床洗膜3次,每次5~10 min。二抗孵育1h后回收,1×TBST洗膜3次,每次5~10 min。将蛋白条带放置盒子中,随后在Image Lab软件进行数据处理。
1.3 统计学方法
实验数据大多为定量数据,以Means±SD表示。数据使用Graphpad Prism 5.0软件录入,后进行正态性及方差齐性检验,如果满足正态性及方差齐性时,多组间比较可采用单因素方差分析(One-way ANOVA),两组间比较则采用t检验;若不满足正态性或者方差齐性,采用非参数检验。按检验水准α=0.05,即差异具有统计学意义标准为P<0.05。
2 结果
2.1 扶正抗癌方对A549细胞增殖的影响
随着扶正抗癌方浓度的增加和时间的延长,A549细胞活力逐渐降低,从24、48 h的1.0 g/L浓度和72 h的0.5 g/L浓度加药组开始,与对照组比较,细胞活力受到抑制,差异具有统计学意义(P<0.05);A549细胞在24 h、48 h、72 h的半数抑制浓度IC50(Half Maximal Inhibitory Concentration)分别是分别为2.53、1.92、1.36 g/L。见表1。

表1 不同浓度扶正抗癌方不同时间对A549细胞活力的影响
2.2 扶正抗癌方对DNMT1和p21蛋白表达的影响
本研究将A549细胞用胰酶消化后以每孔4.0×105细胞数接种至6孔板,待细胞贴壁后,处理组分别给予0.5、1.0、1.5、2.0、2.5 mg/mL剂量的扶正抗癌方处理两组细胞,作用24h后,再利用WB检测DNMT1和p21蛋白的表达,以甘油醛-3-磷酸脱氢酶(GAPDH)作为对照,此试验均重复3次或以上,结果如下图。图1、图2分别为扶正抗癌方对DNMT1、p21蛋白表达的影响。
该实验结果显示,随着扶正抗癌方的浓度的增加,该细胞株DNMT1T蛋白的表达量依次下降,p21蛋白表达量依次上升。当扶正抗癌方浓度为1 mg/mL至2.5 mg/mL时与未加药组比较差异具有统计学意义(P<0.05)。统计数据见表2。
2.3 沉默p21后扶正抗癌方对A549细胞增殖的影响
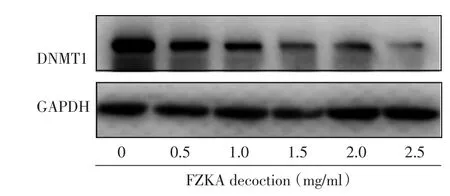
图1 扶正抗癌方对DNMT1蛋白表达的影响
胰酶消化细胞后接种至96孔板,24h贴壁后,将外源性p21siRNA加入细胞株,后通过MTT法观察扶正抗癌方对肺癌细胞生长的影响,结果显示扶正抗癌方抑制A549细胞的细胞活力,与对照组比较,差异具有统计学意义(P<0.05);FZKA联合p21siRNA组与扶正抗癌方组对比,差异具有统计学意义,提示沉默p21逆转了扶正抗癌方对细胞增殖的抑制效应,见表3。0

图2 扶正抗癌方对p21蛋白表达的影响

表2 扶正抗癌方对肺癌A549细胞DNMT1、p21蛋白表达的影响
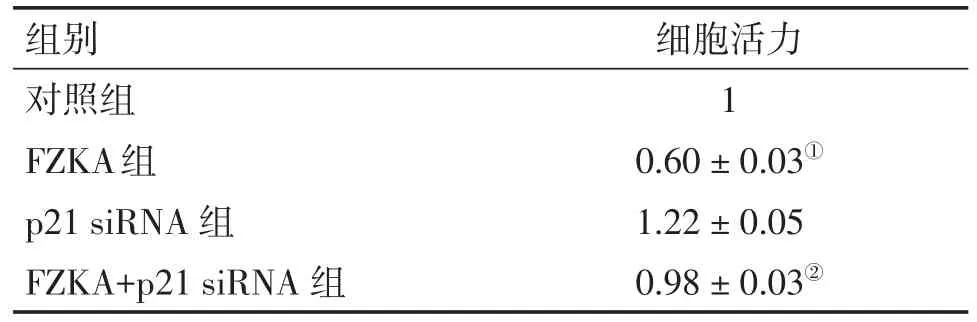
表3 扶正抗癌方A549细胞增殖的影响
3 讨论
本研究进行体内和体外实验,探索扶正抗癌方抑制人肺癌细胞生长的潜在机制,实验结果显示扶正抗癌方通过降低DNMT1蛋白的表达,进一步促进p21基因的表达,进而抑制肺癌细胞的增殖。
DNA甲基化是真核生物细胞DNA最普遍常见的修饰,是一种重要的表观遗传学标记,能影响染色质的结构与基因的表达。DNA甲基转移酶主要起到催化DNA甲基化的作用。许多研究发现,DNMT1低表达的肿瘤患者,对肿瘤治疗有较好的效果和较高的生存率。而DNMT1或DNMT3a高表达的肿瘤患者,对化疗药的敏感性较差。其中低甲基化或去甲基化可以抑制生物癌基因的表达,可以促进抑癌基因的表达,进一步抑制肿瘤细胞的生长。DNMT1有可能成为治疗肿瘤的潜在靶点[5]。本文研究发现扶正抗癌方可以以浓度依赖性下调DNMT1蛋白表达。
在肺癌的形成过程中,p21是作为抑癌因子。Shoji T研究发现p21蛋白的缺失与肺癌的预后不良相关[6]。在老鼠动物模型实验中,有研究发现对于p21蛋白表达量高的老鼠比p21蛋白表达量低老鼠更易患肺部肿瘤[7]。另外,Wu等[8]研究发现早期p21蛋白低表达的患者比p21蛋白高表达的患者肿瘤无复发生存率低。Tan等发现p21(WAF1)在哺乳动物细胞中负调控DNMT1表达,它可能在哺乳动物细胞分裂中发挥关键作用,以确保调控的DNMT1表达和DNA甲基化[9]。Xu等在研究中提出在前列腺癌PaTu8988细胞中,沉默DNMT1,p21的表达上调以及Bax/Bcl-2的表达升高[10]。
本研究探讨DNMT1/p21通路在扶正抗癌方抑制肺癌细胞生长过程中的作用,利用细胞沉默p21表达后,采用MTT法检测对细胞活力的影响。结果显示扶正抗癌方联合p21siRNA组较扶正抗癌方组的细胞活力增强,表明沉默p21逆转了扶正抗癌方对细胞增殖的抑制,从而也证实p21参与扶正抗癌方对肺癌A549细胞生长的调节。
综上可知,扶正抗癌方可通过DNMT1-p21通路抑制DNMT1蛋白表达,进而促进p21表达,进一步抑制A549细胞的增殖。

