生物硝化抑制剂的抑制原理及其研究进展
张洋 李雅颖 郑宁国
摘要:为维持和提高农作物产量,大量氮肥施入农田生态系统中。所施入的氮肥通过硝化过程形成硝态氮,其易淋溶或通过反硝化作用损失,造成大量氮素流失,影响农业生产的可持续性且带来生态环境问题。硝化抑制剂可抑制硝化作用,而植物根系分泌的生物硝化抑制剂以其成本低、环境友好等优点逐渐引起关注。本文综述了国内外植物源硝化抑制剂的研究进展,包括分泌生物硝化抑制剂的植物种类、生物硝化抑制剂的作用机制及影响因素;总结了生物硝化抑制剂对农业的影响及对生态环境的保护作用,并从农业生产和环境保护的角度出发,对今后生物硝化抑制剂的研究方向进行了展望。
关键词:生物硝化抑制剂;农业系统;生态环境;氮循环
中图分类号: S143.1 文献标志码: A 文章编号:1002-1302(2019)01-0021-06
为了满足全球不断增长的粮食需求,人类在农业系统中施入大量氮肥。在促进粮食生产的同时,也造成了严重的环境污染,如水体富营养化、地下水硝酸盐污染、氧化亚氮(N2O)和一氧化氮(NO)等温室气体的排放[1]。在农业生产工业化以前,氮的收支长期处于相对平衡的状态,即固氮作用和脱氨作用基本持平。但自20世纪30年代以来,地球氮循环一直被打乱[2],尤其是1960—2009年间的绿色革命,大量使用工业复合肥来栽培水稻和玉米,虽然生产了全球近1/4的粮食,但却严重地破坏了生态环境[3-4]。全球每年氮肥的消耗量将近1.5×108 t,而强硝化作用导致了近70%的氮肥流失[5],每年直接造成的经济损失约8 100万美元(尿素的价格是0.54~0.80美元/kg)[6]。预计到2050年全球氮肥的施用量会翻1倍达到每年3.0×108 t[6],每年从农业系统中流失的硝态氮所造成的氮损失将会达到6.15×107 t[7],这会增大农业系统中氮肥的流失风险,加剧环境污染问题。
矿化(mineralization)、硝化(nitrification)和反硝化(denitrification)是土壤氮循环的重要过程[8]。氮素的矿化作用是土壤有机氮在微生物作用下分解成无机氮的过程;而硝化作用是铵态氮(NH+4-N)在有氧条件下,微生物的作用下经氨氧化和亚硝酸盐氧化2步反应转化为硝酸盐的过程[9];Pjevac等于2015年从硝化螺旋菌属(Nitrospira)中发现并培养了1株完全硝化细菌,这种化能自养型微生物的基因型可以编码氨氧化和亚硝酸盐氧化2个途径中的蛋白,完全硝化菌是氮循环中微生物群落的一个重要成分,它的发现改变了人们对硝化过程的认识[10]。反硝化作用也称脱氮作用,是反硝化细菌在无氧条件下,还原硝酸盐,释放出氮气(N2)或N2O的过程。现代农业所用氮肥以铵态氮肥料(尿素、硫酸铵)为主,铵态氮经过硝化作用形成硝态氮,硝态氮带有负电荷,不能被土壤吸收,具有很高的流动性,在根区容易受淋溶和反硝化作用的影响[11]。因此,硝化作用是氮素从土壤生态系统中流失的主要原因,且硝态氮的淋失造成了地下水和地表水污染[12]。此外,农田系统是N2O的主要排放源,硝态氮通过反硝化过程产生N2O,且植物对硝态氮的同化作用会直接增加植物树冠对N2O的排放。氧化亚氮是造成全球变暖的三大温室气体之一,排放量一直在增加。虽然N2O在大气中含量比较低,但其增温潜势却是二氧化碳(CO2)的298倍[13]。研究表明,2014年大气平均N2O的摩尔分数是18世纪50年代的121%[14]。因此,提出切实可行的农业减排措施对控制全球气候变暖有重要意义[9]。
抑制硝化作用和减少土壤氮肥的投入是提高农业系统中氮肥利用和减少N2O排放的关键方法[15]。用化学抑制剂来控制硝化作用已经被证实可以有效地提高氮肥利用率和降低环境污染[16],与此同时,研究人员发现一些植物根际分泌的化合物对土壤硝化过程也存在抑制作用,这些化合物被称为生物硝化抑制剂(biological nitrification inhibitor,简称BNI)。BNI指在自然生态系统中,特定植物根系产生的、可以通过抑制氨氧化微生物活性从而起到抑制硝化作用的化合物[17]。本文综述目前国内外已知的、具有生物硝化抑制功能的植物及其作用机制,总结生物硝化抑制剂在农业生产和生态环境保护方面的作用,并从农业和环境的角度出发,对今后生物硝化抑制剂的研究方向进行展望,为调控氮素循环、提高氮素利用率和减少土壤温室气体排放提供科学参考。
1 化学合成硝化抑制剂
硝化抑制剂(nitrification inhibitor,简称NI)是一类能够抑制土壤硝化微生物活性物质的总称,可以有效减缓土壤中NH4+向NO2-、NO3-的转化,如2-氯-6-三氯甲基吡啶(nitrapyrin)、双氰胺(DCD)、3,4-二甲基吡唑磷酸盐(DMPP)、4-氨基三唑(AM/AT/ATC)、硫脲(TU)等[16]。其技术原理:硝化抑制剂抑制了土壤中的亚硝化、硝化甚至反硝化过程,从而阻碍了NH4+向NO2-、NO3-的转化过程。硝化抑制剂与氮肥配合施用,通过抑制硝化细菌的活性,抑制亚硝化、硝化、反硝化作用,使施入的铵态氮能够较长时间以NH4+-N的形态存在并供作物利用,从而提高肥效,并减少硝态氮和亚硝态氮的淋溶和反硝化的氮素损失。不同类型的硝化抑制剂有不同的作用机制,例如DCD、DMPP等通过产生毒性来抑制氨氧化细菌的活性,进而抑制NH3氧化成NO2-;氰酸盐(cyanate)和氯酸盐(chlorate)等可抑制硝化杆菌属细菌的活性,从而抑制NO2-氧化成NO3-[15,17-18]。
將硝化抑制剂与肥料同时施入土壤,可以降低氮肥的淋失和反硝化作用的损失,不仅提髙了对氮肥的利用率,还减少了对环境的污染[11]。化学合成的硝化抑制剂DCD、DMPP经过了大田试验的评估,被人们广泛应用[18]。硝化抑制剂在无机氮含量高、氮淋失严重和反硝化较强的土壤中效果明显。但硝化抑制剂存在成本较高、应用不方便且容易造成环境污染等缺点,特别是一些可溶于水的抑制剂会造成地表水和地下水污染[12]。以DCD为例,使用高浓度DCD(DCD用量为氮肥施用量的10%)才能达到所期望的抑制效果,但DCD可溶于水,易从植物根区流失造成环境污染[19-20]。相对于这些化学合成的硝化抑制剂的种种限制,生物硝化抑制剂不仅不会污染土壤,而且易于从自然界中得到,成本低廉,抑制时间较长,效益较高[21]。
2 生物硝化抑制剂
1966年,Munro等发现,森林与草地土壤存在硝化作用减缓的现象[19],随后生物硝化抑制剂的概念第1次被提出[22],即BNI源于自然环境,易被微生物降解利用,是1种环境友好型的硝化抑制剂[23]。尽管20世纪60年代就已经开始了对BNI的研究,但由于缺乏准确检测BNI活性的方法,使得对土壤系统中BNI功能的验证受到了阻碍。直到2006年,Subbarao等改进了生物化学发光法(其原理为待测物浓度与体系内的生物发光强度在一定条件下呈线性关系),研究者重组了亚硝化单细胞菌(Nitrosomonas europaea),使其携带1个具有哈氏弧菌(Vibrio harveyi) lux AB基因表达载体,分析时在30 s内产生清晰的双峰值发光模式[25],亚硝化单细胞菌的生物荧光发射强度和亚硝酸盐的产量呈线性关系。以化学抑制剂烯丙基硫脲(allylthiourea,简称AT)作为对照,将浓度为0.22 μmol/L的AT对亚硝化单细胞菌产生的抑制效果定义为1个ATU(烯丙基硫脲)单元。根据AT的浓度梯度与生物发光强度所得到的线性方程对待测物浓度进行定性和定量分析,样品(根际土提取物、植物等)的抑制效果可用ATU单元来表达和对比[24-25]。生物荧光分析的发展使准确量化植物根系分泌BNI的能力成为可能。
研究显示,非洲湿生臂形牧草(Brachiaria humidicola)和俯仰臂形草(Brachiaria decumbens)有较强的分泌硝化抑制剂的能力[17],在长期缺乏氮素的南美洲热带稀树草原上,这些牧草根系能够通过分泌抑制硝化活性的物质来减少土壤铵态氮转化为硝态氮的量,避免氮素以硝态氮的形式淋失。研究表明,杨梅树(Arbutus unedo)对土壤硝化活性也具有抑制作用[26-27]。关于禾本科植物的研究已经证实玉米根系没有分泌生物硝化抑制剂的能力,但高粱、小麦和水稻的根系具有释放硝化抑制剂的能力[17]。
2.1 生物硝化抑制剂的作用原理
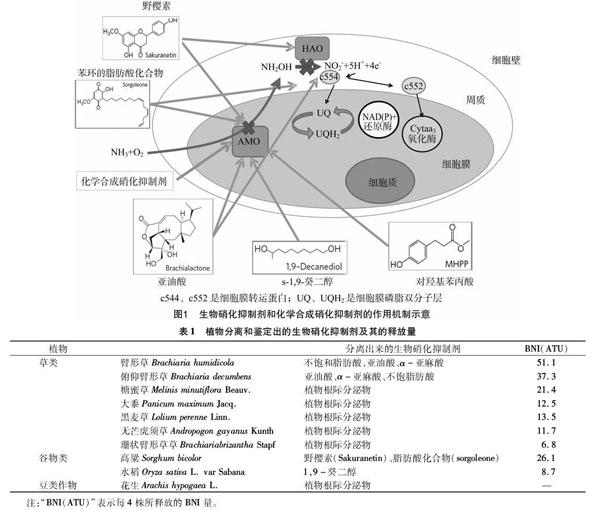
自养型氨氧化细菌(AOB)和氨氧化古菌(AOA)是硝化作用的主要功能微生菌群,在低氮环境里,由于AOA对底物NH3的亲和力更高,因此比AOB的适应性好[24]。氨单加氧酶(ammonia monooxygenase,简称AMO)和羟胺氧化还原酶( hydroxylamine oxidoreductase,简称HAO)是AOB和AOA进行氨氧化过程的关键酶。AOB的AMO三聚体膜结合蛋白由amoA、amoB和amoC 3个亚基组成,其中含有酶活性位点的是amoA亚基,可催化氨(NH3)氧化成羟胺(NH2OH),羟胺再经由HAO作用生成NO2-[27-29];AOA编码AMO的基因中不会同时包含编码amoA、amoB和amoC的基因,但一定含有编码amoA的基因[17],此外,在AOA中检测不到编码HAO的基因,同时AOA也缺少编码细胞色素C的基因,而细胞色素C对AOB氨氧化过程的电子传播途径有重要意义[30-32],这些分子水平上的差异可能是导致2类氨氧化微生物对不同类型的BNI表现出不同响应的主要原因。通常单加氧酶有1个底物范围,AMO也不例外,AMO可用的底物有近60种化合物,这60种底物通過3种不同的机制来影响AMO活性。HAO催化水解羟胺,是发生在能量氧化过程中羟胺到亚硝酸盐反应的一步。生物硝化抑制剂通过抑制AMO和HAO的活性来抑制硝化作用(图1)[33-34]。有研究表明,生物硝化抑制剂可以干扰氨氧化过程中HAO到辅酶和细胞色素的电子传播途径[35]。氨氧化细菌和氨氧化古菌属于专性化能自养型微生物,放线菌、微藻类、细菌、真菌等异养微生物也可进行异养硝化作用,但对硝化作用的贡献较小。
2.2 生物硝化抑制剂的种类
非洲湿生臂形牧草和俯仰臂形草根际所产生的亚油酸、α-亚麻酸和不饱和脂肪酸含有BNI活性,这3种化合物可以同时抑制AMO和HAO的活性,但对AMO的抑制效果更高,且作用时间可达数月[36]。其他具有相似功能的植物对AMO和HAO活性的抑制效果相近[36-37]。目前已知具有释放BNI能力的植物如表1[34]所示,臂形牧草和高粱对AMO和HAO都有抑制作用,而水稻仅对AMO有抑制作用(图1)。
Byrnes等研究了2种具有不同硝化抑制能力的非洲湿生臂形牧草,将2种分泌BNI能力不同的非洲湿生臂形牧草种植 29 d(施入的总N量为1.49 g/kg;土壤pH值为6.2),分别测定了种植前后根际土的硝化速率并用定量PCR法检测了AOA和AOB的拷贝数;结果表明,种植较低抑制能力臂形牧草(Brachiaria humidicola cv. Mulato,简称BM)土壤的N2O排放量为80 mg/m2,而种植了较高抑制能力臂形牧草(Brachiaria humidicola cv. Tully,简称BT)的土壤仅为 32 mg/m2,BT根际土中硝化、反硝化作用和AOA丰度明显低于BM,说明抑制能力较强的牧草对抑制AOA活性起主导作用[27]。基因可遗传变异是分子育种改变植物基因型的前提,非洲湿生臂形牧草释放BNI的能力是存在遗传变异性的。
Subbarao等研究发现,高粱根际释放出2种硝化抑制剂:一种抑制剂是亲水型化合物;另一种抑制剂是疏水型化合物,2种BNI的释放速率范围是10~25 ATU/(g·d)。在种植了30 d高粱的盆栽试验里,土壤BNI增加了10 ATU/g,有效地使硝化作用降低了40%;对亲水性的BNI进行鉴定发现,其主要化合物为野樱素(sakuranetin),而疏水性的BNI主要成分为1种带有苯环的脂肪酸化合物(sorgoleone),这2种化合物可以同时抑制羟胺氧化和氨氧化过程[38]。高粱在整个生长过程中释放生物硝化抑制剂的能力随高粱生长不断提高,但是生物硝化抑制剂的抑制效果却随着高粱的生长不断降低;高粱分泌亲水性和疏水性生物硝化抑制剂的量没有明显差别,唯一的区别是在高粱生长130 d后,根部释放亲水性抑制剂的量有明显的下降[38]。周金泉对高粱分泌的一种BNI——对羟基苯丙酸(MHPP)进行研究发现,MHPP的分泌速率随着铵离子浓度的升高而增加;利用对质子泵具有激活作用的壳梭孢菌素(fusicoccin)和抑制剂钒酸盐(vanadate)处理高粱根系后发现,壳梭孢菌素能提高MHPP的分泌量,而钒酸盐则导致其分泌量降低[39]。
Sullivan对96个的小麦品种进行研究发现,其中26个小麦品种能分泌BNI,使硝化速率平均降低38%;将这26种小麦和非洲湿生臂形牧草抑制硝化速率的能力作比较,结果发现,非洲湿生臂形牧草可将硝化速率降低14%,而26种小麦中有20种的硝化抑制效果优于非洲湿生臂形牧草,其中效果最优的可将硝化速率降低79%[30]。此外,具有分泌BNI能力小麦的根际土硝化潜势降低了25%~45%。
Sun等对19种具有抑制硝化能力的水稻进行研究,并从中提取到1种新型的BNI——1,9-癸二醇。1,9-癸二醇是水稻根系分泌的天然物质,对灰土中硝化作用有明显的抑制能力,其主要通过抑制AMO活性来降低硝化作用,其抑制效果显著大于农牧业生产中普遍使用的硝化抑制剂DCD。但目前无法确定微生物是否能产生s-1,9-癸二醇,或是在某种程度上降解1,9-癸二醇。在水稻中,发现了与非洲湿生臂形牧草相似的编码生物硝化抑制剂的基因[40]。
2.3 生物硝化抑制剂分泌的因素影响
NI和BNI的有效性可能受到若干土壤和环境因素的影响。其中最重要的影响因素为以下几个方面:(1)抑制剂本身具有物理、化学特性(特别是其结构、C链长度和容易降解的官能团结构等),不同的抑制剂具有不同的水溶性和流动性,且被土壤矿物质和有机制吸附的程度也不同;(2)土壤物理性质(黏土含量、土壤类型)、化学性质(pH值)和微生物特性(微生物活性和多样性)等[41];(3)温度和土壤水分条件。环境因素会极大地影响抑制剂的持久性、降解性和有效性。例如,热带土壤的高温不仅增加了土壤硝化率,还增加了NI的降解率[42]。此外,土壤含水率不同对NI的降解和有效性的影响不同[43]。在土壤植物系统中,有大量的数据显示BNIs的存在及其作用机制。因此,加强对不同土壤类型和农业气候条件下,BNI在土壤-植物系统中的持久性和有效性研究,将有助于BNI在农业生态系统中的应用[44]。
氮素类型(铵态氮或者硝态氮)对植物根际分泌BNI有很大的影响。不同氮素形态下高粱分泌BNI的能力并不相同[33],张莹等通过pH值自动调节系统在pH值为3、7的沙培营养液中分别用铵态氮和硝态氮培养高粱幼苗,结果发现,硝态氮条件下培养的高粱BNI释放能力为 10 ATU/(g·d),而铵态氮处理下的高粱BNI释放能力为30 ATU/(g·d)[45]。植物根际释放BNI表现出很强的生理机能,这种生理机能与摄取铵态氮有关,例如随着铵态氮的摄入,质膜输入H+的活跃程度增加,根区被酸化,进而使根际BNI的分泌量提高。另外,根系分泌的BNI具有局部性特点,BNI的释放仅限于周围含有铵态氮的根际,而其他部分的根际则不释放BNI,这种局部性保证了在铵态氮活跃的根区常常伴有高浓度的BNI[46]。从铵态氮对BNI排放的影响出发,防止铵态氮被氨氧化微生物利用可以作为改善BNI能力的关键方法,此方法有待进一步研究。
根区pH值也会影响植物根际BNI的排放。最新研究表明,当pH值>7時,即使高粱在铵态氮含量很低的土壤环境下生长,根际也不会分泌BNI;当pH值=或≈7时,高粱根际近80%释放亲水型BNI的能力被抑制,当pH值为5~6时,高粱根际分泌BNI的活性最高;但BNI一旦被根际释放出来,就不会随着pH值改变而发生变化[6]。植物BNI的活性随着根系分泌氢离子浓度的增加而增强,这也许是植物在铵态氮营养下防止铵态氮被氧化的1种重要机制。可以通过调节土壤pH值来提高植物根际BNI的分泌能力;例如,黑土(pH值>7)有较强的缓冲能力,很难降解根际土壤的pH值[46],这样类型的土壤也许不适合高粱根际分泌BNI功能的表达,而具有低缓冲能力,适度的酸性土壤(pH值<6)更适合高粱BNI能力的表达[6]。也有研究表明,BNI可能是一类有机阴离子,所以根际pH值变化和BNI本身无关[39]。因此,是否可以通过改变土壤pH值来间接提高高粱分泌BNI的能力有待进一步研究。综上所述,从这些影响因素出发来提高植物分泌BNI的能力可能是提高氮素利用率的一种重要机制,相关研究还有待进一步深入。
3 生物硝化抑制剂与农业生态
据联合国粮食及农业组织(FAO)统计,在1950—1970年,世界粮食总产量增加近1倍,其中因谷物播种面积增加的产量占22%,因播种面积提高的产量占78%。西方及日本科学家一致认为,粮食增产有40%~65%是增加化肥的施用量引起的。随着农业生产的发展,我国的化肥施用量逐年增加,目前总量已居世界第1位[37]。1977—2005年,我国的粮食年产量从28 300万t增加到48 400万t,产量增加近71%;但是氮肥的施用量却从707 t增加到2 621 t,施用量增加了270.7%[31],而大量的氮肥施用往往伴随着氮素的流失和环境污染[47]。此外,大量复合肥的施用刺激了畜牧业的发展和化石燃料消费的增长,然而这也破坏了生物地球化学的氮循环,造成了地表水污染、酸雨、土壤酸化、温室气体排放等一系列的环境问题,同时也影响着人类健康[48-49]。因此,提出切实可行的农业减排措施对改善生态环境有重要意义。
生物硝化抑制剂可以在农业上降低硝化速率[38],虽然不能提高植物本身对氮的吸收能力,但延长了氮元素以铵态氮的形式在根际的停留时间,由于铵态氮的移动性比硝态氮低[50],所以生物硝化抑制剂也可为植物提供了更多的时间利用氮素,从而减少氮淋失和反硝化的总量[51-52]。Subbarao等研究了不同植物根际对硝化反应的影响,结果表明,与大豆的对照试验相比,非洲臂形草处理的N2O排放量减少了90%[34]。也有研究通过蔬菜田间试验来对比人工合成硝化抑制剂和生物硝化抑制剂对土壤排放N2O和CH4的影响,结果表明,尿素+化学硝化抑制剂(CP)和尿素+生物硝化抑制剂(BNI)这2个处理之间土壤的CH4排放量无显著性差异,但是N2O排放量每年分别降低16.5%、18.1%[11]。
4 生物硝化抑制剂的产业化生产和应用前景
生物硝化抑制剂能明显降低全球增温潜势和温室气体排放强度。与尿素处理相比,生物硝化抑制剂可使全球增温潜势和温室气体排放强度分别下降10.1%和17.6%。在比较人工合成硝化抑制剂和生物硝化抑制剂效果的热带稻田试验中,与施用尿素的处理相比,生物硝化抑制剂能降低全球增温潜势,而人工合成的硝化抑制剂能显著降低全球增温潜势[52]。
硝化和反硝化过程是硝态氮和NO、N2O产生的主要过程,因此抑制硝化作用的关键在于降低N2O的排放和硝态氮的产生。Philippot等发现,在一些存在生物硝化抑制能力的谷物和草类中,可以利用基因改良的方法(如标记辅助育种、代谢工程)使下一代拥有抑制硝化作用的能力[53]。有研究者成功地将高BNI表达能力的野生型小麦基因导入到无明显分泌BNI能力的栽培小麥中,使其获得了高BNI分泌能力[44]。这些研究使培育具有BNI分泌能力的下一代栽培品种成为可能。虽然此方法可能会对土壤氮排放量的降低产生重大影响,但外来带有不同性状位点的染色体可能会使基因改变,进而造成谷物的减产[44]。虽然关于BNI的应用和品种改良研究尚处于初级阶段,但利用已发现的生物硝化抑制剂来改良已有的化学合成抑制剂产品将会是今后1个重要的研究方向。Sun等在对水稻分泌BNI能力的研究中已经发现1种新型的抑制剂1,9-癸二醇[40],能否将这种抑制剂产业化生产还需进一步研究。
5 展望
随着对BNI研究的深入,越来越多的试验证明了多种植物根系具有分泌BNI的能力。目前,国内外对BNI的研究还停留在其来源、种类和作用等方面,而未来对BNI的研究,应用新技术、新方法,结合不同土壤生态系统和农业系统的特性,重点围绕以下几个方面展开:
(1)从保护环境出发,提供施用氮肥的新方法和范例[54]。把生物硝化抑制剂作为一种有效手段来抑制硝化作用,结合多种学科来研究水稻、高粱等禾本科植物根系分泌BNI的能力。
(2)利用分子生物学等手段,使已发现的生物硝化抑制剂分泌的功能基因在谷物系统中进行表达,降低农业系统中硝化作用。将农业生产在高硝化和低硝化生产系统中找到平衡,更好地对氮肥施用进行管理,从而在满足农业生产需求的同时调控农田土壤温室气体的排放。
(3)关于BNI对农田N2O的排放影响目前多停留在研究阶段,今后可对BNI的分子结构等进行系统性研究,为BNI提取及其产业化生产提供理论依据和切实可行的技术支持。
(4)目前所发现的对无机氮具有转化能力的异养微生物仅存在于一些硝化作用较弱的酸性森林土壤或含水率较高的土壤中,生物硝化抑制剂对异养微生物的硝化过程是否有抑制作用有待进一步研究。
(5)我国对于生物硝化抑制剂的研究才刚刚开始,作为农业大国,如何更好地处理氮肥使用所带来的环境污染问题一直备受关注。将生物硝化抑制剂更好地与我国农田系统相结合是今后重要的研究方向。我国谷物类农作物的生物硝化抑制功能也需要进一步研究,对于已经发现的高粱、水稻等作物的生物硝化抑制能力,如何更好利用现代技术,将其应用到我国的农业系统中也是今后研究的重点方向。
参考文献:
[1]Canfield D E,Glazer A N,Falkowski P G. The evolution and future of Earths nitrogen cycle[J]. Science,2010,330(6001):192-196.
[2]Dansgaard W,Johnsen S J,Clausen H B,et al. Evidence for general instability of past climate from a 250-kyr ice-core record[J]. Nature,1993,364(6434):218-220.
[3]Broadbent F,Rauschkolb R S. Nitrogen fertilization and water pollution[J]. California Agriculture,1977,31(5):24-25.
[4]Matson P A,Mcdowell W H,Townsend A R,et al. The globalization of N deposition:ecosystem consequences in tropical environments[J]. Biogeochemistry,1999,46(1/2/3):67-83.
[5]Galloway J N,Townsend A R,Erisman J W,et al. Transformation of the nitrogen cycle:recent trends,questions,and potential solutions[J]. Science,2008,320(5878):889-892.
[6]Subbarao G V,Sahrawat K L,Nakahara K,et al. Biological nitrification inhibition-a novel strategy to regulate nitrification in agricultural systems[J]. Advances in Agronomy,2012,114(1):249-301.
[7]Schlesinger W H. On the fate of anthropogenic nitrogen[J]. Proceedings of the National Academy of Sciences,2009,106(1):203-208.
[8]Liu J G,You L Z,Amini M,et al. A high-resolution assessment on global nitrogen flows in cropland[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(17):8035-8040.
[9]Tesfamariam T,Yoshinaga H,Deshpande S P,et al . Biological nitrification inhibition in sorghum:the role of sorgoleone production[J]. Plant & Soil,2014,379(1/2):325-335.
[10]Pjevac P,Schauberger C,Poghosyan L,et al. AmoA-targeted polymerase chain reaction primers for the specific detection and quantification of comammox nitrospira in the environment[J]. Frontiers in Microbiology,2017,275(3/4/5/6):26-31.
[11]王国强,孙焕明,彭 婧,等. 生物硝化抑制剂应用研究进展[J]. 安徽农业科学,2016,44(11):66-69,78.
[12]Scanlon B R,Jolly I,Sophocleous M,et al. Global impacts of conversions from natural to agricultural ecosystems on water resources:quantity versus quality[J]. Water Resources Research,2007,43(3):455-456.
[13]Alexander L,Allen S,Bindoff N L,et al. Climate change 2013:The physical science basis,in contribution of working group I(WGI) to the fifth assessment report(AR5) of the Intergovernmental Panel on Climate Change(IPCC)[M]. Cambridge:Cambridge University Press,2013:1535.
[14]Mosier A,Kroeze C,Nevison C,et al. Closing the global atmospheric N2O budget:nitrous oxide emissions through the agricultural nitrogen cycle[J]. Nutrient Cycling in Agroecosystems,1998,52(2/3):225-248.
[15]Raun W R,Johnson G V. Improving nitrogen use efficiency for cereal production[J]. Agronomy Journal,1999,91(3):357-363.
[16]張苗苗,沈菊培,贺纪正,等. 硝化抑制剂的微生物抑制机理及其应用[J]. 农业环境科学学报,2014,33(11):2077-2083.
[17]胡 军. 生物硝化抑制剂在农业中的应用效果研究[D]. 南京:南京农业大学,2014:25-30.
[18]Slangen J H G,Kerkhoff P. Nitrification inhibitors in agriculture and horticulture:a literature review[J]. Nutrient Cycling in Agroecosystems,1984,5(1):1-76.
[19]Munro P E. Inhibition of nitrifiers by grass root extracts[J]. Journal of Applied Ecology,1966,3(2):231-238.
[20]Cahalan E,Minet E,Ernfors M,et al. The effect of precipitation and application rate on dicyandiamide persistence and efficiency in two Irish grassland soils[J]. Soil Use and Management,2015,31(3):367-374.
[21]Subbarao G V,Yoshihashi T,Worthington M,et al. Suppression of soil nitrification by plants[J]. Plant Science,2015,233:155-164.
[22]Northup R R,Yu Z S,Dahlgren R A,et al. Polyphenol control of nitrogen release from pine litter[J]. Nature,1995,377:227-229.
[23]Subbarao G V,Nakahara K,Ishikawa T,et al. Free fatty acids from the pasture grass Brachiaria humidicola and one of their methyl esters as inhibitors of nitrification[J]. Plant and Soil,2008,313(1/2):89-99.
[24]Leininger S,Urich T,Schloter M,et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J]. Nature,2006,442(714):806-809.
[25]Subbarao G V,Ito O,Sahrawat K L,et al. Scope and strategies for regulation of nitrification in agricultural systems-challenges and opportunities[J]. Critical Reviews in Plant Sciences,2006,25(4):303-335.
[26]Boudsocq S,Niboyet A,Lata J C,et al. Plant preference for ammonium versus nitrate:a neglected determinant of ecosystem functioning[J]. The American Naturalist,2012,180(1):60-69.
[27]Byrnes R C,Nùez J,Arenas L,et al. Biological nitrification inhibition by Brachiaria grasses mitigates soil nitrous oxide emissions from bovine urine patches[J]. Soil Biology & Biochemistry,2017,107:156-163.
[28]Campos J L,Garrido-Fernandez J M,Mendez R,et al. Nitrification at high ammonia loading rates in an activated sludge unit[J]. Bioresource Technology,1999,68(2):141-148.
[29]Arp D J,Sayavedra-Soto L A,Hommes N G. Molecular biology and biochemistry of ammonia oxidation by Nitrosomonas europaea[J]. Archives of Microbiology,2002,178:250-255.
[30]Sullivan C A O,Fillery Ian R P,Roper M M,et al. Identification of several wheat landraces with biological nitrification inhibition capacity[J]. Plant Soil,2016,404:61-74.
[31]Walker C B,de la Torre J R,Klotz M G,et al. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea[J]. Proceedings of the National Academy of Sciences,2010,107(19):8818-8823.
[32]Hallam S J,Mincer T J,Schleper C,et al. Pathways of carbon assimilation and ammonia oxidation suggested by environmental genomic analyses of Marine Crenarchaeota[J]. PLoS Biology,2006,4(12):e95.
[33]Qiu H,Sun D,Gunatilake S R,et al. Analysis of trace dicyandiamide in stream water using solid phase extraction and liquid chromatography UV spectrometry[J]. Journal of Environmental Sciences,2015,35:38-42.
[34] Subbarao G V,Kishii M,Nakahara K,et al. Biological nitrification inhibition (BNI)-is there potential for genetic interventions in the Triticeae[J]. Breeding Science,2009,59(5):529-545.
[35]Coskun D,Britto D T,Shi W,et al. Nitrogen transformations in modern agriculture and the role of biological nitrification inhibition[J]. Nature Plants,2017(3):1-10.
[36]Subbarao G V,Nakahara K,Hurtado M D P,et al. Evidence for biological nitrification inhibition in Brachiaria pastures[J]. Proceedings of the National Academy of Sciences,2009,106(41):17302-17307.
[37]候亚红. 中国化肥的应用现状及合理施用[J]. 西藏农业科技,2005(1):20-23.
[38]Subbarao G V,Nakahara K,Ishikawa T,et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant & Soil,2013,366(1/2):243-259.
[39]周金泉. 高粱分泌生物硝化抑制物(MHPP)的机制及其对土壤N2O排放的影响[D]. 南京:南京农业大学,2015:52-53.
[40]Sun L,Lu Y,Yu F,et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. New Phytologist,2016,212(3):646-656.
[41]Gopalakrishnan S,Watanabe T,Stuart J P,et al. Biological nitrification inhibition by Brachiaria humidicola roots varies with soil type and inhibits nitrifying bacteria,but not other major soil microorganisms[J]. Soil Science & Plant Nutrition,2009,55(5):725-733.
[42]Sahrawat K L. Nitrification in some tropical soils[J]. Plant & Soil,1982,65(2):281-286.
[43]Fiedler S,Vepraskas M J,Richardson J L. Soil redox potential:importance,field measurements,and observations[J]. Advances in Agronomy,2007,94:1-54.
[44]Sahrawat K L. Nitrification in some tropical soils[J]. Plant & Soil,1982,65(2):281-286.
[45]张 莹,张明超,朱毅勇,等. 高粱在不同氮源处理下分泌生物硝化抑制剂的差异[J]. 土壤,2012,44(6):982-986.
[46]Burford J R,Sahrawat K L. Management of Vertisols for improved agricultural production: proceedings of an IBSRAM Inaugural Workshop[M]. Patancheru :International Crops Research Institute for the Semi-Arid Tropics,1989.
[47]Liu J G,Diamond J. Revolutionizing Chinas environmental protection[J]. Science,2008,319(5859):37-38.
[48]Jin X,Xu Q,Huang C. Current status and future tendency of lake eutrophication in China[J]. Science in China Series C Life Sciences,2005(48):948-954.
[49]Zhu Z,Xiong Z,Xing G. Impacts of population growth and economic development on the nitrogen cycle in Asia[J]. Science in China Series C Life Sciences,2005(48):729-737.
[50]Forde B G,Clarkson D T. Nitrate and ammonium nutrition of plants:physiological and molecular perspectives[J]. Advances in Botanical Research,1999(30):1-90.
[51]Vitousek P M,Matson P A. Mechanisms of nitrogen retention in forest ecosystems:a field experiment[J]. Science,1984,225(4657):51-53.
[52]曾后清,朱毅勇,王火焰,等. 生物硝化抑制剂——一种控制农田氮素流失的新策略[J]. 土壤学报,2012,49(2):382-388.
[53]Philippot L,Hallin S. Towards food,feed and energy crops mitigating climate change[J]. Trends in Plant Science,2011,16(9):476-480.
[54]Rockstrm J,Steffen W,Noone K,et al. A safe operating space for humanity[J]. Nature,2009,461:472-475.李夏瑩,陈 锐,刘鹏程,等. 转基因高通量检测技术研究进展[J]. 江苏农业科学,2019,47(1):27-30.

