HPLC法同时测定活血促愈胶囊中2种黄酮类和4种菲醌类成分的含量Δ
陈丹,李柯,卢茂芳,侯茜,李若存(1.湘潭医卫职业技术学院,湖南湘潭41110;.湖南省中医药研究院,长沙 41001;.湖南中医药大学药学院,长沙 41008)
活血促愈胶囊是由三七、积雪草、丹参、槐米等药材组成的中药6类新药,具有活血化瘀、消肿止痛的功效,临床用于急性软组织损伤及骨折[1-2]。其中,三七为方中君药,积雪草为臣药,丹参、槐米分别为佐药、使药。本课题组前期研究已建立了同时测定活血促愈胶囊中三七、积雪草中5种皂苷类成分含量的高效液相色谱法(HPLC)[3]。该方中丹参主要含有菲醌类成分(如丹参酮Ⅰ、丹参酮ⅡA、丹参酮ⅡB、隐丹参酮、二氢丹参酮Ⅰ等),为活血化瘀的活性成分;槐米中的黄酮类成分(如芦丁、槲皮素、山柰酚-3-O-芸香糖苷等)具有良好的消肿止痛作用,均为该方的主要活性成分[4]。为了进一步提高质量控制水平,本试验建立了同时测定该方中芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA等6种成分的HPLC法,现报道如下。
1 材料
1.1 仪器
LC-20AT型HPLC仪(包括LC-20AT型二元泵、SPD-20A型紫外检测器、7725i-049型手动进样器)、LabSolutions 6.50 SP1系列工作站(日本Shimadzu公司);XPE105型十万分之一电子分析天平(瑞士Mettler-Toledo公司);HX-06型超声波清洗器(武汉恒信世纪科技有限公司)。
1.2 药品、药材与试剂
活血促愈胶囊(湖南省中医药研究院制剂室自制,批号:20161210、20170305、20170312、20170319,规格:0.56 g/粒,人参皂苷Rg1含量:≥4.0mg/粒,丹参酮ⅡA含量:≥0.4 mg/粒);三七药材(批号:20160501、20160820、20161001、20161212)、积雪草药材(批号:20160612、20160911、20161105、20170110)、丹 参 药 材( 批 号 :20160515、20160725、20170118、20170126)、槐米药材(批号:20160501、20160911、20161212、20170104)均购自湖南上药九旺医药有限公司,经湖南省中医药研究院李若存研究员鉴定,三七为五加科植物三七[Panax notoginseng(Burk.)F.H.Chen]的干燥根和根茎、积雪草为伞形科植物积雪草[Centella asiatica(L.)Urb.]的干燥全草、丹参为唇形科植物丹参[Salvia miltiorrhiza Bge.]的干燥根和根茎、槐米为豆科植物槐[Sophora japonica L.]的干燥花蕾及花;芦丁对照品(批号:100080-200707,纯度:90.5%)购自中国食品药品检定研究院,山柰酚-3-O-芸香糖苷对照品(批号:MUST-17040507,纯度:98.16%)、二氢丹参酮Ⅰ对照品(批号:MUST-17032705,纯度:98.40%)、隐丹参酮对照品(批号:MUST-17030403,纯度:99.34%)、丹参酮Ⅰ对照品(批号:MUST-17030210,纯度:99.09%)、丹参酮ⅡA对照品(批号:MUST-17101811,纯度:99.33%)均购自成都曼思特生物科技有限公司;聚酰胺(30~60目,柱层析用,国药集团化学试剂有限公司,批号:20160118);乙腈为色谱纯,甲醇、乙醇均为分析纯,水为纯净水。
2 方法与结果
2.1 色谱条件
色谱柱:Welch Ultimate XB-C18(250 mm×4.6 mm,5 μm);以乙腈(A)-0.1%磷酸溶液(B)为流动相,梯度洗脱(0~10 min,15%A;10~30 min,15%A→21%A;30~60 min,21%A→75%A;60~75 min,75%A→15%A);流速:1.0 mL/min;柱温:20℃;检测波长:270 nm;进样量:10μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 取芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA对照品适量,分别置于25 mL量瓶中,加甲醇溶解并定容,摇匀,得芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA质量浓度分别为8 606.6、766.6、640.6、295.2、256.0、335.7 μg/mL的单一对照品贮备液。分别精密吸取上述各单一对照品贮备液1 mL,置于10 mL量瓶中,加甲醇定容,摇匀,得芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA质量浓度分别为 860.66、76.66、64.06、29.52、25.60、33.57 μg/mL的混合对照品溶液。
2.2.2 供试品溶液 取活血促愈胶囊内容物,研细(过三号筛),精密称取0.7 g,置于100 mL圆底烧瓶中,加甲醇50 mL,加热回流1 h,放冷,滤过,滤液蒸干,残渣加适量水溶解,上样于已处理好的聚酰胺柱(3 g,30~60目,内径1.2 cm),水洗脱至无色后,加乙醇洗脱,收集乙醇洗脱液30 mL,蒸干,残渣加甲醇溶解并定容至50 mL量瓶中,摇匀,用0.45 μm微孔滤膜滤过,作为供试品溶液。
2.2.3 阴性对照溶液 按样品的制备工艺和配方比例,分别制备缺丹参药材、缺槐米药材的阴性样品,再按“2.2.2”项下方法分别制成缺丹参药材和缺槐米药材的阴性对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各10 μL,按“2.1”项下色谱条件进样测定,记录色谱图。结果,在该色谱条件下,各待测成分之间、待测成分与杂质峰之间得到分离,6种成分的分离度>1.5,理论板数以芦丁计均大于5 000,详见图1。
2.4 线性关系考察
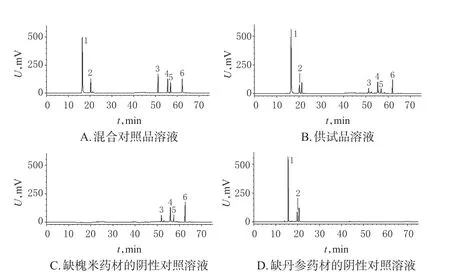
图1 高效液相色谱图Fig 1 HPLC chromatograms
精密量取“2.2.1”项下混合对照品溶液0.2、0.4、0.6、0.8、1.0 mL,分别置于1 mL量瓶中,加甲醇定容,摇匀,即得系列混合对照品溶液。精密量取上述混合对照品溶液各10 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,线性关系考察结果见表1。

表1 线性关系考察结果Tab 1 Results of linear range investigation
2.5 检测限与定量限考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件进样测定,记录峰面积。当信噪比为3∶1时,得检测限;当信噪比为10∶1时,得定量限。结果,芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的检测限分别为0.08、0.01、0.01、0.01、0.01、0.01 μg/mL,定量限分别为 0.27、0.02、0.03、0.03、0.03、0.03 μg/mL。
2.6 精密度试验
取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA峰面积的RSD分别为0.78%、1.22%、1.67%、1.87%、1.92%、1.16%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(批号:20161210)适量,分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA峰面积的RSD分别为1.32%、1.25%、1.64%、1.98%、1.51%、1.49%(n=6),表明供试品溶液在室温下放置24h内基本稳定。
2.8 重复性试验
取样品(批号:20161210)适量,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品含量。结果,芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的平均含量分别为37.82、1.93、1.03、1.18、0.50、1.07 mg/g,RSD 分别为 1.57%、1.92%、1.20%、1.41%、1.64%、1.09%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取已知含量样品(批号:20161210)适量,共6份,分别加入芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA对照品溶液[此溶液的浓度是根据取样量中该成分的含量,按质量比1∶1配制],按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
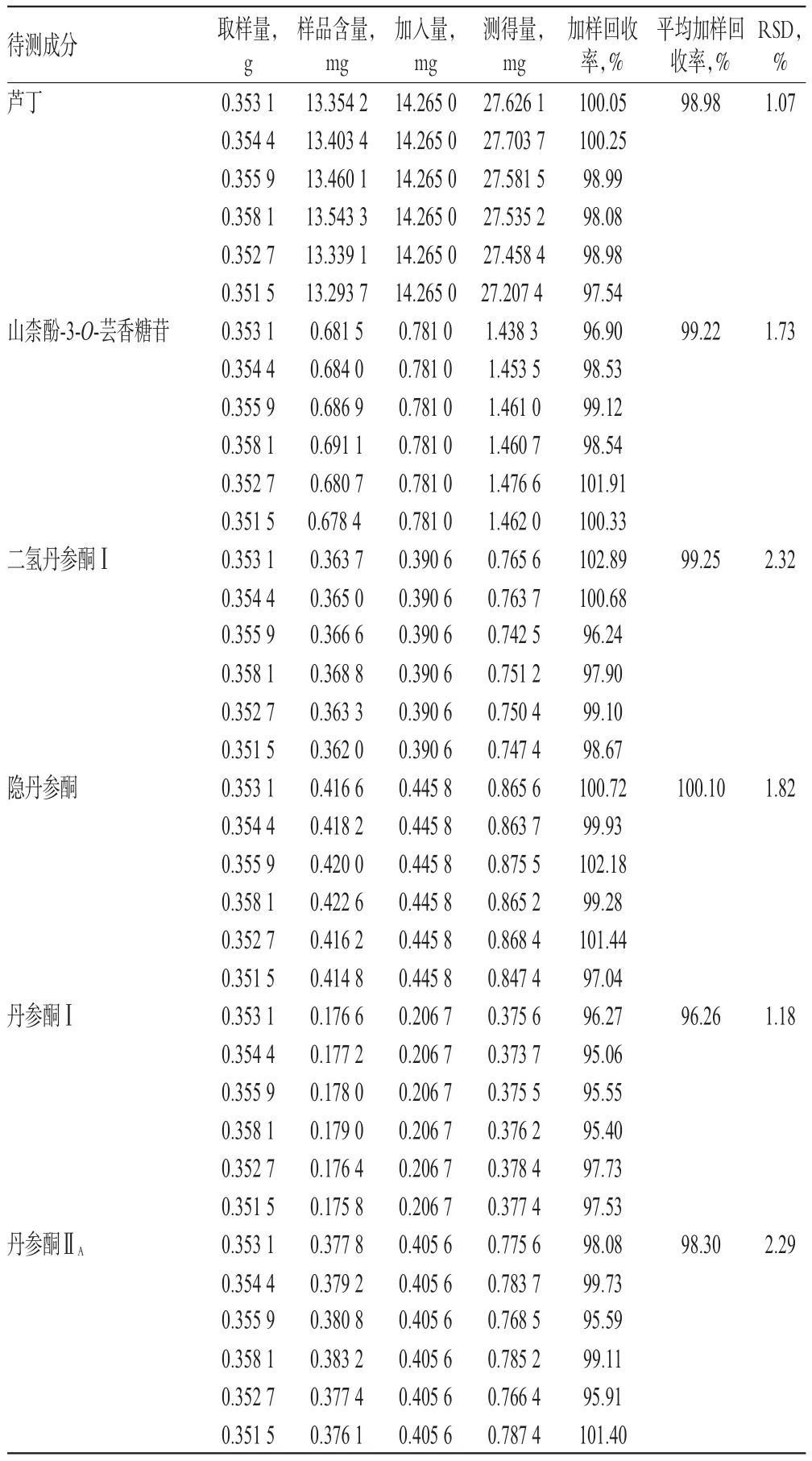
表2 加样回收率试验结果(n=6)Tab 2Results of recovery tests(n=6)
2.10 耐用性试验
2.10.1 色谱柱考察 取样品(批号:20161210)适量,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件[色谱柱分别为Welch Ultimate XB-C18(250 mm×4.6 mm,5 μm)、Kromasil 100-5-C18(250 mm×4.6 mm,5 μm)、TECHI C18(250 mm×4.6 mm,5 μm)]进样测定,记录峰面积并按外标法计算样品含量,结果见表3。结果表明,当色谱柱发生一定程度波动时,本法能满足试验要求,提示其耐用性良好。
2.10.2 柱温考察 取样品(批号:20161210)适量,按

表3 耐用性试验结果Tab 3 Results of durability tests
“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件(柱温分别为18、20、22℃)进样测定,记录峰面积并按外标法计算样品含量,结果见表3。结果表明,当柱温发生一定程度波动时,本法能满足试验要求,提示其耐用性良好。
2.11 样品含量测定
取4批样品适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,平行测定3次,记录峰面积并按外标法计算样品含量,结果见表4。
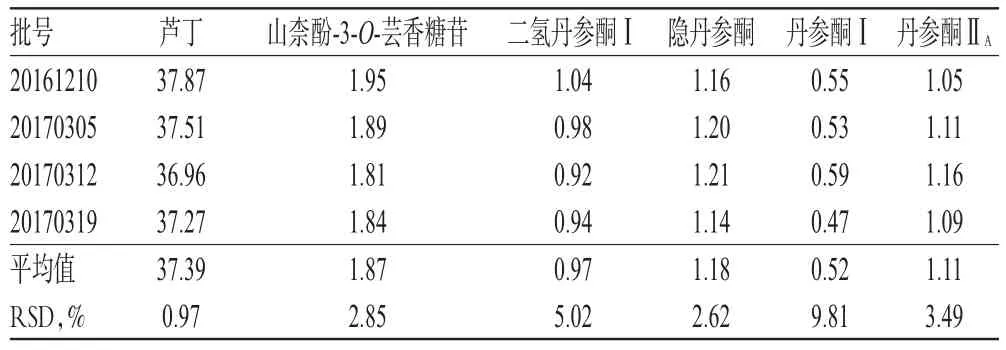
表4 样品含量测定结果(n=3,mg/g)Tab 4Results of content determination of samples(n=3,mg/g)
3 讨论
以2015年版《中国药典》(一部)丹参、槐米含量测定项下方法[5]为基础,结合文献方法[6-12]同时测定了芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA等6种成分的含量。
3.1 测定成分的选择
本方中丹参为佐药、槐米为使药。研究表明,丹参所含的二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA均为菲醌类成分,均能明显提高骨折愈合区和成骨细胞数目,能阻止白细胞过度的游出和聚集,防止溶酶体酶、氧化代谢产物等过多的释放,减轻组织损伤,可控制炎症的发生;对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌和β-内酰胺酶阳性的金黄色葡萄球菌有较强抑菌作用,其中隐丹参酮作用最强[13-15]。槐米所含的芦丁、山柰酚-3-O-芸香糖苷均为黄酮类成分,其中芦丁能降低毛细血管的异常通透性、脆性,能维持血管抵抗力,可用于出血症的治疗和预防;山柰酚-3-O-芸香糖苷能抑制血管平滑肌细胞的增殖和迁移,为活血化瘀的有效成分[16]。
本处方中4味药材所含主要活性成分是皂苷类、菲醌类及黄酮类。本课题组前期已对三七、积雪草中皂苷类成分的定量测定进行研究;二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA是丹参中的主要成分,2015年版《中国药典》(一部)丹参含量测定的指标就是丹参酮类[5];芦丁是槐米的含量测定指标[5],山柰酚-3-O-芸香糖苷为槐米中的另一主要黄酮类成分[17]。因此,最终选择芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA等6种成分进行含量测定。
3.2 检测波长的选择
本研究前期分别对芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA等6种成分进行紫外扫描。结果,芦丁的最大吸收波长为257 nm,山柰酚-3-O-芸香糖苷的最大吸收波长为344 nm,丹参酮ⅡA与隐丹参酮的最大吸收波长为270 nm,二氢丹参酮Ⅰ的最大吸收波长为240 nm,丹参酮Ⅰ的最大吸收波长为245 nm,各成分最大吸收波长各不相同,故选择相差较大的3个波长(245、270、344 nm),对同一供试品进行测定,对基线、分离度、理论板数和各成分含量进行综合评价。结果,在上述波长下检测,各色谱峰均能达到基线分离,分离度均大于1.5,柱效好;在270 nm波长下检测时,各成分含量均较高,故最终选择270 nm作为检测波长。
3.3 流动相的筛选
本研究前期参照2015年版《中国药典》(一部)丹参含量测定项下的流动相[5],比较了乙腈-水、乙腈-0.02%磷酸溶液、乙腈-0.1%磷酸溶液的分离效果。结果,以乙腈-0.1%磷酸溶液为流动相的色谱峰分离度及峰形最好。经反复摸索,本研究最终选定了上述流动相梯度,结果6种成分均能得到较好的分离。
3.4 供试品溶液制备方法的选择
丹参中脂溶性成分主要为菲醌类化合物,槐米中则主要含黄酮类化合物。本研究前期参照2015年版《中国药典》(一部)丹参与槐米药材含量测定项下的方法[5],采用甲醇超声处理,超声提取液直接进样分析。结果,提取液中成分复杂,呈现出多个色谱峰,且待测成分与相邻色谱峰无法实现基线分离。因此,依据黄酮类、菲醌类化合物与聚酰胺形成氢键缔合而产生吸附的特性,采用聚酰胺柱对供试品进行分离、纯化[18-19]。本研究前期对聚酰胺的用量、色谱柱内径及长度、洗脱剂的种类及用量等进行了筛选。结果发现,选用聚酰胺柱(3 g,30~60目,内径1.2 cm)、以乙醇30 mL进行洗脱时,供试品溶液色谱图中的杂质峰较少,各色谱峰分离度均大于1.5,因此最终选择此法作为本品供试液的制备方法。
3.5 含量测定结果分析
由表4可知,每批成品中黄酮类成分的含量均高于菲醌类成分,均以芦丁含量最高,且芦丁批间差异最小,RSD为0.97%,山柰酚-3-O-芸香糖苷含量的RSD为2.85%,说明黄酮类化合物较稳定。丹参中4种菲醌类成分含量批间差异较大,尤其是二氢丹参酮Ⅰ和丹参酮Ⅰ(RSD分别为5.02%和9.81%),且丹参酮Ⅰ含量最低。由于不同来源的丹参药材及饮片中丹参酮类成分含量差异明显,因此有必要对丹参的来源进行严格控制。
综上所述,本研究所建立的HPLC法灵敏、快速、操作简便、重复性好,可用于活血促愈胶囊中芦丁、山柰酚-3-O-芸香糖苷、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA含量的同时测定。

