bZIP转录因子在植物生长发育及非生物逆境响应的作用
刘慧洁,徐 恒,邱文怡,李晓芳,3,张 华,朱 英,李春寿,王良超,*
(1.浙江师范大学 化学与生命科学学院,浙江 金华321004; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江省有害生物防控国家重点实验室培育基地,浙江 杭州310021; 3.河北师范大学 生命科学学院,河北 石家庄050000; 4.浙江省农业科学院 作物与核技术利用研究所,浙江 杭州 310021)
在植物的种子萌发、休眠、衰老以及花发育等生物学过程中,不同的基因具有不同的时空表达特性,它们的表达受到转录因子的精确调控;在植物生长发育过程中,它们无时无刻不面临着环境中非生物逆境的影响,包括高温、低温、干旱等。这些不利因素往往会造成植物生长发育减缓甚至死亡,从而导致农作物减产。庆幸的是在进化过程中,植物获得了多种响应或抵抗逆境的能力,其中利用转录因子调控逆境相关基因的表达,从而能快速地响应、克服这些不利因素是最重要的一种防御机制。碱性亮氨酸拉链(basic leucine zipper,bZIP)转录因子家族在植物生长发育和非生物胁迫响应的过程中均扮演着非常重要的角色,本文着重对bZIP转录因子家族在这两方面的最新研究进展进行了综述,旨在为相关研究提供参考。
1 bZIP转录因子的结构特征
bZIP转录因子家族都具有一个高度保守的bZIP结构域,为60~80个氨基酸。它由两部分组成:高度保守的结合DNA的碱性区和多变的亮氨酸拉链区[1]。碱性区的序列特征是含有一个不变的N-x7-R/K的基序,其功能是识别启动子上的特定序列并与之结合;亮氨酸拉链区则是由1个或多个重复区组成,每个重复区含有7个氨基酸残基,其中亮氨酸位于第七位,其余的则包含一些疏水氨基酸,比如异亮氨酸、缬氨酸、甲硫氨酸;该区域具有寡聚功能,bZIP转录因子通过亮氨酸区形成同源或异源二聚体后,可以行使转录激活或抑制功能。
2 bZIP转录因子的分布与分类
bZIP转录因子在动植物中广泛存在且数量较多。数据显示,双子叶植物拟南芥中有75个bZIP转录因子,约为人类、蠕虫和酵母数量的4倍[2],单子叶模式植物水稻则更多一些,有86个bZIP转录因子[3]。由此可见,植物中的bZIP转录因子的家族成员在数量上占很大的比重。
早期Jakoby等[4]利用MEME(multiple em for motif elicitation)分析工具,主要按照bZIP转录因子碱性区的特性对拟南芥的75个bZIP转录因子进行分类,主要分为:A、B、C、D、E、F、G、H、I和S共10个亚家族。Liao等[5]根据bZIP转录因子的结构特征及拟南芥bZIP转录因子的分类法,将大豆的131个bZIP类转录因子也分成了10个亚家族。随着生物信息学的进步,Corrêa等[6]利用Neighbour-Joining分类法,以最短的bZIP基序(含44个氨基酸残基)为基准,对已经测序的几个被子植物拟南芥、水稻和美国黑杨的bZIP转录因子家族进行了重新分类,在原有的几个类别之外,又进一步细分得到了J、K、L三个新的bZIP类别。最近Zhang等[7]利用专业的生物信息学软件MEGA6.0(Neighbour-Joining法),FastTree 2.1.7将大豆的160个bZIP转录因子分成了12个亚家族,比之前Corrêa等[6]的分类少了L组。Zhao等[8]用类似的方法将苹果(MalusdomesticaBorkh)的112个bZIP转录因子家族分成了11个亚家族,少了K、L这两个亚家族。随着生物信息学的进步,bZIP转录因子的分类也越来越精细和科学。
3 bZIP转录因子的功能研究
在植物中,bZIP转录因子在多种生物学过程中充当着重要的角色,下面就bZIP转录因子在植物的生长发育和非生物胁迫调控(表1)等过程中的作用进行概述。
3.1 bZIP转录因子与植物生长发育
诸多研究发现,bZIP类转录因子在植株的生长发育,包括种子成熟、萌发及花的发育等过程中有着重要的作用。水稻花药特异表达基因OsTGA10/OsbZIP74,其表达受到花分化相关基因OsMADS8的直接调控,突变体ostga10表现为绒毡层发育不良,雄性不育;生化实验表明,OsTGA10与绒毡层相关蛋白TIP2、TDR存在相互作用,同时也调控AP25和MTR1的表达,从而参与花药及绒毡层的分化及发育[9]。拟南芥AtbZIP18与AtbZIP34、AtbZIP52及AtbZIP61在酵母中互作,并一同参与了花粉的发育,突变体atbzip18及atbzip34的少量花粉均无法形成正常的花粉壁[10-11]。bZIP蛋白也参与植物根的生长发育。拟南芥AtbZIP29通过调控根尖分身组织细胞中细胞壁形成相关基因的表达,从而影响根的生长发育[12]。玉米ZmbZIP4过表达能显著促进根的生长发育,染色质免疫共沉淀显示ZmbZIP4能直接结合ZmLRP1、ZmSCR等根发育相关基因的启动子并促进其转录[13]。在单子叶植物中,胚乳特异性表达的bZIP转录因子是种子发育过程的重要参与者,如水稻OsbZIP58基因与6个淀粉合成基因的启动子相互作用,并调控其表达,突变体osbzip58的胚乳中总淀粉及直连淀粉的含量降低,而支链淀粉中短链含量增高,中长链分支降低[14]。玉米bZIP转录因子O2(Opaque-2)通过调控ZmbZIP17以及糊粉层发育相关基因ZmNKD2(NAKEDENDOSPERM2)的表达参与胚乳细胞分化及储藏物质形成,后两者还能与O2一道共同激活其他受O2调控的目的基因的转录[15]。玉米ZmbZIP22能直接结合27KD-Y玉米胶蛋白基因的启动子并促进其表达,从而促进玉米胚乳蛋白体的形成[16]。bZIP蛋白也参与马铃薯块茎淀粉的积累,在马铃薯中过表达拟南芥ABF4能显著地提高块茎产量,并且能够抑制块茎萌发,提高块茎的加工和储藏品质[17-18]。
表1 已知与植物生长发育与非生物逆境响应相关的bZIP转录因子及功能
Table 1 bZIP transcription factors involved in plant growth development and abiotic stress response
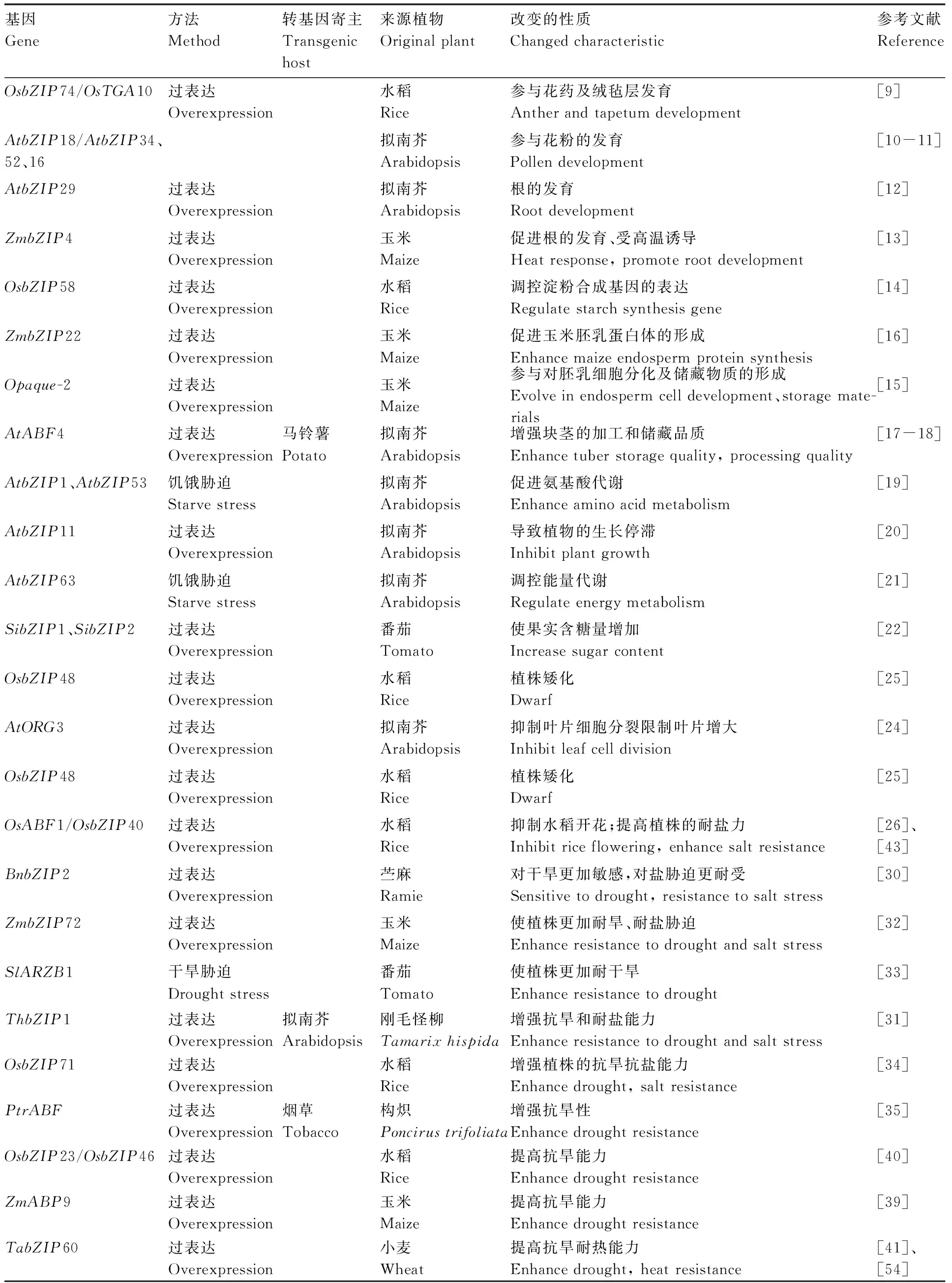
基因Gene方法Method转基因寄主Transgenichost来源植物Original plant改变的性质Changed characteristic参考文献ReferenceOsbZIP74/OsTGA10过表达Overexpression水稻Rice参与花药及绒毡层发育Anther and tapetum development[9]AtbZIP18/AtbZIP34、52、16拟南芥Arabidopsis参与花粉的发育Pollen development[10-11]AtbZIP29过表达Overexpression拟南芥Arabidopsis根的发育Root development [12]ZmbZIP4过表达Overexpression玉米Maize促进根的发育、受高温诱导Heat response, promote root development[13]OsbZIP58过表达Overexpression水稻Rice调控淀粉合成基因的表达Regulate starch synthesis gene[14]ZmbZIP22过表达Overexpression玉米Maize促进玉米胚乳蛋白体的形成Enhance maize endosperm protein synthesis [16]Opaque-2过表达Overexpression玉米Maize参与对胚乳细胞分化及储藏物质的形成Evolve in endosperm cell development、storage mate-rials[15]AtABF4过表达Overexpression马铃薯Potato拟南芥Arabidopsis增强块茎的加工和储藏品质Enhance tuber storage quality, processing quality[17-18]AtbZIP1、AtbZIP53饥饿胁迫Starve stress拟南芥Arabidopsis促进氨基酸代谢Enhance amino acid metabolism[19]AtbZIP11过表达Overexpression拟南芥Arabidopsis导致植物的生长停滞Inhibit plant growth[20]AtbZIP63饥饿胁迫Starve stress拟南芥Arabidopsis调控能量代谢Regulate energy metabolism[21]SibZIP1、SibZIP2过表达Overexpression番茄Tomato使果实含糖量增加Increase sugar content[22]OsbZIP48过表达Overexpression水稻Rice植株矮化Dwarf[25]AtORG3过表达Overexpression拟南芥Arabidopsis抑制叶片细胞分裂限制叶片增大Inhibit leaf cell division[24]OsbZIP48过表达Overexpression水稻Rice植株矮化Dwarf[25]OsABF1/OsbZIP40过表达Overexpression水稻Rice抑制水稻开花;提高植株的耐盐力Inhibit rice flowering, enhance salt resistance[26]、[43]BnbZIP2过表达Overexpression苎麻Ramie对干旱更加敏感,对盐胁迫更耐受Sensitive to drought, resistance to salt stress[30]ZmbZIP72过表达Overexpression玉米Maize使植株更加耐旱、耐盐胁迫Enhance resistance to drought and salt stress[32]SlARZB1干旱胁迫 Drought stress番茄Tomato使植株更加耐干旱Enhance resistance to drought[33]ThbZIP1过表达Overexpression拟南芥Arabidopsis刚毛怪柳Tamarix hispida增强抗旱和耐盐能力Enhance resistance to drought and salt stress[31]OsbZIP71过表达Overexpression水稻Rice增强植株的抗旱抗盐能力Enhance drought, salt resistance[34]PtrABF过表达Overexpression烟草Tobacco构炽Poncirus trifoliata增强抗旱性Enhance drought resistance[35]OsbZIP23/OsbZIP46过表达Overexpression水稻Rice提高抗旱能力Enhance drought resistance[40]ZmABP9过表达Overexpression玉米Maize提高抗旱能力Enhance drought resistance[39]TabZIP60过表达Overexpression小麦Wheat提高抗旱耐热能力Enhance drought, heat resistance[41]、[54]
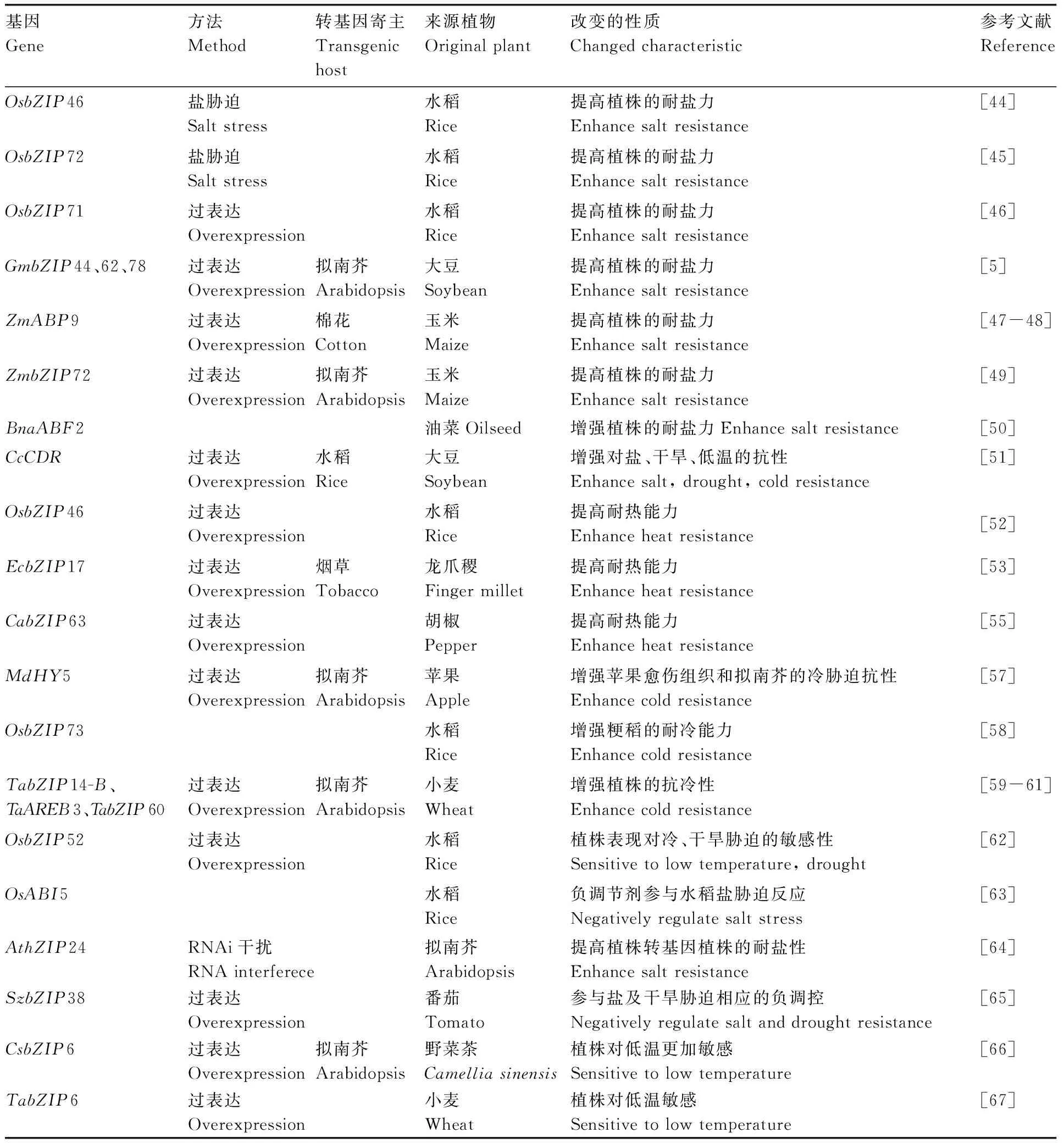
续表1
植物生长发育是一个包括能量的吸收、存储以及再分配的过程。植物应对胁迫的抗性反应是个消耗能量的过程,如何平衡生长发育和抗性反应对植物来说非常重要,研究发现,植物可以通过调控bZIP转录因子来平衡这两个过程。拟南芥AtbZIP1、AtbZIP53、AtbZIP11、AtbZIP63是调控植物能量代谢的关键因子。在缺乏碳源的情况下,AtbZIP1和AtbZIP53形成异源二聚体,直接调控氨基酸代谢关键基因天冬酰胺合酶,脯氨酸脱氢酶的表达[19],植物以氨基酸为碳源进行能量代谢;AtbZIP11的表达能导致代谢的改变,显著促进海藻糖、肌醇、蜜三糖等小分子碳水化合物代谢相关基因的表达,降低6-磷酸海藻糖的积累,后者是生长促进因子,导致植株出现生长停滞[20]。AtbZIP63可以与AtbZIP1、AtbZIP11分别形成异源二聚体。AtbZIP63具有3个可以磷酸化的丝氨酸位点,其磷酸化受AtSnRK1家族控制。在饥饿胁迫下,糖类碳源减少,SnRK1对AtbZIP63的磷酸化程度加深,AtbZIP63倾向于与AtbZIP1形成异源二聚体,开启以氨基酸为碳源的代谢途径;而当细胞中存在蔗糖时,SnRK1对Atbzip63的磷酸化减弱,后者则更多的与AtbZIP11结合[21]。利用以上研究结果,Sagor等[22]从番茄(Solanumlycopersicum)中克隆了AtbZIP11的两个同源基因SibZIP1和SibZIP2,通过果实特异表达启动子E8分别驱动表达不包含SIRT(蔗糖诱导抑制翻译框)的剪切体,获得了较野生型番茄含糖量增加1.5倍的转基因果实,而且还没有其他的副作用。这些研究表明,通过调控bZIP转录因子改良作物品质完全可行。
植物bZIP转录因子在植物的生长发育过程也扮演着负调控因子的角色。拟南芥AtbZIP11通过激活根生长发育负调控因子IAA3/SHY2的转录,后者能高效抑制生长素运输促进基因家族PIN-FORMED(PIN)的表达,导致生长素无法运输至根尖分生组织,最终致使根生长发育迟滞[23]。拟南芥bZIP基因AtORG3通过抑制叶片细胞分裂限制叶片增大[24]。水稻OsbZIP48能抑制OsKO2的表达,该基因编码赤霉素合成相关蛋白贝壳杉烯氧化酶2,过表达OsbZIP48导致赤霉素合成降低植株矮化[25]。水稻ABF1,及其同源基因OsbZIP40抑制水稻开花,OsABF1促进其目标基因OsWRKY104的转录,后者直接抑制OsEhd1(Earlyheadingdate1)的表达从而推迟水稻花原基的分化,导致水稻开花推迟;相反,通过RNAi抑制OsABF1及OsbZIP40的表达则能显著提高OsEhd1的表达,从而促使水稻提前开花[26],该调控通路主要由干旱信号诱导独立于光及温度。bZIP转录因子参与ABA抑制种子萌发的过程,拟南芥ABI3、ABI5能与DELLA蛋白形成转录复合物诱导SOMNUS表达,后者抑制拟南芥种子的萌发[27]。ABA在种子发育后期诱导晚期胚胎发生丰富基因(LEA)的表达,这些基因调控渗透调节物质的积累,ABA也阻碍种子的萌芽、生长,同时分析ABI5突变体植株的表型,发现该突变体的幼苗生长和种子萌发均受到抑制[28]。bZIP转录因子与ABA及对种子萌发抑制的研究也为通过操纵bZIP转录因子提高粮食的储存品质提供了参考。
3.2 bZIP转录因子与非生物胁迫
在植物生长发育过程中会遭遇各种各样的逆境胁迫,包括干旱、低温、高盐等。面对胁迫,植物会在生理、生化及分子水平上迅速作出响应,即诱导非生物胁迫相关基因的表达进而改变生理生化过程来抵御各种环境胁迫带来的影响[29]。在这其中转录因子通过与其启动子区域中的顺式元件特异性结合进而调控逆境相关基因的表达是最主要的调控机制之一,植物bZIP类转录因子就是这一过程的重要参与者。
3.2.1 bZIP转录因子与干旱胁迫
水分是植物生长过程中不可或缺的环境因子,干旱是威胁植物生长发育的头号不利环境因素。在种子萌发和植物发育过程中,过表达苎麻BnbZIP2的转基因拟南芥植物对干旱更敏感,对盐胁迫的耐受性高于野生型[30]。此外,在拟南芥中过量表达刚毛怪柳ThbZIP1能显著增强转基因植物对干旱和盐胁迫的抗性[31],过表达玉米ZmbZIP72赋予转基因拟南芥优异的抗旱和耐盐性[32]。Hsieh等[33]研究发现,干旱处理SlAREB1转基因番茄和野生型对照,3周后转基因植株表型正常,而野生型的叶子呈萎蔫和卷曲状。水稻OsbZIP71能够直接结合OsNHX1和COR413-TM1两个非生物逆境相关基因的启动子并激活转录,从而增强植株的抗旱抗盐能力[34]。在烟草中过表达枸枳(PoncirustrifoliataL.)PtrABF能稳定地促进烟草中9个胁迫响应基因的表达,并且在干旱胁迫下显著诱导表达3个抗氧化物酶基因,从而能更好地清除活性氧自由基,进而增强了转基因植株对干旱的抗性[35]。水稻ABF1的插入突变体abf1-1对干旱敏感,在水稻中过表达ABF1则能显著增强转基因水稻的抗旱能力,RNA-Seq及染色质免疫共沉淀鉴定的ABF1目标基因中共有242个与干旱响应相关,ABF1直接调控蛋白磷酸酶2C家族的OsPP48、OsPP108,bZIP家族的bZIP23、bZIP46、bZIP72的表达,表明ABF1通过调控ABA途径参与对水稻的干旱响应[36]。有趣的是,OsbZIP23的同源基因OsbZIP46,同样参与ABA信号的正调控,然而由于结构特性,该蛋白的D结构域对其自身转录激活功能具有抑制作用,因而过表达完整蛋白并不能增强植物的抗干旱能力,但是过表达缺失D结构域的剪切体,能诱导抗性相关基因的表达,从而使植株的抗旱能力增强[37]。此外,在植物中过表达玉米ABP9[38]、拟南芥ABF3[39]、水稻OsbZIP23[40]、小麦TabZIP60[41]等,转录因子均能显著地提高转基因植株的抗旱能力。这些研究不仅仅证明了植物bZIP基因在植物抗旱响应过程中的重要作用,也为我们通过这些转录因子改良作物的抗旱能力提供了参考。
3.2.2 bZIP转录因子与盐胁迫
在植物生长发育中,盐分同样是不可或缺的生存条件,当生存环境中的盐浓度高于植株所承受的范围时,会导致植物生长发育受阻甚至死亡。研究表明,高盐胁迫下,在植物的生理生化过程中bZIP转录因子起着积极的作用,从而使得植物获得较高的耐盐能力。在耐盐和敏感型水稻中bZIP转录因子OsBZ8有着不同程度的表达情况,研究发现,在ABA处理下,OsBZ8 基因表达量明显增强,当对水稻进行高盐处理后,在籼稻中OsBZ8在耐盐品种的表达明显高于盐敏感的品种[42],OsbZIP12(OsABF1)、OsbZIP46(OsABF2)和OsbZIP72在盐胁迫下强烈诱导表达[43-45]。水稻OsbZIP71虽然在酵母和水稻原生质体中不具有转录活性,但是它在酵母中能形成同源二聚体,也可以与C类bZIP转录因子形成异源二聚体,在水稻中过表达OsbZIP71能显著增强转基因水稻的抗盐能力[46]。此外,大豆GmbZIP44、GmbZIP62和GmbZIP78基因能显著提高转基因拟南芥的耐盐性[5]。研究显示,玉米bZIP基因ABP9[47]和ZmbZIP72能够使植株获得较高的耐盐能力,Wang等[48]在棉花中表达玉米ABP9,Ying等[49]在拟南芥中表达ZmbZIP72转录因子,均能显著提高转基因植株的抗盐能力。在高盐胁迫下,与野生型水稻植物相比,OsABF1突变体Osabf1-1和Osabf1-2[43]表现地更为敏感。油菜(BrassicanapusL.)bZIP转录因子BnaABF2通过ABA途径增强植株的耐盐能力[50]。Sunitha等[51]在水稻中过表达木豆CcCDR(cold and drought regulatory protein)增强了水稻对盐、干旱、低温等众多胁迫的抗性。众多bZIP基因能显著地增强植物的抗盐能力,使得bZIP基因家族成为一个提高作物抗盐害特性的基因宝库,利用bZIP转录因子改良作物抗盐品质大有可为。
3.2.3 bZIP转录因子与高温胁迫
当植物所处的环境温度高于其最适生长温度时,就会对植物的生长发育产生不良影响,这就是高温胁迫。植物在抽穗期遭遇高温胁迫会使植株的开花发生异常,而且会造成低结实率的现象。研究表明,bZIP转录因子在植物高温胁迫的途径扮演着不可或缺的部分。玉米bZIP转录因子ZmBZIP4表达受高温诱导[14];在水稻中同时过表达OsbZIP46、CA1和蛋白激酶OsSAPK6与单独过表达其中一个的转基因植株表现出了更好的抗热能力[52]。过表达龙爪稷(EleusinecoracanaL.)转录因子EcbZIP17的转基因烟草,在适温及高温胁迫下在长势、种子产量等各方面的表现均较野生型有优势[53]。进一步的生理生化分析表明,在适温下EcbZIP17通过油菜素内酯(BR)途径促进转基因烟草的生长发育;在胁迫条件下其能激活内质网胁迫响应基因Bip、PDIL及CRT1等的表达从而增强植株抗逆能力。在拟南芥中过表达小麦(Triticumaestivum)TabZIP60也能通过激活内质网胁迫响应增强转基因植株的抗热能力[54]。胡椒(Capsicumannuum)CabZIP63与CaWRKY40存在相互作用,并且能够相互促进表达,形成一个正反馈回路,共同促进下游抗高温高湿响应基因的表达从而提高植物的高温耐性[55]。
3.2.4 bZIP转录因子与低温胁迫
当植物所处的环境温度低于其最适生长温度时,就会使得植株生长缓慢,甚至会造成植株生理机制的伤害,有时会直接导致植株死亡,这就是低温胁迫。植物响应低温胁迫主要通过ICE-CBF-COR途径,植物感受低温后由ICE(inducer of CBF expression)诱导CBFs(C-repeat-binding Factors)表达,后者则能识别位于COR(cold regulated genes)启动子上的CRT/DRE(C-repeat/dehydration responsive element)结合激活基因转录增强植株冷胁迫抗性[56]。bZIP类转录因子在调控植物冷胁迫响应中也同样扮演了不可或缺的角色。苹果(Malus×domestica)bZIP转录因子MdHY5在转录和蛋白两个水平上都对冷胁迫存在响应,过表达MdHY5能显著增强苹果愈伤组织和转基因拟南芥的冷胁迫抗性,电泳迁移率变动分析(electrophoretic mobility shift assay,EMSA)表明,MdHY5能直接结合MdCBF1启动子上的G-Box促进其转录,并且MdHY5还能调控不依赖于CBF的COR基因的表达[57]。Liu等[58]鉴定到水稻中一共有8个bZIP基因OsbZIP08、OsbZIP35、OsbZIP38、OsbZIP46、OsbZIP63、OsbZIP72、OsbZIP73和OsbZIP76与苗期低温抗性相关,其中bZIP73在粳稻和籼稻中存在一个单碱基差异,导致一个氨基酸变异(+171 aa,Glu>Lys);并且通过进一步的基因组地域足迹分析表明,OsbZIP73有明显的地域分布特性,北方低温区均为粳稻背景,而南方低温区则主要为籼稻背景,表明OsbZIP73参与了早期粳稻耐冷驯化的选择。生化实验表明,OsbZIP73与OsbZIP71相互作用,后者能增强OsbZIP73的活性,从而降低低温胁迫下细胞内ROS、ABA水平,进而增强粳稻的耐冷能力。在拟南芥中过表达小麦TabZIP14-B、TaAREB3、TabZIP60均能显著增强植株抵抗冷胁迫的能力,转录分析表明,转基因植株的逆境响应基因大范围上调表达,此外转基因植株对ABA比野生型敏感,表明TabZIP14-B、TaAREB3均是通过ABA途径来增强植株的抗冷能力[59-61]。
3.2.5 bZIP转录因子在非生物胁迫中的负调控作用
除了上述提到的bZIP转录因子在非生物胁迫中起着正调控作用之外,还有一些bZIP转录因子起着负调控作用。OsbZIP52过表达株系对冷和干旱胁迫均较野生型敏感,qRT-PCR结果表明,转基因植株中OsLEA3、OsTPP1、Rab25等非生物逆境相关基因的表达较野生型降低,表明OsbZIP52对水稻干旱和冷胁迫是负调控作用[62]。OsABI5作为负调节因子参与水稻的盐胁迫耐受反应,OsABI5过表达植株在高盐浓度下出现比野生型更明显的萎黄现象[63]。另外,Yang等[64]研究发现,通过RNAi干扰技术抑制AthZIP24的表达水平,可大大提高拟南芥转基因植株的耐盐性。过表达番茄SlbZIP38能抑制高盐、干旱胁迫下植株中叶绿素及脯氨酸的积累,同时ABA响应的逆境相关基因的表达较对照显著下降,从而使得植株对胁迫敏感,表明SlbZIP38参与了盐及干旱胁迫响应的负调控[65]。野茶树的CsbZIP6的表达在低温条件下被诱导,在拟南芥中过表达野茶树CsbZIP6导致植株对低温胁迫敏感,转录组分析表明,与野生型比较,过表达植株中低温及干旱响应基因的表达显著降低,表明CsbZIP6对植物冷胁迫起负调控作用[66]。在拟南芥中过表达小麦TabZIP6显著降低了转基因植株中CBFs、关键CORs等基因的表达,从而使得转基因植株对低温敏感[67]。
4 展望
bZIP转录因子在植物生命过程中充当着不可或缺的角色。自从发现bZIP转录因子以来,许多学者通过生物信息学、分子生物学等方法,对不同的植物中的bZIP转录因子进行鉴定并研究其生物学功能。已有的一系列研究结果表明,bZIP转录因子参与植物的生长、衰老、抗逆反应等生理过程。此外,bZIP转录因子还参与开花调控、花的发育等生理过程。因为bZIP转录因子的数量众多,各亚族的信号传导机制和亚族之间的交叉功能还需进一步研究探讨;期待研究者分离出更多的bZIP转录因子,从而进一步探讨其在激素信号、抗逆途径中的作用以及bZIP转录因子对能量代谢途径的调控机制,进一步完善bZIP转录因子的功能研究。

