侵袭性垂体泌乳素腺瘤中GPER1基因表达的变化
李 珺 张 义
(复旦大学附属上海市第五人民医院神经外科 上海 200240)
泌乳素(prolactin,PRL)腺瘤是激素分泌性腺瘤中最常见的一种,约占垂体腺瘤的 30%,部分肿瘤虽为良性,但仍有侵袭性生长的恶性肿瘤表现。男性患者临床表现与女性不同,女性的泌乳素腺瘤大多是微腺瘤,男性则有就诊年龄大、肿瘤大、泌乳素水平高和肿瘤侵袭性生长等特点[1]。妊娠和雌激素替代疗法也会导致泌乳素瘤增大[2-3]。泌乳素腺瘤全切率低,与其他类型的垂体腺瘤相比具有更快的侵袭速度[4],因此临床预后差。寻找敏感的生物标志物将有助于鉴定泌乳素瘤的侵袭性,协助临床治疗。
众所周知,雌激素受体(estrogen receptor,ER)与垂体肿瘤侵袭作用密切相关[5-6]。但是很早就有学者提出传统ER并不足以完成雌激素的全部作用[7-8]。G蛋白偶联雌激素受体1(G protein-coupled estrogen receptor 1,GPER1)是一种由GPER基因编码的蛋白质,曾被称作G蛋白偶联受体30。GPER1与雌二醇结合并被其激活,发挥其独立于传统ER并且快速的受体作用,因此被视为具有独立作用的新型ER[9-10]。研究表明,GPER1与GPER雌激素结合后,不依赖传统途径,可以快速活化细胞内第二信使信号,参与雌激素非核效应调节及肿瘤的发生和发展[11-12]。已知GPER1在乳腺癌细胞中具有抑制作用,其表达减少可造成乳腺癌进展,但在其他雌激素相关肿瘤的作用尚不明确。本研究采用免疫组化和荧光实时定量聚合酶链反应(RT-PCR)方法研究侵袭性泌乳素腺瘤中GPER1基因表达的变化,为泌乳素腺瘤侵袭机制提供新的理论基础,可为未来的基因治疗提供新的靶点[13],为寻找新的分子生物标志物评价泌乳素瘤的侵袭性提供理论依据。
资 料 和 方 法
临床病例资料选取2012—2017年复旦大学附属上海市第五人民医院神经外科收治的泌乳素腺瘤患者共102例,根据其头颅MR表现参考Knosp[14]方法分为侵袭性泌乳素腺瘤组(侵袭组)和非侵袭性泌乳素腺瘤组(非侵袭组)。排除标准:(1)接受2次手术治疗;(2)使用溴隐亭治疗。102例患者中,80例最终纳入研究,其中侵袭组37例、非侵袭组43例。详细记录各例患者性别、年龄及术前泌乳素水平。
本研究获复旦大学第五人民医院伦理委员会批准(批准号:2012[021])。所有患者均签署知情同意书。本研究按照《赫尔辛基宣言》原则进行。
免疫组化手术切除垂体瘤标本制成蜡块,制作4.0 μm切片进行免疫组化实验。免疫组织化学采用LSAB法(labeled streptavidin-biotin,抗生物素蛋白链菌素-生物素标记法)。GPER1一抗购于美国Santa Cruz Biotechnology公司。通用型SP-Kit和DAB由北京中山生物技术有限公司提供。PBS代替一抗为阴性对照。
组化实验由两名病理实验员同时进行,实验员对患者资料并不知情。染色结果进行HPF半定量分析:以染色强度结合阳性细胞数百分比综合计分。组织切片中胞质染为淡黄色至棕褐色者为阳性细胞标志。具体评分标准见表1,标准组化示例见图 1。

表1 GPER1 免疫组化染色 HPF 半定量分析评分法Tab 1 GPER1 immunohistochemical staining HPF semi-quantitative analysis scoring method
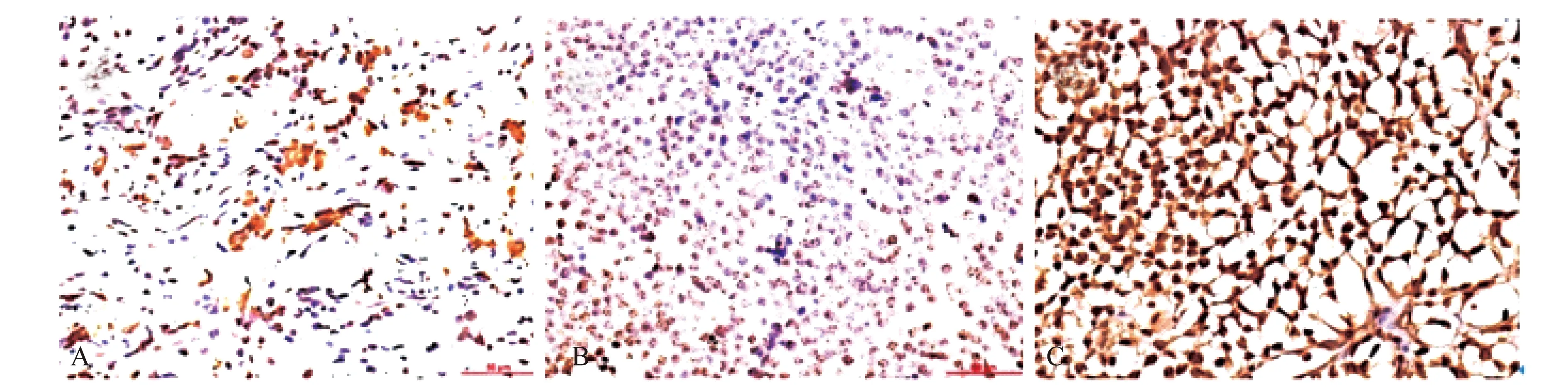
A:Weak positive;B:Mid positive;C:Strong positive.
图 1 HPF 半定量分析标准组化示例(×400)
Fig 1 HPF semi-quantitative analysis standard sample (×400)
荧光实时定量多聚酶链反应将组织样本在无RNA酶的研钵中液氮研磨,Trizol(lot A7205-1,大连TaKaRa生物有限公司)充分裂解细胞提取总RNA。使用M-MLV逆转录酶试剂盒(lot EP0441,上海赛默飞世尔科技有限公司)和oligo dT (lot S1316S,上海NEB公司)根据操作说明书进行逆转录。引物设计为GPER1(正向):5’-GCA GGT CCA GCA GAG GTA CA-3’,GPER1 (反向):5’-TGG TTT GGG TTG GGT TTG TTA-3’ (278bp);甘油醛 3- 磷酸脱氢酶(GAPDH) (正向):5’-GGG TGT GAA CCA TGA GAA GTA TG-3’,GAPDH (反向):5’-GAT GGC ATG GAC TGT GGT CAT-3’(145 bp)。以逆转录的cDNA为模板,用目的基因特异性引物和内参引物扩增待检测的目的基因片段和看家基因,摸索适合qPCR上机的最佳引物退火温度和模板量,若有杂带应重新调整PCR过程中的退火温度,直至杂带消失。最后以GAPDH作为内部控制,使用SYBR Green Mix(中国广州东盛生物科技有限公司)在Eppendorf Mastercycler ep Realplex 荧光定量PCR系统中(德国汉堡 Eppendorf 生物技术公司)进行特异性mRNA定量Real-time PCR实验。所有反应包括在95 ℃初始变性2 min,95 ℃ 15 s,60 ℃ 20 s,然后 72 ℃ 20 s循环40次。计算2-ΔΔCT代表相对目标基因的mRNA水平。

结 果
临床资料分析侵袭组病例37人,非侵袭组病例43人,患者的临床特点及其术前泌乳素水平见表2。侵袭组平均年龄与非侵袭组平均年龄比较无统计学差异(P=0.94)。侵袭组女性17人,男性20人;非侵袭组女性25人,男性18人。侵袭组术前泌乳素水平与非侵袭组相比,差异无统计学意义(P=0.869)。

表2 侵袭组与非侵袭组泌乳素腺瘤患者临床数据分析Tab 2 Characteristics of prolactinomas patients with or without invasive tumor
免疫组化结果免疫组化染色结果显示瘤细胞质中出现的黄色颗粒为GPER1蛋白质。放大400倍光镜观察侵袭性垂体瘤组织标本中表达较少,颜色偏淡,多呈淡黄色;在非侵袭性垂体瘤组织标本中颜色浓郁,多呈深褐色。通过计算,侵袭组蛋白质阳性度平均值较非侵袭组低,侵袭组为3.8 (2.2~6.6),非侵袭组为11.2 (6.0~12.0)(P<0.001,图2)。为了去除混杂因素影响,本研究还针对两组不同的临床特征可能对GPER1表达产生影响的因素进行了统计比较,结果显示不同性别的泌乳素腺瘤患者GPER1蛋白质水平未见明显差异,表3显示GPER1蛋白质水平仅与垂体瘤侵袭行为有关,与其他临床特征无关。

A:GPER1 protein staining in invasive pituitary tumor showing weak staining (+) (×400).B:GPER1 protein staining in non-invasive pituitary tumor showing strong staining (+++) (×400).C:Box-plot of GPER1 protein expression in male and female prolactinomas patients (data reported as median and IQR);D:Box-plot of GPER1 protein expression in prolactinomas patients with invasive or not (data reported as median and IQR).
图2 泌乳素腺瘤患者GPER1蛋白质免疫组化结果
Fig 2 Immunohistochemical results of GPER1 protein in patients with prolactin adenoma

表3 两组间不同临床特征的 GPER1 蛋白质水平的阳性度平均值比较Tab 3 Grade distribution of GPER1 protein level in prolactinomas patients with different characteristics [n (%)]
荧光实时定量多聚酶链反应非侵袭组GPER1 mRNA水平为1.93 (1.00~4.70),显著高于侵袭组[0.47 (0.03~2.30)],差异有统计学意义(P=0.021,图 3)。此结果与免疫组化结果相一致。

Data reported as median and IQR.
图3 real-time RT-PCR分析两组患者
相对GPER1 mRNA 水平
Fig 3 Relative GPER1 mRNA level in patients of twogroups by real-time RT-PCR
Cox 比例风险模型将侵袭组与非侵袭组各患者的年龄、性别、瘤体大小、术前血清泌乳素水平及GPER1 mRNA基因水平与垂体瘤复发时间做相关性分析(表4、图4)。按照 GPER1 mRNA水平分组,校正年龄和肿瘤大小之后发现,不同表达水平的GPER1对肿瘤复发的影响差异无统计学意义(P=0.48)。
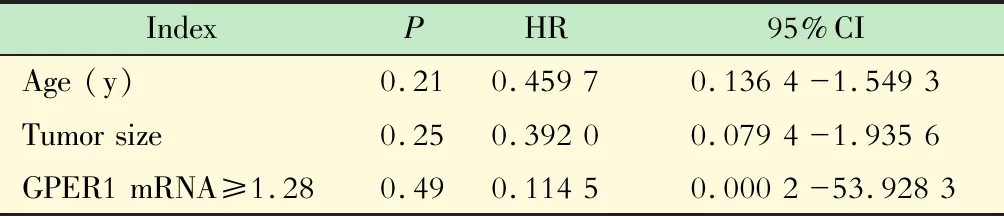
表 4 Cox 比例风险模型对GPER1 mRNA水平与患者预后的相关性分析结果Tab 4 The relationship of GPER1 mRNA level with the prognosis of patients by Cox proportional risk model analysis
讨 论
泌乳素腺瘤是一种常见的垂体肿瘤,雌激素在其发生发展中起着关键作用。GPER1属于G蛋白偶联受体(GPCRs),其作用独立于雌激素受体(ER)α 和(ER)β。GPER1刺激增加产生GPER1 Gαs。此外,GPER1的激活导致肝素结合生长因子(HB-EGF)的激活和释放,进而激活表皮生长因子受体,然后磷酸化MAPK[16]。
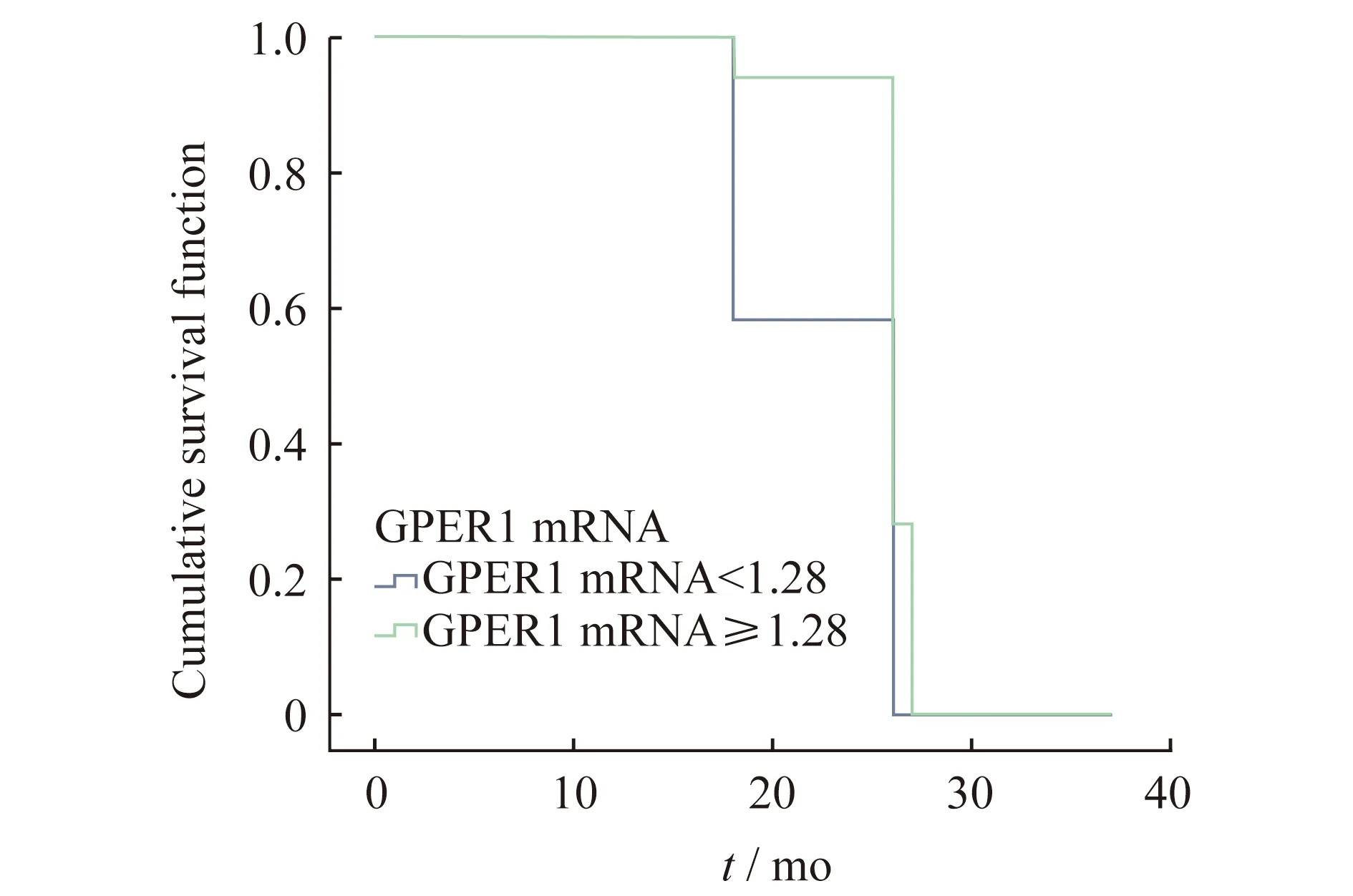
The effect of different levels of GPER1 mRNA on tumor recurrence was not statistically significant,P=0.48.
图4 不同 GPER1mRNA 水平患者复发生存曲线(校正年龄和肿瘤)
Fig 4 Recurrence survival curve of patients with differentGPER1 mRNA levels (adjusted for age and tumor size)
2014年 Lappano等[17]研究了GPER1 (又称GPR30)受体在不同的细胞类型中对雌激素信号的影响,发现表皮生长因子受体的激活是GPER1触发的生物作用中的一个基本整合点。在乳腺癌中发现,天然和合成雌激素可激活GPER1,并在乳腺癌发生和发展中起作用。还有研究表明,雌激素与GPER1特异性配体G.1结合可调控ERKl、ERK2等信号通路,从而进一步影响细胞增殖[18-22]。有研究表明,GPER1表达的大鼠初级精子细胞与GPER1结合后,E2、G.1可激活EGFR/ERK/c-Jun通路,进一步调控细胞基因表达[22]。其他学者[23-24]的实验研究再次强调了GPER1在癌细胞侵袭时的抑制作用。本研究与上述研究结论相符,GPER1 表达降低的肿瘤侵袭性增高。
然而,GPER1的具体作用通路尚不清楚,GPER1基因的低表达的机制是什么,仍是研究的热点。Manjegowda等[25]的研究分析了不同乳腺癌细胞中GPER1 mRNA的水平,使用RT-PCR检测MCF-7和MDA-MB-231细胞中GPER1基因座两个CpG岛的甲基化状态,通过改良COBRA法和亚硫酸氢盐测序法检测GPER1 mRNA。结果表明,MCF-7细胞GPER1 mRNA表达水平较高,与MDA-MB-231细胞相比,COBRA检测显示GPER1 mRNA表达水平存在差异甲基化。结果证明了DNA甲基化在 GPER1 抑制中的作用。
细胞研究证实,GPER/ERK信号通路与细胞生长、存活和迁移有关[26]。Jiang等[27]的体外实验研究证实雌激素信号与乳腺癌的转移有关,可能通过 GPER1/ERK&AKT/NFκ-B/引发CXCR1 的级联反应。有关GPER在激素分泌性垂体腺瘤中的分子机制研究报道较少,可能是将来研究的重点。此外,参与泌乳素瘤侵袭行为的还有基质金属蛋白酶[28]和芳香化酶细胞色素 P450[29],它们与GPER1的关系有待研究。
由于泌乳素腺瘤女性患者多见,为了排除性别的干扰,我们将性别进行统计对比,结果表明侵袭组及非侵袭组GPER1的表达与性别无关。我们还对比了年龄、瘤体大小以及术前血清泌乳素水平对GPER1基因表达的影响,最后证实GPER1基因表达仅与垂体瘤侵袭性有关,与其他临床特征无关。
本研究按照GPER1 mRNA水平分组,校正年龄和肿瘤大小之后发现,不同表达水平的GPER1对肿瘤复发的影响并不具有统计学意义。这种结果可能是由于泌乳素垂体瘤并不是恶性程度高的肿瘤,复发率不高,结局发生数较少造成的,需要在大样本人群队列中进一步验证。
本研究存在一定的局限性。本文仅研究了泌乳素腺瘤GPER1基因的表达,未对和侵袭性作用相关的其他蛋白质进行更全面的研究和对比。无法通过多变量分析充分调查泌乳素瘤侵袭的危险因素。
目前泌乳素腺瘤的手术治疗及随访仍存在很大的挑战。因此研究更为敏感的生物标志物如GPER1为评判泌乳素垂体瘤的侵袭性和泌乳素垂体瘤的综合治疗提供科学依据。

