高脂诱导下胰岛素抵抗和非胰岛素抵抗小鼠糖脂代谢及肠道AKK菌的变化
田滋润, 王 烨, 韩 雪, 王蟾月, 王晓晓, 杨 浩, 朱曼丽, 李琳琳
(新疆医科大学药学院, 乌鲁木齐 830011)
胰岛素抵抗是2型糖尿病发病的主要环节[1],是指由于营养过剩、脂质分布异常、感染、脓毒症致炎症等原因引起的胰岛素敏感组织如骨骼肌、肝脏、脂肪组织等对胰岛素的敏感性下降,并引起下游细胞信号通路缺陷和机体自稳平衡失调的现象[2]。目前有研究显示,肠道菌群结构的改变是引起肥胖和胰岛素抵抗等代谢性疾病的主要原因之一[3-5]。本研究通过高脂诱导胰岛素抵抗小鼠实验,对比研究胰岛素抵抗成模小鼠和未成模小鼠粪便中糖脂代谢及AKK菌的变化,确定肠道菌群在胰岛素抵抗形成过程中的重要性。
1 材料
1.1 仪器与试剂实时荧光定量仪(Bio-rad IQ5 美国),凝胶成像仪(Bio-rad IQ5 美国),微量分光光度计(ND-2000,美国),全自动酶标仪(Multiskan GO,Thermo公司)。胆固醇测定试剂盒、甘油三酯测定试剂盒,中生北控生物科技股份有限公司;粪便基因DNA提取试剂盒(凯杰,德国);实时荧光定量PCR试剂盒(TaKaRa公司,日本);琼脂糖凝胶DNA回收试剂盒,2×Tag PCR MasterMix、DNA Marker、6×Loading buffer(天根生化科技有限公司);所用引物由新疆欧易生物公司合成。
1.2 实验动物SPF级正常C57BL/6J小鼠,雄性,鼠龄6~8周,体质量为18~22 g,35只,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006,实验动物质量合格证:11400700307064。实验动物饲料购自北京华阜康生物科技股份有限公司,实验动物饲料生产许可证号:SCXK(京)2014-0008,实验动物饲料质量合格证:11003800016856。动物饲养于新疆医科大学SPF级实验动物中心,温度(23±2) ℃,湿度40%~45%,每天光照12 h,单笼单只饲养,自主饮水。
1.3 分组35只C57BL/6J小鼠适应性喂养1周后,随机分为正常饮食对照组(normal control diet,NCD组)10只,高脂饮食组(high fat diet,HFD组)25只,饮食干预8周后,检测各组小鼠血糖、血脂、口服葡萄糖耐量及胰岛素敏感性的变化,根据HFD组检测指标结果,从中筛选出胰岛素抵抗(insulin resistance,IR)和非胰岛素抵抗(non-insulin resistance,N-IR)小鼠各10 只,分别为IR组和N-IR组。小鼠胰岛素抵抗成模标准:小鼠胰岛素耐量试验时小鼠40 min血糖下降百分数<40% 纳入为胰岛素抵抗。
1.4 实验方法
1.4.1 口服葡萄糖耐量试验 动物禁食8 h(自由饮水)后,尾尖采血,用移液枪吸取10 μL血样加入到加有90 μL抗凝剂的1.5 mL EP管中,测定(0 min)。然后灌胃给予葡萄糖(2 g/kg体质量),分别于糖负荷后30、60、120 min尾尖采血,用移液枪吸取10 μL血样加入到加有90 μL抗凝剂的1.5 mL的EP管中,用葡萄糖氧化酶法测定血糖,并计算血糖曲线下面积(AUC)。
1.4.2 胰岛素耐量实验 动物禁食8 h(自由饮水)后,尾尖采血,用移液枪吸取10 μL血样加入到有90 μL抗凝剂的1.5 mL EP管中,测定FBG(0 min)。随后根据小鼠体质量(0.5 U/kg体质量)皮下注射精蛋白锌重组人胰岛素注射液(优泌林);分别于胰岛素注射后40、90、120 min尾尖采血,用移液枪吸取10 μL血样加入到有90 μL抗凝剂的1.5 mL EP管中,用葡萄糖氧化酶法测定血糖,并计算血糖AUC及AUC下降百分数。
1.4.3 生化指标的测定 动物禁食8 h(自由饮水)后,尾尖采血,用移液枪吸取10 μL血样加入到加有90 μL抗凝剂的1.5 mL EP管中,用相应试剂盒测定空腹血浆总胆固醇(TG)及甘油三酯(TC)。
1.4.4 粪便样本的采集及肠道微生物总DNA的提取 分别于高脂干预前和干预第8周,用小鼠代谢笼收集小鼠的新鲜粪样于冻存管中,-80℃保存。用粪便基因DNA提取试剂盒提取小鼠肠道微生物总DNA,用微量分光光度计测定DNA浓度与纯度。
1.4.5 实时荧光定量PCR检测目标菌群水平
1.4.5.1 标准曲线的制作 扩增AKK菌所用引物参照文献[6], 上游引物: 5′-AGAGGTCTCAAGC-GTTGTTCGGAA-3′下游引物:5′-TTTCGCTCCCCTGGCCTTCGTGC-3′,扩增片段大小285 bp。以PCR扩增AKK菌16SrDNA条带为靶片段,经切胶回收后作为目标菌DNA标准品,操作过程严格按照琼脂糖凝胶DNA回收试剂盒说明进行。
1.4.5.2 小鼠粪样中目标菌群水平的检测 将标准品稀释到浓度梯度为10-1~10-8copies/μL的DNA样本为阳性模板,并将最后一个浓度梯度设置为起始拷贝数(LogSQ)=1,同时以去核酸水为阴性对照,每个样品都设置复孔,进行荧光定量PCR,扩增体系:目标菌上下游引物各1 μL,荧光染料SYBR Green Ⅱ 12.5 μL,样品(粪菌总DNA) 2 μL,ddH2O 8.5 μL。反应条件:预变性 95℃、3 min,变性 95℃、15 s,退火 65℃、30 s,共40个循环。

2 结果
2.1 高脂诱导对C57BL/6J小鼠体质量的影响高脂诱导8周,与NCD组小鼠相比,IR组小鼠体质量从实验第1周就明显增加,差异有统计学意义(P<0.05),而N-IR组小鼠体质量从实验第6周才明显增加,差异有统计学意义(P<0.05);与IR组小鼠相比,N-IR组小鼠体质量从实验第1周,明显下降,差异有统计学意义(P<0.05)。结果见图1a。
2.2 高脂诱导对C57BL/6J小鼠FBG及血脂水平的影响高脂饮食干预8周,与NCD组相比,IR组小鼠FBG和TC水平,明显增加,差异有统计学意义(P<0.05),TG水平有增加趋势,但差异无统计学意义(P>0.05);N-IR组小鼠TC水平,明显增加,差异有统计学意义(P<0.05),FBG和TC水平有增加趋势,但差异无统计学意义(P>0.05)。与IR组相比,N-IR组小鼠FBG水平,明显下降,差异有统计学意义(P<0.05),TC和TG水平有下降趋势,但差异无统计学意义(P>0.05),见表1。
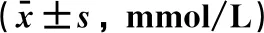
表1 高脂饮食干预对C57BL/6J小鼠空腹血糖及血脂水平的影响
注:与NCD组比较,*P<0.05;与IR组比较,#P<0.05。
2.3 高脂诱导对C57BL/6J小鼠糖耐量异常的影响高脂诱导8周,与NCD组相比,IR组和N-IR组小鼠OGTT曲线下面积,均明显增加,差异有统计学意义(P<0.05),但N-IR组小鼠OGTT曲线下面积增加明显小于IR(P<0.05),表明N-IR小鼠口服葡萄糖耐量异常程度小于IR组小鼠。结果见表2、图1b。
2.4 高脂诱导对C57BL/6J小鼠胰岛素敏感性的影响高脂饮食干预8周,与NCD组相比,IR组和N-IR组小鼠ITT曲线下面积,均明显增加,差异有统计学意义(P<0.05),表明IR组和N-IR组小鼠胰岛素敏感性异常;与IR组相比,N-IR组小鼠ITT曲线下面积,明显下降,差异有统计学意义(P<0.05),表明N-IR小鼠胰岛素敏感性异常程度低于IR组小鼠,未达到胰岛素抵;IR组和N-IR组小鼠40 min血糖下降百分数分别为20.36%和42.52%。结果见表2、图1c。
2.5 高脂诱导对C57BL/6J小鼠肠道AKK菌丰度的影响高脂饮食干预8周,与NCD组相比,IR组小鼠肠道AKK菌丰度明显下降,差异有统计学意义(P<0.05),N-IR组小鼠肠道AKK菌丰度有下降趋势,但差异无统计学意义(P>0.05);与IR组相比,N-IR组小鼠肠道AKK菌丰度有增加趋势,但差异无统计学意义(P>0.05)。实验结果表明AKK菌丰度变化与小鼠的胰岛素抵抗存在相关性,结果见图1d。

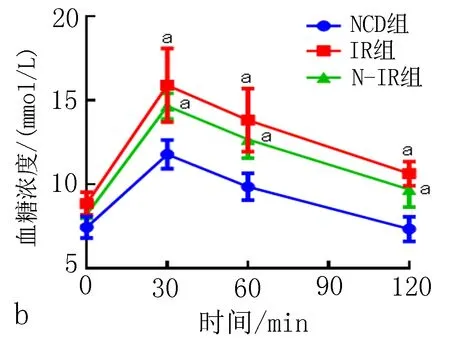

注:与NCD组相比, aP<0.05; 与IR组相比, cP<0.05。图1 高脂诱导对各组小鼠体质量(a)、口服葡萄糖耐量(b)、胰岛素耐量(c)、AKK菌丰度水平(d)的影响表2 高脂饮食干预对C57BL/6J小鼠口服葡萄糖和胰岛素耐量实验曲线下面积的影响

组别口服葡萄糖耐量实验曲线下面积0周8周胰岛素耐量实验曲线下面积0周8周NCD组1 074.18±89.081 128.75±76.33607.15±83.66628.31±70.50IR组1 058.35±102.521 550.60±167.40*607.44±111.68917.11±98.76*N-IR组1 101.46±54.821 424.03±82.01*#580.78±74.24766.62±45.91*#
注:与NCD组比较,*P<0.05; 与IR组比较,#P<0.05。
3 讨论
通过用高脂饲料喂养C57BL/6J小鼠来诱导其产生胰岛素抵抗,是本课题组研究肠道菌群与2型糖尿病关系的常用动物模型。在前期造模过程中,我们发现,在同样的饲养环境下,高脂饮食干预8周时,80 % 的动物均达到胰岛素抵抗模型,而有约20%的动物仍处于非胰岛素抵抗状态,此种现象引起了我们的注意,因此本研究对实验动物高脂饲养8周后,检测小鼠糖脂代谢指标水平,以胰岛素耐量试验40 min血糖下降百分数<40% 为标准,筛选出胰岛素抵抗组和非胰岛素抵抗组小鼠,收集它们0周和8周粪样,运用基于16SrRNA的实时荧光定量PCR技术分析各组小鼠粪便中肠道菌群的变化,旨在找到与胰岛素抵抗发生可能相关的靶标菌,为肠道菌群与2型糖尿病的研究提供基础依据。
近年来,肠道菌群与人类疾病的研究领域逐渐成为热点,尤其在肠道菌群与2型糖尿病等代谢性疾病的关系研究。本课题组在前期研究中发现,多形拟杆菌、气单胞菌等均与2型糖尿病的发生存在一定的相关性[7-8],但机制不明。目前,肠道菌群失调与2型糖尿病发生的可能机制研究主要有短链脂肪酸学说、胆汁酸学说、内毒素学说、生长因子学说等[9]。
随着分子生物学技术的发展,越来越多与胰岛素抵抗和肥胖等代谢紊乱相关联的关键益生菌株被发现(如Akk菌)。Akk菌是一种革兰氏阴性厌氧球菌,2004年,德里安教授和她的团队将其在人体肠道中分离出来,命名为Akkermansia muciniphila。Akk菌可以使用人类肠道上皮细胞覆盖着的一层黏膜层,作为其能源,因该黏膜层富含黏蛋白。这种黏液层可以作为许多肠道菌群的黏合剂,促进人体和微生物相互作用。Akk菌通过使用这种黏蛋白,与肠道内其他菌群产生竞争作用从而保护肠道免受病原体侵害[10]。与其他肠道菌不同的是,Akk菌可以储备黏蛋白,即使在肠道中没有营养物质(特别是在禁食期间),也可以蓬勃地繁衍生息。除了利用黏蛋白作为能源供给,科学家们认为Akk菌也可能参与恢复肠道黏蛋白储备的机制,达到自给自足[11]。Akk菌被认为是健康人体肠道中最丰富的黏液溶解细菌。肠道中低水平的Akk菌可能导致黏膜层的变薄,从而导致肠道屏障功能减弱,使肠道内的毒素更容易侵入人体。患有炎症性肠病、肥胖症和II型糖尿病的患者体内的Akk菌含量会有所降低[12]。Akk菌在降解黏蛋白的同时,会释放各种副产物,包含乙酸,这是肠道中一种重要的短链脂肪酸,可以通过其厌食效应起到控制体质量的作用。有证据表明Akk菌在肠道的数目和乙酸盐含量之间存在很强的相关性[13]。同时,Akk菌可以诱导空腹诱导脂肪因子(FIAF),可降低脂肪储存能力的表达。目前的研究表明,给小鼠灌喂活的Akk菌,可以在不影响食欲和饮食习惯的情况下来预防饮食诱导性的肥胖[14]。
本研究通过对比IR组和NCD组小鼠肠道内Akk菌丰度发现,IR组小鼠肠道内Akk菌丰度显著低于NCD组,通过对比IR组与N-IR组小鼠肠道内Akk菌丰度发现,IR组小鼠肠道内Akk菌丰度低于N-IR组。实验结果提示,小鼠胰岛素抵抗的发生可能与小鼠肠道内Akk菌的减少相关。

