luxR基因调控嗜水气单胞菌耐药性的分子机制初探*
毛磊磊 鄢庆枇 黄力行 张梅梅 王素云 张萌萌 覃映雪
基因调控嗜水气单胞菌耐药性的分子机制初探*
毛磊磊 鄢庆枇 黄力行 张梅梅 王素云 张萌萌 覃映雪①
(农业农村部东海海水健康养殖重点实验室 集美大学水产学院 厦门 361021)
LuxR家族蛋白是一类在革兰氏阴性细菌中发挥重要作用的调控蛋白,参与细菌多项重要生理活动。采用RNAi技术构建嗜水气单胞菌()05735稳定沉默菌株05735-RNAi,并利用qRT-PCR检测基因沉默效果。结果显示,与野生株相比,沉默株中05735的表达量降低了96.8%。药物敏感性实验表明,与野生株相比,05735-RNAi对庆大霉素、诺氟沙星、卡那霉素、吡哌酸的耐药性显著降低。对野生株与沉默株05735-RNAi的转录组数据进行分析发现,表达差异显著的基因共有1286个,其中,上调基因353个,下调基因933个;显著富集的通路4条,分别是核糖体通路、精氨酸生物合成通路、硫代谢通路、硒化合物代谢通路;在这4条通路中可能与嗜水气单胞菌耐药性相关的重要功能基因包括、、、等,这些功能基因编码的蛋白主要与细菌的生物成膜及核糖体蛋白合成相关。综合以上研究结果,可以推测嗜水气单胞菌的05735通过调控细菌的生物膜形成相关基因及核糖体蛋白相关基因的表达,从而调控细菌对药物的耐受性。
嗜水气单胞菌;LuxR调控蛋白;耐药;转录组
嗜水气单胞菌()隶属气单胞菌科(Aeromonadaceae)气单胞菌属(),是一种革兰氏阴性短杆菌(邰光富等,2013),是近年来淡水养殖动物的主要病原菌之一(张国亮等,2016; 秦莉等,2014)。目前,水产业中防治嗜水气单胞菌引发的病害主要还是依靠抗生素,然而,由于抗生素的使用方法不科学不规范,导致嗜水气单胞菌耐药菌株大量出现(Del Castillo,2013)。如李绍戊等(2013)检测28株鱼源嗜水气单胞菌对18种抗生素的耐药性,结果表明,分离到的鱼源嗜水气单胞菌呈多重耐药性,对氯霉素类和四环素类的耐药率超过60%,对氨基糖苷类的耐药率为28.6%~53.6%。方一风等(2014)检测23株嗜水气单胞菌的耐药性,结果显示,31.9%的嗜水气单胞菌对喹诺酮类药物耐药。耐药性菌株的出现导致嗜水气单胞菌引发的水产动物疾病更难以控制,因此,阐明嗜水气单胞菌的耐药机制成为防控嗜水气单胞菌的关键。
LuxR家族调控蛋白是革兰氏阴性细菌最重要的调控因子之一,对其重要性的认识始于该蛋白在细菌群体感应信号系统中的枢纽作用(Fuqua,1994; Zeng,2011)。随着研究的深入,越来越多细菌LuxR家族调控蛋白被发现和鉴定,研究证实,该蛋白家族除了参与细菌群感应系统调控外,还在细菌胞外酶合成、致病性、抗药性等多个生物学过程中扮演极其关键的角色(Malott,2009; Zeng,2011; Cerqueira,2014)。
本研究在前期研究的基础上,采用RNAi技术研究分离自鳗鲡(spp.)的病原性嗜水气单胞菌B11菌株的05735对该菌耐药性的影响,并结合转录组分析,探讨嗜水气单胞菌耐药的分子机制,为防控嗜水气单胞菌引发的病害提供理论依据。
1 材料与方法
1.1 菌株和质粒
大肠杆菌()在LB培养基37℃条件下培养,嗜水气单胞菌在TSB培养基28℃条件下培养。各菌株培养根据需要加入相应抗生素,抗生素浓度为链霉素(Sm) 100mg/ml,氯霉素(Cm) 34mg/ml。在转录组测序时为避免抗生素对转录组数据造成影响,对嗜水气单胞菌B11菌株和05735-RNAi菌株进行培养时均不使用抗生素。菌株基因型和/或表形特性见表1。
表1 实验菌株和质粒

Tab.1 Experimental strains and plasmids
1.2 基因稳定沉默株的构建和鉴定
参考Darsigny等(2010)的方法,首先从大肠杆菌中提取pACYC184质粒,并用HⅠ和Ⅰ将pACYC184酶切、回收,回收产物与携带相同酶切位点粘末端的小干扰RNA(表2)连接,构建重组质粒pACYC-LuxR。然后,将重组质粒热击转化入DH5α感受态细胞中,在氯霉素抗性平板(34 μg/ml)上筛选阳性单克隆,将阳性单克隆送测序公司测序。测序正确的重组质粒电击转化入嗜水气单胞菌野生株B11,构建嗜水气单胞菌05735稳定沉默菌株05735-RNAi。
1.3 qRT-PCR
B11和05735-RNAi菌株培养至对数生长期,收集菌体提取RNA,测定其浓度,电泳检测后进行反转录,以B11菌株作为对照,选取稳定表达的16S rRNA基因作为内参,进行qRT-PCR,具体引物序列见表3。反转录和荧光定量PCR过程严格按照试剂盒说明书进行操作。qRT-PCR反应体系为10 μl:q-PCR Mix 5 μl、ddH2O 4 μl、cDNA模版0.5 μl、上、下游引物各0.25 μl。PCR反应条件:95℃预变性10 min;95℃变性20 s,58℃退火20 s,72℃延伸20 s,40个循环。
表2 稳定基因沉默的shRNA序列

Tab.2 shRNA sequence for stable gene silence
表3 qRT-PCR引物

Tab.3 Primers for qRT-PCR
1.4 耐药实验
参考王印庚等(2012)的方法,将固体培养基倒入玻璃平板一层,使培养基覆盖玻璃平板底部即可,待凝固后放入牛津杯,然后倒入第2层培养基,约占整个平板高度的2/3,等到冷却凝固后取出牛津杯,即为打孔培养基。向小孔内分别加入100 μl药物(药物浓度参照美国CLSI的抗微生物药物敏感性实验操作方法和判断标准),向小孔周围的平板上加200 μl菌液,并用无菌棉签涂满小孔周围的平板。处理完后,在28℃培养箱内培养16 h。
1.5 转录组分析
从菌液(每个样本3个重复)中提取总RNA,采用NanoDrop 2000检测提取的RNA浓度和纯度,然后利用琼脂糖凝胶电泳检测RNA的完整性,并利用Agilent2100测定RIN值。单次建库要求RNA总量为 2 μg,浓度≥100 ng/μl,OD260 nm/280 nm介于1.8~2.2之间。然后,以TruSeqTMStranded Total RNA Library Prep Kit试剂构建文库,在合成cDNA第2链的dNTPs试剂中用dUTP代替dTTP,从而使cDNA第2链中碱基包含A/U/C/G。在PCR扩增前,用UNG酶把cDNA第2链消化,就使文库中仅包含cDNA第1链。之后,交上海美吉公司采用Illumina Hiseq进行转录组测序。为保证后续的生物信息分析的准确性,首先对原始测序数据进行过滤,去除原始测序数据中包含的测序接头序列、低质量读段、N率较高序列及长度过短序列,从而得到高质量的测序数据(Clean data)。使用Bowtie软件将质控后得到的高质量序列与指定的参考基因组比对。筛选差异表达基因(在实验组与对照组之间RNA水平的表达有显著性差异的基因。差异基因的筛选条件为,≤0.05,|logFC|≥1,即校正后≤0.05,差异倍数大于2倍的基因认为差异显著)。针对2组的差异表达基因进行GO注释的统计,以其中一个样本为对照,可以统计出具有某个功能的基因列表及基因数目。再对差异基因进行GO功能显著性富集分析,以说明差异基因的功能富集情况,在基因功能水平阐明样本间的差异。最后,使用KOBAS软件进行KEGG Pathway富集分析,其计算原理与GO功能富集分析相同,并使用Fisher精确检验进行计算。为了控制计算假阳性率,采用BH(FDR)方法进行多重检验,经过校正的值(Corrected-value)把0.05设为阈值,满足这一条件的通路定义为在差异表达基因中显著富集的KEGG通路。
2 结果
2.1 luxR05735沉默效果
从图1可以看出,与野生株B11相比,05735被稳定沉默后,基因的表达水平降低了96.8%,证实已成功构建稳定沉默株05735-RNAi,可用于后续研究。

图1 luxR05735的沉默效果
***:<0.001;**:<0.01;*:0.01<<0.05
下同The same as beolw
2.2 野生株和沉默株的药物敏感性实验
如图2所示,与B11菌株相比,05735-RNAi菌株对庆大霉素的耐药性减弱了约28.45%,对诺氟沙星的耐药性减弱了约4.22%,对卡那霉素的耐药性减弱了约44.25%,对吡哌酸的耐药性减弱了约6.23%,均具有显著差异。而对四环素的耐药性减弱了约1.83%、对强力霉素的耐药性减弱了约1.49%、对氟苯尼考的耐药性减弱了约1.75%,且均无显著差异。
2.3 野生株和沉默株的转录组分析
以基因库中标准菌株嗜水气单胞菌亚种ATCC 7966的基因组(Accession number CP000462)为参考,使用Bowtie软件将质控后得到的高质量序列与参考基因组比对(图3),由图3可知,2个菌株样品分别获得20771885和23017733条Reads,占总读数的81.61%和80.41%,2个菌株样品的Reads与参考基因组的比对效率较高。
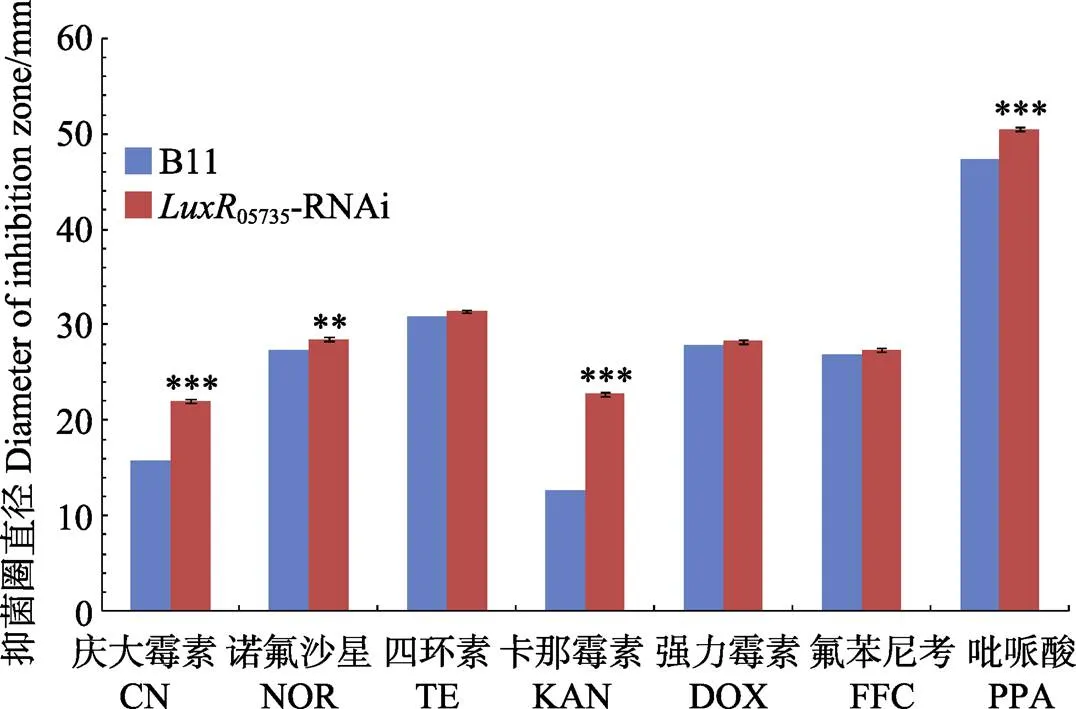
图2 B11菌株和luxR05735-RNAi菌株对抗生素的耐药性
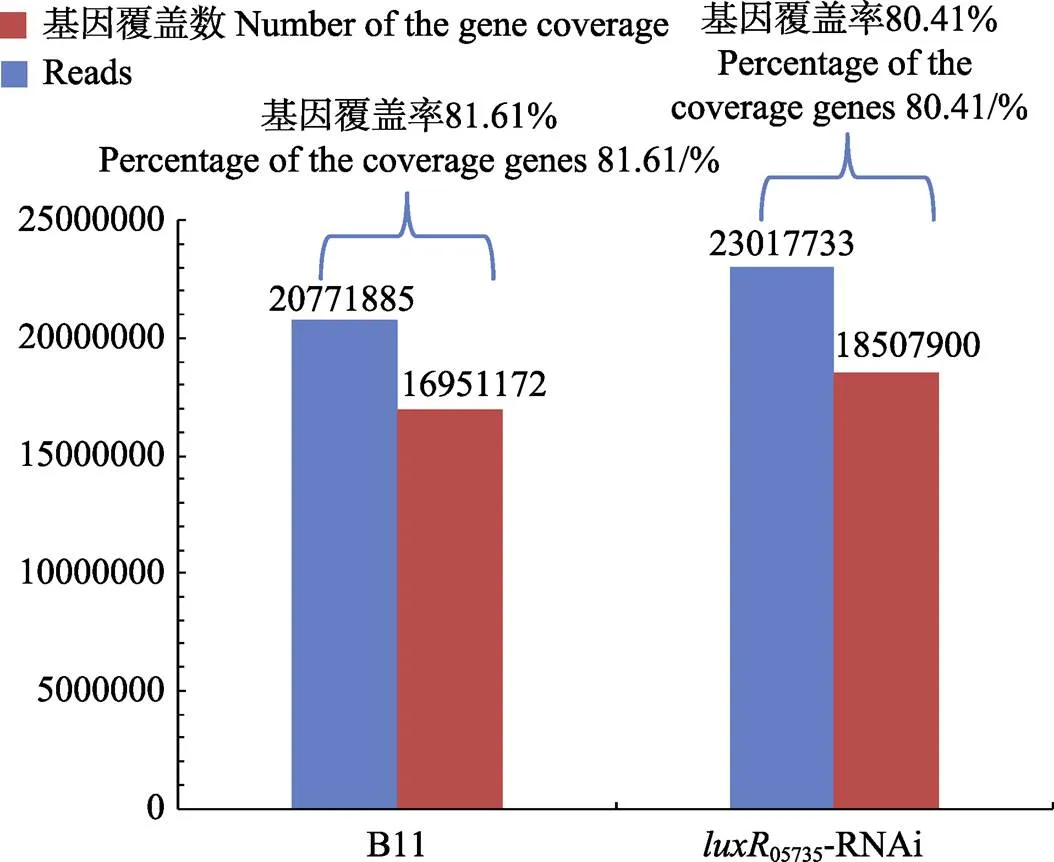
图3 测序数据评估统计
2.4 差异表达基因数量统计分析及功能分类
2.4.1 差异表达基因数量统计分析 通过对B11菌株和05735-RNAi菌株的数据进行标准化处理,使用edgeR软件进行差异分析。将B11菌株和05735- RNAi菌株的数据进行比较(图4)。由图4可知,差异显著的基因共有1286个,其中,上调基因353个,下调基因933个。

图4 差异表达基因统计
2.4.2 差异基因功能分类 利用GO数据库,可将基因按照其参与的生物学过程、构成细胞的组分、实现的分子功能进行分类。可分为生物过程、细胞组分、分子功能3部分。
由图5可知,在生物学过程功能分类的代谢过程中差异基因数量最多,为584个,其次为细胞过程,差异基因数量为552个。另外,单一生物过程、生物调节、局部构建、应激反应的差异基因数量也较多。
由图6可知,细胞和细胞组分在细胞组分分类中所占比例在最大(同为289个),大分子复合物为156个、膜为188个、膜组分为119个,反映膜和膜组分都在耐药过程中发挥重要作用。
图7显示,在分子功能分类中,催化活性差异基因的数量最多为477个,结合和转运蛋白活性的差异基因数为375个和115个,反映具有催化活性的酶类以及结合和转运蛋白均与嗜水气单胞菌的耐药性密切相关。
2.5 差异基因GO功能富集结果
为了获得基因完善的功能信息,对显著差异表达的基因进行功能富集分析显示,1286个显著差异基因显著富集到152个GO条目。以差异基因数目为筛选条件,筛选出富集差异基因数目最多的5类功能,分别是生物过程、分子功能、细胞过程、结合、细胞代谢过程(表4)。
2.6 差异基因KEGG富集结果
分析结果显示,显著富集的通路分别是硒化合物代谢、精氨酸生物合成、核糖体、硫代谢4条通路,反映这4条通路与嗜水气单胞菌耐药性关系最为紧密(表5)。对这4条通路中的功能基因进行分析,结合文献报道,筛选出这4条通路中可能与细菌耐药性关系密切的功能基因,如表6所示,这些基因的功能主要涉及生物成膜和核糖体蛋白合成。
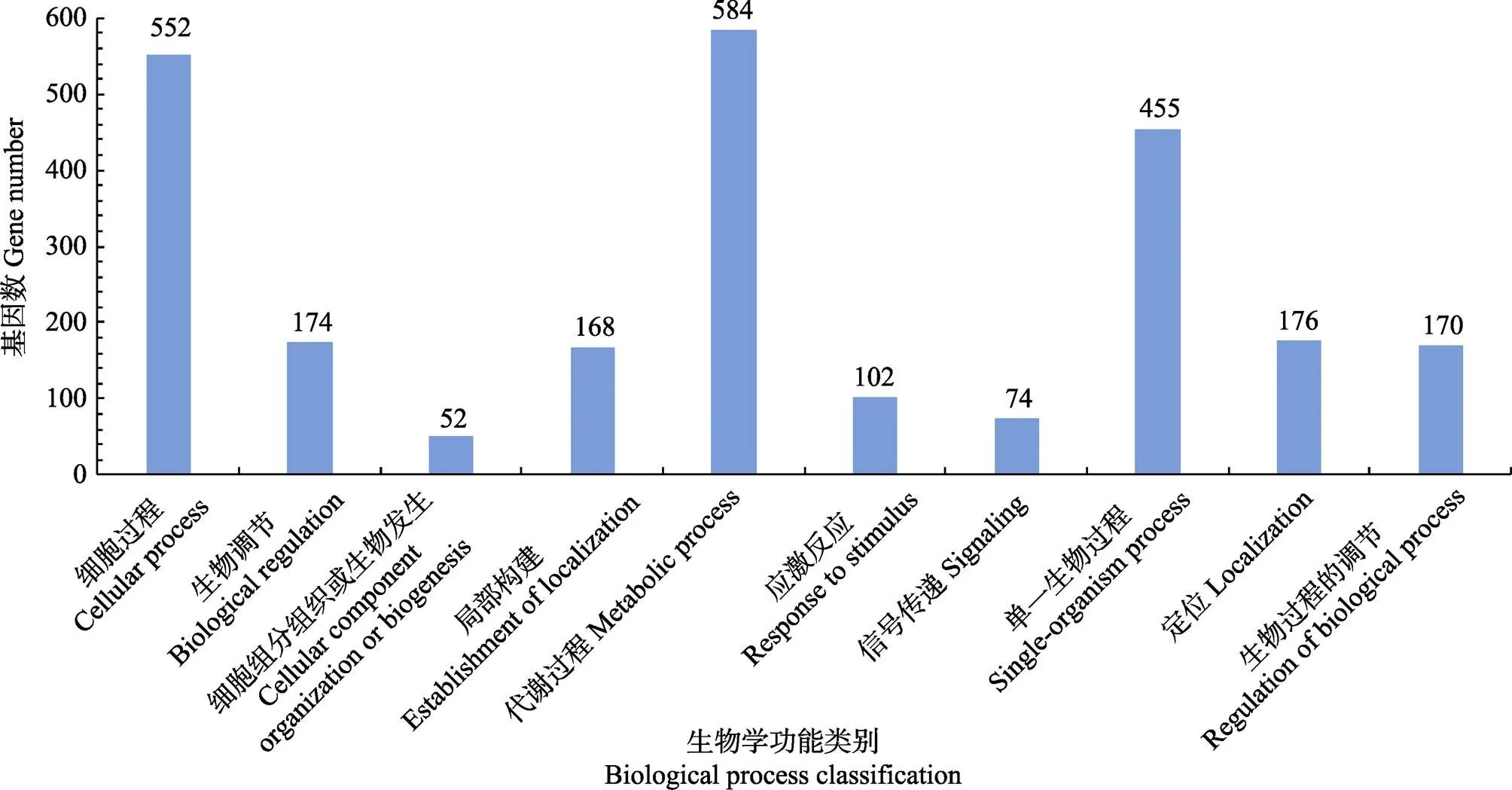
图5 差异表达基因的生物学过程功能分类

图6 差异表达基因的细胞组分分类
3 讨论
本研究发现,嗜水气单胞菌05735沉默后,细菌对庆大霉素、诺氟沙星、卡那霉素和吡哌酸的耐药性均显著降低。转录组分析发现,嗜水气单胞菌的耐药性可能与硒化合物代谢、精氨酸生物合成、核糖体、硫代谢4条通路有关。其中,可能与这4条通路中的功能基因、、、、、等关系最为密切,这些功能基因中,和编码功能性酶,参与细菌生物膜的形成,、、、则均是编码核糖体蛋白的基因,参与细菌蛋白的合成。
研究发现,生物被膜的形成与细菌耐药性直接相关。如Stewart(1996)曾报道称,生物被膜的耐药作用与被膜的厚度呈线性关系。张吉红等(2003)研究表明,嗜水气单胞菌的生物成膜能力与细菌的耐药性密切相关,其研究结果显示,形成生物膜的细菌对抗生素的耐受性显著高于浮游细菌。生物被膜中细菌的耐药性主要来自2个方面,一方面是生物被膜内细菌的代谢降低,进入一种非生长状态,可以保护细菌不被抗生素杀死;另一方面是形成生物被膜的细菌可以表达特有的生物被膜表型,并促进抗性基因的表达,从而对抗生素产生抗性。本研究发现,嗜水气单胞菌的耐药性与和的表达关系密切,而这2个基因又参与生物膜的形成。如李霞等(2013)研究发现,是耶尔森菌()的生物膜合成的主要影响因子,对耶尔森菌生物膜形成的贡献率均超过25%;杨艳北(2017)研究结果也显示,精氨酸生物合成通路中也参与细菌成膜,缺失,生物成膜能力下降。结合本研究结果可以推测,05735调控和的表达,当05735被沉默后,和的表达显著下降,直接导致细菌生物成膜能力的显著下降,而生物成膜能力的下降又直接降低细菌对抗生素的耐受性。
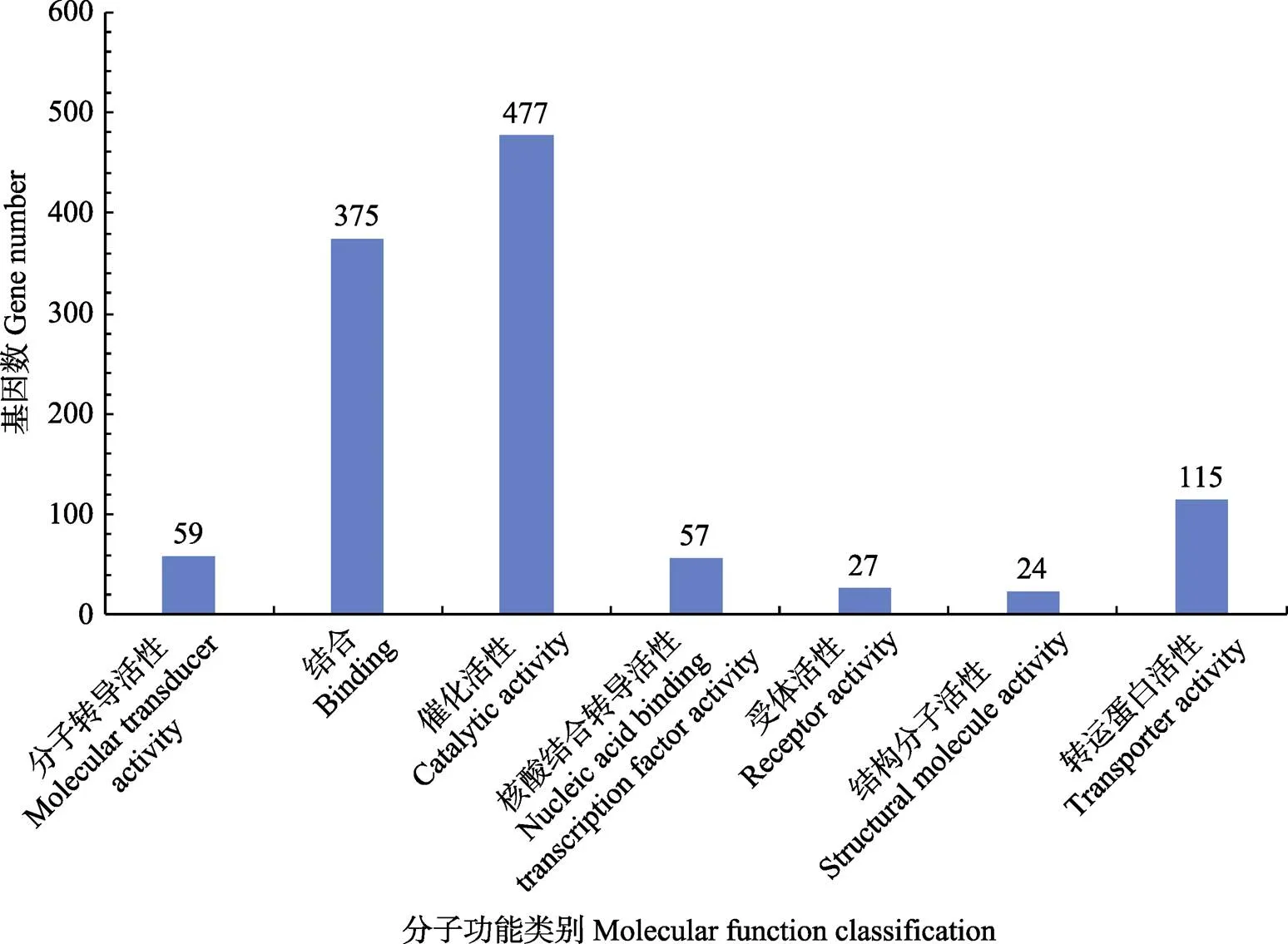
图7 差异表达基因的分子功能分类
表4 差异基因GO富集列表

Tab.4 List of GO enrichment differential genes
表5 差异基因KEGG富集列表
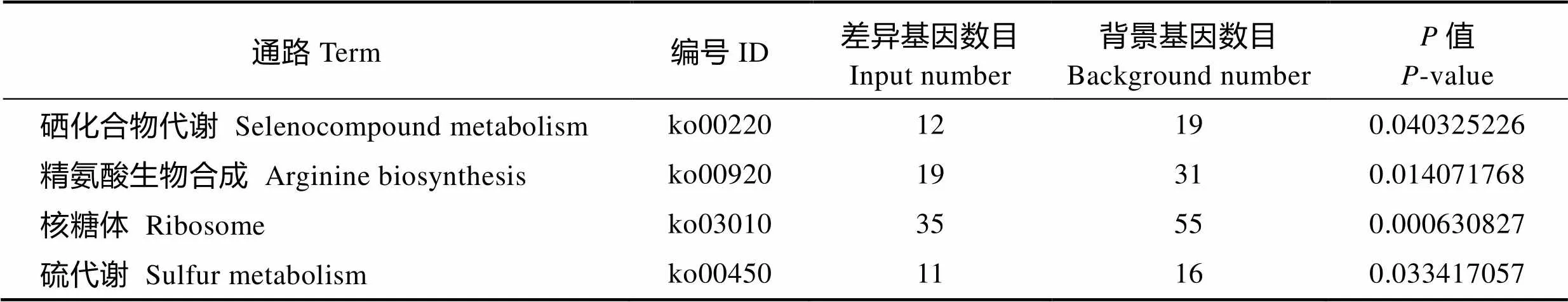
Tab.5 List of KEGG enrichment differential genes
表6 4条通路中与嗜水气单胞菌耐药性相关的功能基因
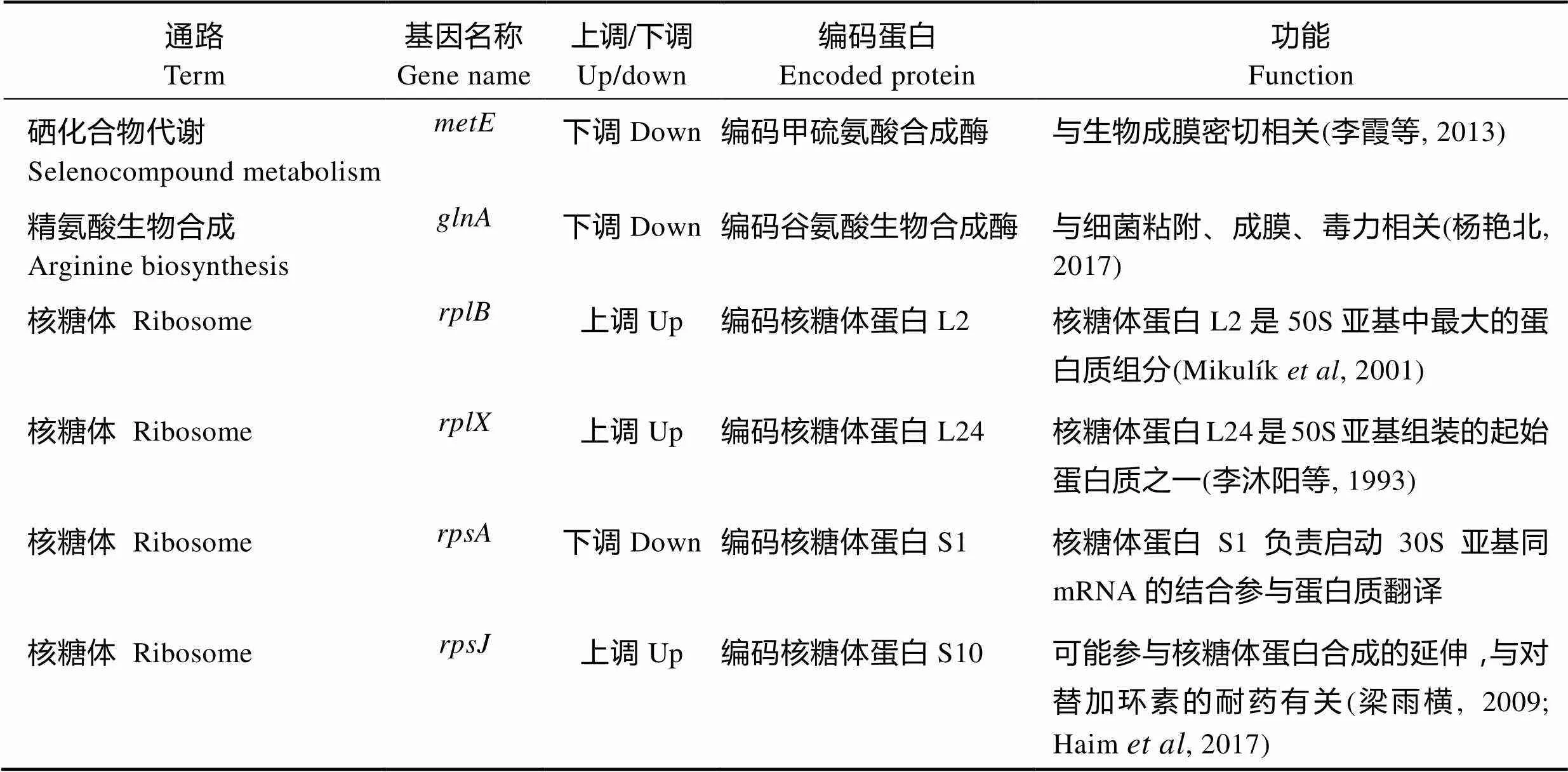
Tab.6 Functional genes associated with A. hydrophila resistance in the four pathways
研究还发现,核糖体蛋白对细菌耐药性有重要影响。本研究中发现的差异表达基因、、、分别编码核糖体蛋白S1、L2、L24和S10 (胡族琼等,2014; Mikulík,2001; 李沐阳等,1993; Haim,2017)。已知核糖体蛋白S1在翻译起始中起重要作用,直接参与30S核糖体蛋白对mRNA的识别和结合。表达量下调会降低核糖体蛋白S1的产量,从而减少30S亚基同mRNA的结合;核糖体蛋白L2是50S亚基中最大的蛋白质组分(Mikulík, 2001),核糖体蛋白L24是50S亚基组装的起始蛋白质之一(李沐阳等,1993);核糖体蛋白S10可能参与核糖体蛋白合成的延伸(梁雨横,2009)。Xiao等(2015)研究发现,氨基糖苷类抗生素主要是通过作用于细菌30S核糖体的16S rRNA解码区A部位,抑制细菌蛋白质的合成或诱导合成错误蛋白,抑制已经合成蛋白的释放,而导致细菌的死亡。由此推测,05735沉默后表达量下调,抑制30S亚基同mRNA的结合,进一步加强硫酸庆大霉素和卡那霉素的杀菌效果。因此,在本研究中与B11菌株相比,05735-RNAi菌株对硫酸庆大霉素和卡那霉素更加敏感。核糖体通路中与对替加环素的耐药有关(Haim, 2017),替加环素属于四环素类药物,且杀菌机制与四环素和强力霉素相同,能特异性与细菌核糖体30S亚基的亚单位结合,阻滞氨酰基转移RNA与信使RNA核蛋白体的位点结合,抑制肽链增长和影响细菌蛋白质合成(曹俊敏等, 2013),该基因表达量上调与四环素和强力霉素耐药性降低不显著的实验结果相符。推测是由于表达量上调,增加了细菌对药物的耐受性,虽然生物成膜能力下降增加了药物与细菌的接触,但细菌对药物的耐受能力增强,抵消了药物对细菌的作用。核糖体通路中和分别编码核糖体蛋白L2和核糖体蛋白L24。而氟苯尼考杀菌机制是通过与50S核糖体亚基结合,抑制蛋白质合成所需的关键酶——肽酰转移酶,从而特异性地阻止氨酰tRNA与核糖体上的受体结合,抑制肽链的延长而使菌体蛋白不能合成(Cannon,1990)。核糖体通路中,和表达量上调,50S亚基含量会增高。结合实验结果,与B11菌株相比,05735-RNAi菌株虽然对氟苯尼考的敏感性有所增加,但差异并不显著,可能是由于氟苯尼考的杀菌机制是通过与50S核糖体亚基结合,而50S亚基含量增高消耗了氟苯尼考的药性,使生物成膜能力下降,对耐药性的影响效果不显著。综合以上因素,就导致05735-RNAi菌株对氟苯尼考的耐药性虽然有所下降,但效果并不显著。
诺氟沙星和吡哌酸同属于喹诺酮类药物,2种药物的杀菌机制均为通过作用于细菌DNA旋转酶,干扰细菌DNA的合成,从而导致细菌死亡(王洁等, 2008)。结果显示,05735-RNAi菌株对诺氟沙星和吡哌酸的敏感性显著增加,推测可能是由于生物成膜能力下降,引起药物与细菌的接触更加直接,导致药效增加,从而引起05735-RNAi菌株对诺氟沙星和吡哌酸敏感性显著增加。
4 结论
本研究利用RNAi技术构建嗜水气单胞菌基因稳定沉默株05735-RNAi,与B11菌株相比,其05735的表达量下调96.8%。耐药性结果显示,与B11菌株相比,05735-RNAi菌株对庆大霉素的耐药性降低了28.45%、对诺氟沙星的耐药性降低了4.22%,对卡那霉素的耐药性降低了44.25%,对吡哌酸的耐药性降低了6.23%。差异基因KEGG富集结果显示,与嗜水气单胞菌耐药性相关性最显著的通路为核糖体、精氨酸生物合成、硫代谢、硒化合物代谢4条通路。在这4条通路中,可能与嗜水气单胞菌耐药性相关的重要功能基因包括、、、等,这些功能基因编码的蛋白主要与细菌的生物成膜及核糖体蛋白合成相关。因此,推测嗜水气单胞菌的05735通过调控细菌的生物膜形成相关基因及核糖体蛋白相关基因的表达,从而调控细菌对药物的耐受性。
Cannon M, Harford S, Davies J. A comparative study on the inhibitory actions of chloramphenicol, thiamphenicol and some fluorinated derivatives. Journal of Antimicrobial Chemotherapy, 1990, 26: 307–317
Cao JM, Yang XJ, Wang Y. Methodology of identification ofand the drug resistant mechanisms to tetracycline and macrolides antibiotics. Chinese Journal of Nosocomiology, 2013, 23(2): 241–244 [曹俊敏, 杨雪静, 王原. 棒杆菌属细菌分类鉴定的方法学比较及对四环素与大环内酯类抗菌药物耐药机制的研究. 中华医院感染学杂志, 2013, 23(2): 241–244]
Cerqueira GM, Kostoulias X, Khoo C,. A global virulence regulator inand its control of the phenylacetic acid catabolic pathway. Journal of Infectious Diseases, 2014, 210(1): 46–55
Darsigny M, Babeu JP, Seidman EG,. Hepatocyte nuclear factor-4α promotes gut neoplasia in mice and protects against the production of reactive oxygen species. Cancer Research, 2010, 70(22): 9423–9433
Del Castillo CS, Hikima JI, Jang HB,. Comparative sequence analysis of a multidrug-resistant plasmid from. Antimicrobial Agents and Chemotherapy, 2013, 57(1): 120–129
Fang YF, Pan XY, Lin LY,. Molecular mechanisms of quinolone resistance in. Acta Microbiologica Sinica, 2014, 54(2): 174–182 [方一风, 潘晓艺, 蔺凌云, 等. 嗜水气单胞菌对喹诺酮类药物耐药的分子机制. 微生物学报, 2014, 54(2): 174–182]
Fuqua WC, Winans SC, Greenberg EP. Quorum sensing in bacteria: The LuxR-LuxI family of cell density-responsive transcriptional regulators. Journal of Bacteriology, 1994, 176(2): 269–275
Haim MS, Di Gregorio S, Galanternik L,. First description ofandmutations associated with tigecycline resistance inisolated from a cystic fibrosis patient during antibiotic therapy. International Journal of Antimicrobial Agents, 2017, 50(6): 739–741
Hu ZQ, Cai XS, Xie WS,. Characterization ofandmutations in pyrazinamide-resistant. Chinese Journal of Laboratory Medicine, 2014, 37(4): 285– 289 [胡族琼, 蔡杏珊, 谢伟胜, 等. 吡嗪酰胺耐药结核分枝杆菌及基因突变特征分析. 中华检验医学杂志, 2014, 37(4): 285–289]
Li MY, Weng ML, Tong KZ. A new point mutation in the L24 gene () of theribosome. Chinese Science Bulletin, 1993, 38(22): 2085–2088 [李沐阳, 翁曼丽, 童克忠. 大肠杆菌核糖体蛋白质L24基因()的一个新的点突变. 科学通报, 1993, 38(22): 2085–2088]
Li SW, Wang D, Liu HB,. Molecular characterization of integron-gene cassettes in mult-drug resistantfrom fish. Journal of Fishery Sciences of China, 2013, 20(5): 1015–1022 [李绍戊, 王荻, 刘红柏, 等. 鱼源嗜水气单胞菌多重耐药菌株整合子的分子特征. 中国水产科学, 2013, 20(5): 1015–1022]
Li X, Li Y, Huang JH,. Effect of different biofilm-forming genes onbiofilm. Journal of Northwest A&F University (Natural Science Edition), 2013, 41(9): 159–163 [李霞, 李艺, 黄金海, 等. 耶尔森菌不同成膜基因对其生物膜形成的影响. 西北农林科技大学学报(自然科学版), 2013,41(9): 159–163]
Liang YH. Methylation of ribosomal protein S10 affects its interaction with B23. Master´s Thesis of Lanzhou University, 2009 [梁雨横. 核糖体蛋白S10的甲基化对其与B23相互作用的影响. 兰州大学硕士研究生学位论文, 2009]
Malott RJ, O’Grady EP, Toller J,. Aorphan LuxR homolog is involved in quorum- sensing regulation. Journal of Bacteriology, 2009, 191(8): 2447–2460
Mikulík K, Man P, Halada P. Characterization of thegene fromand its protein product by mass spectrometry. Biochemical and Biophysical Research Communications, 2001, 285(5): 1344–1349
Qin L, Yin JG, Zhang W,. Isolation and identification of pathogenicfromaround Urumqi in Xinjiang. Progress in Fishery Sciences, 2014, 35(5): 40–45 [秦莉, 殷建国, 张薇, 等. 白斑狗鱼()致病性嗜水气单胞菌的分离与鉴定. 渔业科学进展, 2014, 35(5): 40–45]
Stewart PS. Theoretical aspects of antibiotic diffusion into microbial biofilms. Antimicrobial Agents Chemotherapy, 1996, 40(11): 2517–2522
Tai GF, Yan QP, Xu XJ,. Establishment of quantitative model on eel peripheral blood leukocytes phagocytosingin vitro. Progress in Fishery Sciences, 2013, 34(6): 68–74 [邰光富, 鄢庆枇, 徐晓津, 等. 鳗鲡外周血白细胞体外吞噬嗜水气单胞菌数量模型的建立. 渔业科学进展, 2013, 34(6): 68–74]
Wang J, Shao HF. Plasmid-mediated resistance to quinolones in Enterobacteriaceae. Journal of Medical Postgraduates, 2008, 21(1): 91–94 [王洁, 邵海枫. 肠杆菌科质粒介导喹诺酮类抗菌药耐药的研究. 医学研究生学报, 2008, 21(1): 91–94]
Wang YG, Ren H, Zhang Z,. Causative pathogen of dark-thin syndrome in culturedmaximus and Chinese herbal medicine screening for the bactericidal effect. Progress in Fishery Sciences, 2012, 33(4): 57–63 [王印庚, 任海, 张正, 等. 养殖大菱鲆黑瘦症的病原菌鉴定及杀菌中草药筛选. 渔业科学进展, 2012, 33(4): 57–63]
Xiao SZ, Han LZ, Chu HQ,. Detection of aminoglycoside resistance related genes in multidrug-resistantisolated from a single institute of Shanghai, China. Panminerva Medica, 2015, 57(1): 49–53
Yang YB. Base on glutamine synthetase target to investigate mechanism of erythromycin againstbiofilm formation. Doctoral Dissertation of Northeast Agricultural University, 2017 [杨艳北. 基于谷氨酰胺合成酶靶标探讨红霉素干预木糖葡萄球菌生物被膜形成的机制. 东北农业大学博士研究生学位论文, 2017]
Zeng L, Xie J. Molecular basis underlying LuxR family transcription factors and function diversity and implications for novel antibiotic drug targets. Journal of Cellular Biochemistry, 2011, 112(11): 3079–3084
Zhang GL, Wang H, Zhang Y,. Whole-genome sequencing and comparative analysis ofAH10 (CCTCC AB2014155). Journal of Fishery Sciences of China, 2016, 23(5): 995–1005 [张国亮, 王浩, 张也, 等. 嗜水气单胞菌AH10(CCTCC AB2014155)的全基因组测序及比较分析. 中国水产科学, 2016, 23(5): 995–1005]
Zhang JH, Lu CP. Effects ofbiotilm on the drug resistance. Acta microbiologica Sinica, 2003, 43(4): 498–502 [张吉红, 陆承平. 嗜水气单胞菌生物被膜对其耐药性的影响. 微生物学报, 2003, 43(4): 498–502]
Molecular Mechanism ofRegulation of Drug Resistance of
MAO Leilei, YAN Qingpi, HUANG Lixing, ZHANG Meimei, WANG Suyun, ZHANG Mengmeng, QIN Yingxue①
Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture and Rural Affairs, Fisheries College, Jimei University, Xiamen
LuxR family proteins play a key role in various important physiological activities of gram-negative bacteria. In this study, RNAi technology was used to construct a stable silenced strain05735-RNAiThe expression of05735in wild-type strain and05735- RNAi was detected by qRT-PCR. The results showed that the expression of05735in strain05735- RNAi was reduced by 96.8% compared to that of the wild-type strain.Drug sensitivity tests showed that05735-RNAi significantly reduced bacterial resistance to gentamicin, norfloxacin, kanamycin, and pipemidic acid compared with the wild-type strain. The transcriptome analysis of the wild-type strain and05735-RNAi revealed that there were 1286 genes with significant differences in expression, of which 353 genes were up-regulated and 933 genes were down-regulated. There are four significantly enriched pathways, which are ribosome, arginine biosynthesis, sulfur metabolism and selenocompound metabolism. In the four pathways, some important functional genes, including,,,,,were found to be associated with drugs resistance of. These genes encode the proteins that were mainly involved in bacteria biofilm formation and ribosomal protein synthesis. It can be speculated from the above results that the05735ofregulates the expression of the genes that encode bacteria biofilm formation and ribosomal protein synthesis, and then further regulates the drugs resistance of.
; LuxR regulatory protein; Drug resistance; Transcriptome
QIN Yingxue, E-mail: yxqin@jmu.edu.cn
* 国家自然科学基金(31502194)和福建省自然科学基金(2017J01451)共同资助[This work was supported by National Natural Science Foundation of China (31502194), and Natural Science Foundation of Fujian Province of China (2017J01451)]毛磊磊,E-mail: 865014883@qq.com
覃映雪,教授,E-mail: yxqin@jmu.edu.cn
2018-05-31,
2018-07-05
S917.1
A
2095-9869(2019)04-0147-09
10.19663/j.issn2095-9869.20180531001
毛磊磊, 鄢庆枇, 黄力行, 张梅梅, 王素云, 张萌萌, 覃映雪.基因调控嗜水气单胞菌耐药性的分子机制初探. 渔业科学进展, 2019, 40(4): 147–155
Mao LL, Yan QP, Huang LX, Zhang MM, Wang SY, Zhang MM, Qin YX. Molecular mechanism ofregulation of drug resistance of. Progress in Fishery Sciences, 2019, 40(4): 147–155
(编辑 马璀艳)

