脓毒症大鼠基质金属蛋白酶表达与血脑屏障通透性改变的关系
杨 光,鲁卫华,曹迎亚,祁羽鹏
(皖南医学院第一附属医院 弋矶山医院 重症医学科,安徽 芜湖 241001)
脓毒症相关性脑病(sepsis associated encephalopathy,SAE)是由脓毒症或全身炎症反应综合征所导致的弥漫性脑功能障碍,一般缺乏中枢神经系统感染的临床或实验室证据,同时需要排除肝性脑病、肾性脑病和肺性脑病等代谢性脑病;通常以谵妄、认知及行为功能障碍等为表现,SAE是 ICU常见的神经功能障碍性疾病。SAE发病机制至今尚未完全阐明,目前认为血脑屏障(blood-brain barrier,BBB)损伤、氨基酸的改变和神经递质的改变、线粒体功能障碍和神经细胞凋亡等可能与SAE发病有关[1]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是一种锌依赖的蛋白水解酶,MMPs受多层次调控,以酶原形式存在,激活过程中受丝氨酸蛋白酶或纤维蛋白酶的介导,也可自主催化激活。生理状态下MMPs参与组织发育、转录水平调控、伤口愈合、酶原的激活及血管生成等;病理情况下MMPs 作为脑组织重要的蛋白水解酶,可降解紧密连接蛋白和血管基底膜,导致血脑屏障结构破坏,增加血脑屏障通透性。在脑创伤、脑缺血和脑出血动物模型上发现MMPs表达升高和紧密连接蛋白降低,但关于脓毒症大鼠MMPs的研究报道甚少[2-3]。本研究通过盲肠结扎穿孔(cecal ligation and puncture,CLP)制作脓毒症大鼠模型,探讨MMP-9在脓毒症大鼠皮质区域血脑屏障通透性改变的作用。
1 材料与方法
1.1 实验试剂 TNF-α ELISA试剂盒(批号:02/2018)购于上海酶联生物公司,MMP-9、Occludin和β-actin 抗体(批号:10375-2,13409-1,10904-1)均购于武汉三鹰生物技术公司。
1.2 实验动物与分组 SPF级健康雄性SD大鼠72只,体质量200~260 g(南京市青龙山动物繁殖场)。按随机数字表随机分为4组:对照组(C)、CLP 24 h 模型组(CLP24 h)、CLP 48 h模型组(CLP48 h)、CLP 72 h模型组(CLP72 h),每组18只。每组随机取6只用于检测血脑屏障通透性,6只用于ELISA和Western blot检测,6只用于免疫组化检测。
1.3 模型制备 本研究通过CLP制作脓毒症大鼠模型,各组大鼠术前禁食12 h,用10%水合氯醛,按0.3 mL/100 g腹腔注射麻醉。腹中线做长约1.5 cm切口,暴露盲肠后,在盲肠末端1/3处结扎,使用22号针头贯穿末端盲肠两次,并轻轻挤压少许肠内容物,后逐层缝合关闭腹腔,术后大鼠予以皮下注射30 mL/kg生理盐水并自由进水进食,空白对照组不进行任何处理。
1.4 炎症因子测定 C组大鼠腹主动脉取血后处死大鼠,CLP 24 h组、48 h组和72 h组分别在CLP术后24 h、48 h和72 h腹主动脉取血后处死大鼠,分离血清后据ELISA检测试剂盒说明书,测定血清TNF-α含量。
1.5 免疫组化检测 各组大鼠腹主动脉取血后迅速断头取脑,切除小脑,4%多聚甲醛固定液4℃固定2 d,石蜡包埋,蜡块做连续切片,贴片于防脱载玻片上,烤片5 h后,将组织切片脱蜡,用中性树脂封片,光学显微镜下观察MMP-9在皮质区域的表达。
1.6 Western blot 检测 各组大鼠腹主动脉取血后迅速断头取脑,切除小脑,冰上分离皮质海马。无菌小剪刀将皮质剪碎,加入适量RIPA裂解液,冰上裂解30 min后,4℃ 12 000 r/min 离心 30 min,取上清,采用 BCA 蛋白浓度测定试剂盒进行蛋白浓度的测定。然后进行 SDS-聚丙烯酰胺凝胶电泳,电泳结束后将蛋白转移至PVDF膜上。5%脱脂奶粉封闭1 h,一抗孵育4℃过夜,洗膜,室温下与相应二抗孵育1 h,加入ECL显影剂曝光。使用Image J软件对曝光条带进行灰度值分析。
1.7 BBB通透性的测定 伊文思蓝(Evans blue,EB)渗透法分析 BBB 通透性变化[4],大鼠处死1.5 h前,2% EB按3 mL/kg股静脉注射,1.5 h后打开胸腔,心内灌注生理盐水至右心耳流出无色液体时停止,立即断头取脑,每100 mg脑皮质加入1 mL甲酰胺溶液,60℃避光水浴24 h,离心后取上清在酶标仪上(620 nm)进行比色,同时制作标准曲线。
1.8 统计学处理 采用 SPSS 18.0 统计软件。计量资料以均数±标准差表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清TNF-α含量及血脑屏障通透性变化的比较 脓毒症可导致炎症因子增高和血脑屏障通透性增加,与C组比较,TNF-α、血脑屏障通透性在造模后24 h升高(P<0.05),72 h达到最高。见表1。

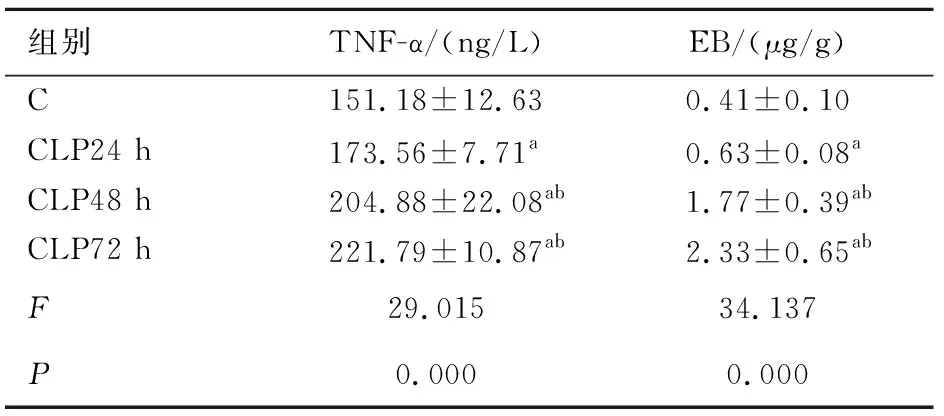
组别TNF-α/(ng/L)EB/(μg/g)C151.18±12.630.41±0.10CLP24 h173.56±7.71a0.63±0.08aCLP48 h204.88±22.08ab1.77±0.39abCLP72 h221.79±10.87ab2.33±0.65abF29.01534.137P0.0000.000
注:与C组比较,aP<0.05;与CLP24 h组比较,bP<0.05。
2.2 各组大鼠脑皮质MMP-9表达变化 免疫组化染色结果显示,脓毒症可引起MMP-9阳性染色增强,但在造模后24、48 h无明显增强,造模后72 h增强明显。如图1所示。

图1 各组大鼠脑皮质MMP-9表达(×100)
2.3 各组大鼠脑皮质Occludin表达变化 结果显示(如图2),与C组比较,Occludin在造模后24 h、48 h表达降低不明显,但在72 h表达下降(P<0.05)。如表2所示。
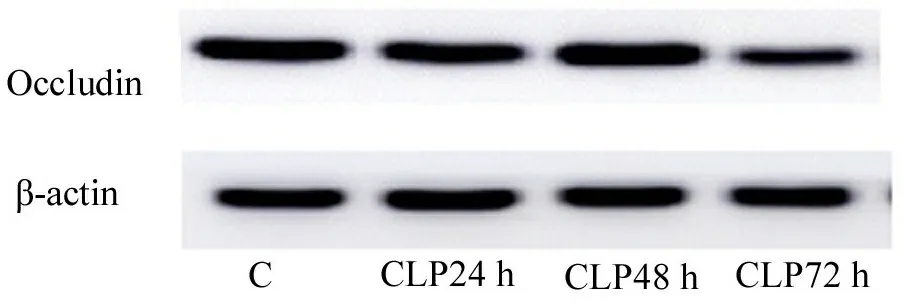
图2 Western blot检测Occludin表达


组别 Occludin/β-actinC1.33±0.09CLP24 h 1.17±0.03CLP48 h 1.13±0.11CLP72 h0.93 ±0.04aF14.308P0.001
注:与C组比较,aP<0.05。
3 讨论
SAE发病机制尚未明确,BBB受损可能是SAE发病的重要机制之一[5],BBB是由脑内的血管内皮细胞通过各种连接蛋白彼此紧密相连,并与周细胞和星形胶质细胞相互作用形成的特殊屏障系统,BBB 严格限制血液中的神经毒性物质、炎症因子、免疫细胞等进入中枢神经系统,进而维持大脑微环境的稳态,保证神经系统功能的正常发挥[3]。
Michels等[4]研究发现脓毒症大鼠海马区域BBB通透性增加,并且脓毒症大鼠出现认知功能改变。由于血脑屏障的通透性增加,各类炎症因子、细胞因子和假性神经递质可较易进入脑实质,进而影响脑组织的循环灌注,物质代谢,信号传递等过程,从而加重SAE[6-7]。
脓毒症不同时期BBB破坏的机制尚未明确,本研究通过脓毒症大鼠模型发现脓毒症大鼠脑皮质区MMP-9表达增加,与空白对照组比较,MMP-9在造模后24 h、48 h表达增加不明显,但在72 h表达明显增高。同时在造模后72 h紧密连接蛋白Occludin表达降低最为明显,BBB通透性最高,从而提示MMP-9可能与脓毒症晚期皮质区域BBB通透性改变有关。
Higashida T等[8]发现脑创伤大鼠模型建立24 h后即出现MMP-9表达增加,紧密连接蛋白Occludin及ZO-1表达降低,血脑屏障破坏及脑组织水肿,使用米诺环素治疗脑创伤大鼠后,MMP-9表达降低,同时紧密连接蛋白Occludin及ZO-1表达增高,血脑屏障破坏及脑组织水肿减轻,从而提示MMP-9可能与早期脑创伤大鼠血脑屏障的破坏有关。本研究中脓毒症大鼠造模24 h、48 h后MMP-9表达增加不明显,但在72 h表达明显增高,同时BBB破坏最严重。可能是由于SAE继发于脓毒症或全身炎症反应综合征,待炎症反应达到一定程度后引起MMP-9表达明显增高。
本研究中随着造模时间的延长,血清中TNF-α含量逐渐增高,与空白对照组比较,在造模后24 h差异即具有统计学意义;同时随着造模时间的延长,脓毒症大鼠少动、动作迟缓及团缩等表现逐渐明显。TNF-α被认为是脓毒症时最重要的炎症介质,TNF-α可诱导中性粒细胞浸润脑组织、中性粒细胞凋亡和脑水肿的发生,同时也影响中枢神经系统介质多巴胺、去甲肾上腺素及血清素的神经传递功能,引起认知功能减退[9]。此外,Tsuge M等[10]发现增加血清中TNF-α含量能够激活脑组织中MMP-9,进而增加BBB通透性。
综上所述,脓毒症时MMP-9表达增多,紧密连接蛋白减少,可能是SAE的发病机制之一,不同时期BBB通透性破坏的机制目前尚不十分清楚,有待进一步的研究。

