帕金森病模型大鼠的痛觉敏化及其时反应量-效关系
李光建,张双双,李 岩,梁 坤,林浩然,汪萌芽
(皖南医学院 1.细胞电生理研究室;2.启明星小组,安徽 芜湖 241002)
帕金森病(Parkinson disease,PD)是一种常见的中老年中枢神经系统退行性疾病[1-3],临床表现除运动迟缓、静止性震颤、姿势平衡障碍、肌强直等运动症状外[3-4],还有认知功能障碍、精神障碍、睡眠障碍、自主神经功能障碍、疼痛等非运动症状[4-5]。在众多的非运动症状中,疼痛[6]作为一种高发生率,低就诊率的症状,临床表现形式多样,按患病率由高到低依次为肌肉骨骼性疼痛、肌张力障碍性疼痛等[6-7]。其发病机制考虑与PD相关病变侵犯痛觉传导通道有关,PD 相关性疼痛一直未受到足够的重视,目前尚无规范的治疗方案,以临床经验用药为主。PD患者存在正中神经感觉受损及痛觉耐受阈值下降[8-9]。PD 疼痛的发生是否与疼痛阈值降低有关,目前还在争论中[10]。时反应量-效关系(timed dose-response relationship,TDRR) 概念的提出及其相关数学模型的设计,原旨在用于药物的药理或毒理作用分析[11-13]。在对时反应量-效关系的概念、特点、数学模型方面进行探讨后,我们实验室先后进行过大鼠空间学习记忆能力测试的时反应量-效关系[14-15]和大鼠痛觉时反应量-效关系[16]的探究。在此基础上,本研究旨在观察PD模型大鼠的痛觉特征,并探讨和分析帕金森病模型大鼠的痛觉敏化与痛觉时反应量-效关系,以期为帕金森病的痛觉发生与疼痛阈值的关系等方面提供新的研究思路和实验基础。
1 材料和方法
1.1 实验动物 SPF级别(250±10)g成年雄性SD大鼠55只,由南京青龙山动物繁殖场提供,许可证号SCXK(苏)2017-0001。
1.2 仪器和药品 脑立体定位仪(瑞沃德,68000系列)、光辐射热测痛仪(ZH-YLS-12A,安徽正华生物仪器设备有限公司)、Von Frey纤维丝刺激针(Von Frey hairs测痛仪,North Coast Medical,Inc.,CA,USA)、微量注射泵(ALC-LP660,上海奥尔科特生物科技有限公司)、6-hydroxydopamine(美国 Sigma 公司,批号:MKCB5847)、盐酸阿扑吗啡(美国 Sigma 公司,批号:SLBP2431V)、20% 乌拉坦(国药集团化学试剂有限公司,批号:20161208)、青霉素钠(华北制药股份有限公司,批号:国药准字H20144727)、3% 过氧化氢(国药集团化学试剂有限公司,批号:20160120)、其他常规哺乳动物手术器械等。
1.3 实验方法
1.3.1 实验分组 取55只雄性SD大鼠随机分为正常组(n=13)、假手术组(n=8)和模型组(n=34)。
1.3.2 PD大鼠模型制备 采用单侧纹状体两点法双靶点注射神经毒素6-羟多巴胺(6-OHDA) 制备PD大鼠模型[17]。34只SD大鼠用 20%乌拉坦麻醉( 1.5 g/kg,ip),直至夹捏刺激无明显反应。麻醉稳定后,将大鼠俯卧位固定于脑立体定位仪上,参照 Paxinos G 等大鼠脑立体定位图谱[18],确定右侧纹状体两点坐标,第1点(尾壳核内):前囟前0.72 mm,中线右侧2.6 mm,硬膜下5.0和6.0 mm;第2点(苍白球内):前囟后0.36 mm,中线右侧3.6 mm,硬膜下5.0和6.0 mm。以前囟为坐标原点,确定好颅骨表面尾壳核注药点坐标,用颅骨钻钻一直径为2 mm小孔,将一次性吸入5 μL 终浓度为 2.5 g/L 的 6-OHDA 溶液的微量注射器连接于立体定位仪上,垂直入颅,缓慢进针,在硬膜下6 mm处注入 2.5 μL 6-OHDA溶液,注药速度为 1 μL/ min,留针 5 min 后缓慢退针至硬膜下5 mm 处,注入剩余的(2.5 μL)6-OHDA 溶液,留针5 min 后以1 mm/min 的速度缓慢退针。苍白球注药点的注药方式同上。注射完成后进行缝合,在缝合处垫上明胶海绵并在术后连续3 d给予20万U青霉素(腹腔注射),预防感染。模型组大鼠在术后意外死亡2只,纳入模型鉴定的大鼠数为32只。假手术组用生理盐水代替 6-OHDA 溶液,其余步骤与实验组相同,因在术后意外死亡2只,纳入统计的假手术组大鼠数为6只。
1.3.3 帕金森病大鼠模型鉴定 所有受试大鼠分别于造模第2、4 周后腹腔注射阿朴吗啡(0.25 mg/kg) 检测行为学变化[17]。注射后 3~5 min 观察大鼠的行为学表现,如出现肢体僵直,并以健侧(左侧)后肢为支点,向健侧旋转,且旋转圈数≥210 圈/30 min 的大鼠鉴定为成功模型。
1.3.4 痛觉检测
1.3.4.1 机械痛阈值检测 帕金森病模型检验成功后,将3组大鼠放置在纤维丝透明纱网的测量装置上进行连续3 d,每天30 min的适应性训练,适应结束后用Von Frey纤维丝刺激针(Von Frey hairs测痛仪)[19]在质量分别为2、4、6、8、10、15和20 g进行大鼠的机械刺激缩足反应阈值(paw withdrawal mechanical threshold,PWMT)检测。
1.3.4.2 光辐射热痛甩尾潜伏期检测 机械痛阈值检测完成后,用光辐射热测痛仪,对3组大鼠进行不同光照强度下甩尾反应潜伏期(tail-flick latency,TFL)的移位法测定[16],即首次在距鼠尾根部1 cm处,随后每隔0.5 cm依次后移光照位点,进行5个光照强度的检测,设定光辐射热测痛仪的光照强度(Focus值)为15、23、34、51、76,随后依次测定各组大鼠在不同光强下的TFL,即为甩尾反应的TDRR数据。室温控制在(25±1)℃。
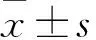
2 结果
2.1 造模后第2周和第4周的模型鉴定 采用χ2检验的方法,对第2周和第4周帕金森病模型的鉴定结果进行统计分析,在纳入模型检测的模型组大鼠32只中,第2周成功模型为20只,第4周成功模型为27只,造模成功率显示第4周的成功率高于第2周,最终造模成功率为84%(χ2=3.925,P=0.048)。
2.2 PWMT 对3组大鼠进行了机械痛检测,结果如图1显示,模型组(n=27)较另两组大鼠的PWMT降低(P<0.01),且假手术组(n=6)与正常组(n=13)大鼠相似(P>0.05)。

正常组(Normal):n=13,模型组(Model):n=27,假手术组(Sham operation):n=6,单因素方差分析:P<0.01,Newman-Keuls两两对比检验:*P<0.01。
图1 3组大鼠的机械刺激缩足反应阈值(PWMT)比较
2.3 光辐射热TFL 按照传统痛觉的分析方法,将3组大鼠TFL分别在34、51、76光强度(单位为Focus值)进行单因素方差分析,结果3组差异均具有统计学意义(P<0.01,表1),且在光照强度在34、51、76时模型组大鼠的TFL较另两组均缩短(P<0.01),而另两组间均相似(P>0.05)。
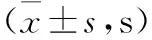
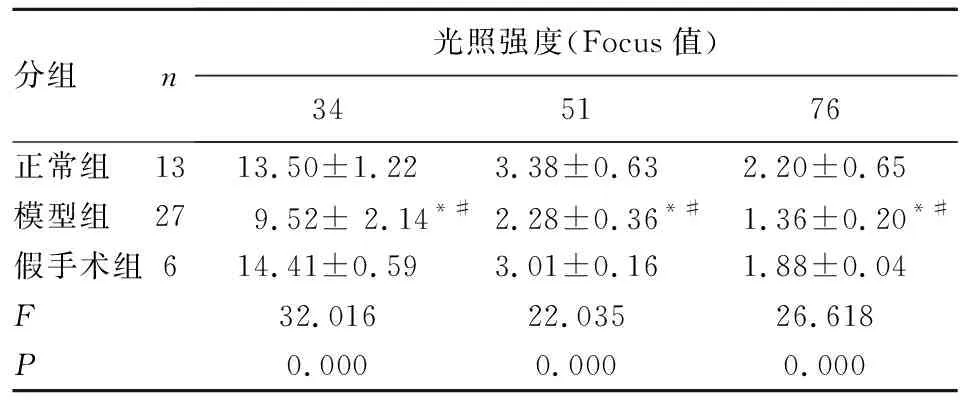
分组n光照强度(Focus值)345176正常组1313.50±1.223.38±0.632.20±0.65模型组279.52± 2.14*#2.28±0.36*#1.36±0.20*#假手术组614.41±0.59 3.01±0.161.88±0.04F32.01622.03526.618P0.0000.0000.000
q检验,与正常组比:*P<0.01,与假手术组比:#P<0.01。
2.4 光辐射热痛觉TDRR 对光辐射热TFL的TDRR数据(图2),用重复测量的双因素方差分析,显示因素光强度(F=9.537,P<0.01)、光强度×组间(F=54.891,P<0.01)及组间(F=39.839,P<0.01)的变异均有统计学意义。不仅提示帕金森病模型大鼠光辐射热TFL存在TDRR关系,还表明其在不同组间不同,其组间两两比较显示模型组TFL的TDRR较另两组明显左移(P<0.01),而假手术组与正常组相似(P>0.05) 。
进一步对3组大鼠的光强度-TFL关系数据分别用双曲线型TDRR模型[15-16]Y=cs+1/(x-a)s+b进行曲线拟合,其中模型组大鼠的TDRR曲线较正常组和假手术组左移,正常组和假手术组相似,各组主要拟合参数结果见表2,其中模型组参数主要显示参数a较另两组减小的变化。
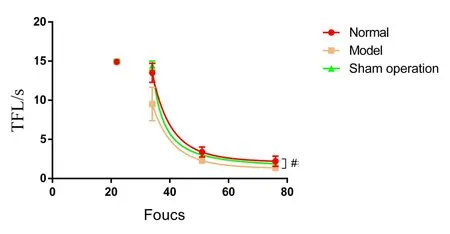
图2 3组大鼠的光辐射热痛觉TDRR
采用双曲线型TDRR模型Y=cs+1/(x-a)s+b进行非线性拟合,单独标出的点为3组大鼠在Focus值23时的TFL值,均为最大值15 s。,正常组(Normal):n=13,模型组(Model):n=27,假手术组(Sham operation):n=6。双因素方差分析(重复测量):因素光强度F=9.537,P<0.01;光强度×组间F=54.891,P<0.01;组间F=39.839,P<0.01。在此之后两两对比检验:#P<0.01(模型组与另外两组对比)。
表2 3组大鼠光辐射热痛觉TDRR的双曲线模型拟合参数

组别cs abR2正常组26.074.8743.152.0330.9730模型组41.297.303-17.471.2610.8971假手术组7.541.35729.001.2540.9955
3 讨论
PD为继阿尔茨海默病后第2个常见的神经退行性疾病,这种疾病的特点是黑质致密部的多巴胺能神经元损毁50%~70%,即纹状体DA严重缺失[20]。近年来PD动物模型的研究较多,造模的方法多种多样,目前神经毒性分子在神经生物学中被广泛用于损毁黑质纹状体DA系统,作为PD模型复制最常用的一种工具[21]。本研究采用了单侧纹状体两点法双靶点注射神经毒素6-羟多巴胺(6-OHDA)的方法制备PD大鼠模型[19],与其他脑区相比,注射纹状体区的造模成功率更高[22],本次实验观察到的结果也得到了验证,并为进一步的痛觉及其TDRR分析奠定了基础。
本次实验在造模成功之后,进行了机械痛阈值检测和光辐射热痛甩尾潜伏期检测两种痛觉的检测方法,结果显示机械痛阈值检测中与正常组和假手术组相比,模型组的机械痛阈值较小,显示帕金森病模型大鼠的机械痛觉出现了敏化;对光辐射热痛甩尾潜伏期数据进行常规的单因素方差分析,将3组分别在34、51、76强度进行单因素方差分析,结果显示光照强度在34、51、76时模型组大鼠的TFL均较另两组缩短,显示在各个强度上PD模型大鼠的痛觉都出现了敏化,这与机械痛检测的结果一致。进一步对光辐射热痛实验检测数据的TDRR进行重复测量的双因素方差分析,结果表明了随着光照强度的增加各组大鼠甩尾潜伏期逐渐缩短,在光强度和组间因素间存在交互影响,而且TDRR关系在3组之间存在差异。经过双曲线型TDRR模型Y=cs+1/(x-a)s+b的非线性拟合,结果呈现出随光照强度增加甩尾反应潜伏期逐渐缩短的负相关 TDRR关系曲线[11-13](光照强度增加时潜伏期不是无限缩短),这与药物剂量与其药物作用潜伏期的关系相类似,理论上该TDRR属于T型双曲线关系,但是该潜伏期有上限性数据,即有一个固定的最长潜伏期 15 s,应归于T型双曲线关系的特殊形式 P型双曲线关系[11-12],假手术和正常组同模型组一样有TDRR的存在,在对3组进行双曲线型TDRR模型Y=cs+1/(x-a)s+b非线性拟合得到的作图结果更清楚地显示模型组左移的特点。由此可见,机械痛阈值检测和光辐射热痛甩尾潜伏期检测结果都显示PD模型大鼠的痛觉敏化,而光辐射热痛觉TDRR的分析则进一步表明,PD模型大鼠同样存在痛觉TDRR,但出现痛觉TDRR曲线的左移,更全面地显示了PD模型大鼠的痛觉敏化特征。
临床研究表明,PD患者存在正中神经感觉受损的症状,因此就会导致疼痛耐受阈值下降[8],但PD疼痛的发生与疼痛阈值降低的相关性还缺乏充分的依据。本实验运用了类似于药理学的TDRR,通过恒定空间效应观察光照强度与时间效应的关系[12]。本实验是通过这种时反应量-效关系观察和分析了PD模型大鼠、正常组大鼠的TDRR特点,结果显示PD模型大鼠的TDRR曲线较正常组大鼠左移的情况,这证明了PD模型大鼠存在痛觉敏化的特点,表明了PD 疼痛的发生可能与阈值降低有关,给目前争论的PD 疼痛的发生是否与疼痛阈值降低有关[10]提供了参考,也为临床治疗和预防PD的疼痛症状提供了实验基础,对PD非运动性症状的相关研究也提供了新思路。至于PD模型大鼠痛觉敏化的机制还需要进一步的研究来阐明。

