羊肚菌多糖的提取分离纯化及保健功效研究进展
罗倩,邹荣灿,刘明月,向准
(1.贵州师范学院,贵州 贵阳 550018;2.贵州省环境工程评估中心六盘水办事处,贵州 六盘水 553001;3.六盘水市农业委员会,贵州 六盘水 553001;4.贵州省生物研究所,贵州 贵阳 550009)
羊肚菌系子囊菌门(Ascomycota)、盘菌纲(Pezizomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae)、羊肚菌属(Morchella)真菌的总称[1],又名美味羊肚菌、羊肚子、阳雀菌、蜂窝蘑、羊肚菜、草笠竹等,是世界公认的美味食药用菌,被誉为“菌中王子”,据《本草纲目》记载,羊肚菌具有化痰理气、补脑提神、润胃健脾、补肾强身之功效。现代研究表明,羊肚菌富含酶、多糖、氨基酸、甾醇、有机酸等活性物质,尤其是羊肚菌多糖越来越成为人们关注的焦点,具有抗肿瘤[2-4]、抗疲劳[5]、抗衰老[6]、抗氧化[7-8]、降血脂[9]、调节免疫[10-11]、抗菌[12]等功效。因此,无论在其药用还是保健领域,对羊肚菌多糖都具有重要的研究价值和经济价值。本文基于对羊肚菌多糖的提取分离纯化及保健功效的最新研究成果,对羊肚菌多糖的提取、分离纯化、理化性质、结构组成及保健功效等方面的研究进展进行综述,并分析各方法的优势和弊端,以期为羊肚菌多糖的深入研究及开发利用奠定理论基础。
1 羊肚菌多糖提取技术
1.1 热水浸提法
矫丽曼[13]以热水浸提法提取羊肚菌胞内多糖(Morchella Intracellular Polysaccharide,MIP),并探究其最佳工艺,研究结果表明最佳工艺条件为:料液比1 ∶25(g/mL),提取温度 90 ℃,浸提时间 2 h,95%乙醇沉淀,在此条件下,多糖得率为7.69%。并进一步对MIP 纯品的单糖组分分析表明,MIP 由D-甘露糖和D-半乳糖组成,摩尔比为1 ∶1.06。而郑燕丹[14]通过液体深层发酵获得羊肚菌菌丝体胞内多糖的最佳提取工艺条件为:料液比 1 ∶15(g/mL),浸提温度 90 ℃,浸提时间3 h,50%乙醇沉析。此法虽操作简单、条件温和、对仪器设备要求低,但也存在提取率低,提取不完全等缺点。
1.2 超声波辅助提取法
李美华等[15]采用超声波辅助提取法提取粗柄羊肚菌菌丝体多糖、菌丝体发酵液浓缩提取胞外多糖。探究二者的最佳提取工艺条件。结果表明:菌丝体多糖的最佳提取工艺条件为:料液比1 ∶20(g/mL),超声温度70 ℃,时间20 min,提取2 次;胞外多糖的最佳提取工艺条件为:浓缩倍数1 ∶5,浓缩温度50 ℃,醇沉浓度95%,pH 值为6。在此条件下,菌丝体粗多糖平均含量为56.76 mg/g,胞外多糖平均含量为1.28 mg/g。毕博等[16]用相同方法探究尖顶羊肚菌多糖提取工艺为:超声功率600 W,提取温度60 ℃,提取时间80 min,70%乙醇沉析,料液比 1 ∶40(g/mL),在此条件下,多糖得率为(2.25±0.04)%。顾旭锋[17]探究的羊肝菌多糖提取最佳工艺条件为:超声功率244 W,超声提取时间24 min,料液比 1 ∶33.90(g/mL),pH 值 8.78,还进一步证实羊肝菌多糖具有显著的抗疲劳活性。而孟超等[18]对羊肚菌富硒多糖研究发现:料液比1 ∶40(g/mL),提取时间30 min,乙醇浓度90%,是羊肚菌多糖提取的最适方案。超声波辅助提取羊肚菌多糖具有用时短、得率高、节省能源等优点。但超声波功率不易过高,否则会对多糖分子结构及特性产生负面影响。
1.3 酶提法
酶提法是利用酶对基体细胞结构的破坏,使细胞内多糖有效的溶出,具有得率高,专一性好,不破坏多糖结构等特点,Sun 等[19]探究酶提法提取富硒羊肚菌菌丝体多糖的最佳工艺条件,研究结果表明:在加酶量为1.5 %,提取时间2 h,酶解温度40 ℃,料液比为1 ∶15(g/mL)的条件下,多糖提取率可达 11.26%,该工艺简单、稳定、可行,适用于富硒羊肚菌菌丝体多糖的提取。
1.4 渗透压法
张娇等[20]研究渗透压法提取羊肚菌胞内多糖工艺。以高浓度盐溶液促进细胞质壁分离,破壁剂破壁处理后,溶胀促进多糖溶出。以硫酸-蒽酮显色法测定多糖含量,通过单因素和正交试验优化提取确定渗透压法最佳提取工艺条件为:浸提时间为120 min,NaCl浓度为20%,浸提温度90 ℃,pH 值为7.00,在此条件下多糖得率为19.56%。该法具有成本低,得率高,获得的目标产物便于进一步分离纯化等特点。
1.5 高压脉冲电场法
张玉等[21]利用高压脉冲电场法对液体深层发酵产羊肚菌菌丝体胞内多糖进行提取和分离。并考察电场强度、脉冲数和料液比等因素对多糖得率的影响,结果表明:多糖最佳提取工艺为:电场强度18 kV/cm,脉冲数 7,料液比 1 ∶27(g/mL),在此条件下多糖得率达56.03 μg/mL。并进一步采用DEAE-52 纤维素离子交换柱和葡聚糖凝胶色谱纯化,得到一种分子量高达2.48×106Da 的多糖F1。该法具有在多糖提取过程中,不产生热量,不破坏多糖结构的优点。
综上所述,用于羊肚菌多糖的提取方法主要有热水浸提法、超声波辅助提取法、酶提法、渗透压法、高压脉冲电场法,不同的提取方法提取的多糖得率有一定差异,每个方法均具独特的特点,因此,建议研究者应根据自己研究的目的、要求、条件及环境选择适合的方法进行提取。随着科学技术的不断进步,一些新的提取技术,如超临界CO2萃取法,双水相萃取法等,这些方法尚未用于羊肚菌多糖的提取,能否提高羊肚菌多糖的得率有待进一步研究。
2 羊肚菌多糖的分离纯化
经不同提取方法获得的羊肚菌多糖常含有蛋白、色素、脂类等杂质,需对其进一步纯化,脱蛋白的方法有Sevag 法、三氯乙酸法、柱层析法。Sevag 法的优点是条件温和、成本低、检测速率快、不会使多糖降解,缺点是多糖易损失。三氯乙酸法脱蛋白较完全、效率高,但易使多糖降解,易残留还会带来安全问题;脱色的方法有活性炭脱色法、H2O2氧化法、离子交换树脂法。H2O2氧化法较常用,该法具有操作简单、成本低廉、不引入其他杂质的优点,但仍需对H2O2使用浓度严格控制,浓度过高不仅会带来残留问题,甚至会破坏多糖的分子结构进而影响其生物活性。活性炭脱色的优点是吸附能力强,脱色成本低,但在吸附过程中也会损耗多糖。孙玉军等[22]优化羊肚菌胞外多糖的活性炭脱色工艺。以脱色率和多糖保留率为指标,考察活性炭用量、温度、pH 值以及脱色时间。结果表明:活性炭脱色的最佳条件为活性炭用量2.00%、温度50 ℃、pH 值5.00、脱色时间60 min,在此条件下,色素的脱除率为88.90%,多糖的保留率为84.30%,该脱色方法简便、易行,适合用于羊肚菌胞外多糖的脱色。
要进一步探究羊肚菌多糖的组成、分子质量、结构特征,在脱色脱蛋白的基础上还需深度分离纯化,常用的分离纯化方法有离子交换树脂法、凝胶过滤柱色谱法、亲和色谱法、膜分离法。Yang 等[23]从羊肚菌子实体中获得一种新的多糖(MEP-1),经脱蛋白、透析、DEAE-纤维素和Sephadex G-100 凝胶柱柱层析等手段纯化后采用化学法、高效液相色谱法、紫外光谱法和红外光谱法对多糖的理化性质进行测定,结果表明,多糖主要由葡萄糖、甘露糖、半乳糖、阿拉伯糖组成,平均分子量为43 625 Da。
相对于传统的分离技术,超滤膜分离技术具有诸优点,如成本低、节能、效率高、环保,在室温下可连续运行等特点。李蔚等[24]探究超滤技术浓缩纯化羊肚菌胞外多糖的最佳条件。以截留率和膜通量为参数,从超滤膜大小、超滤压力、超滤温度3 个因素优选最佳超滤条件。结果表明:用截留Mr 10×103的超滤膜,超滤压力0.10 MPa,超滤温度20 ℃,在此条件下,胞外多糖截留率达到95.72%。
3 羊肚菌多糖的理化性质及结构组成
分析羊肚菌多糖的理化性质及结构组成是研究其保健功效的重要前提,多糖的理化性质与其相对分子质量具有重要的关系见表1。
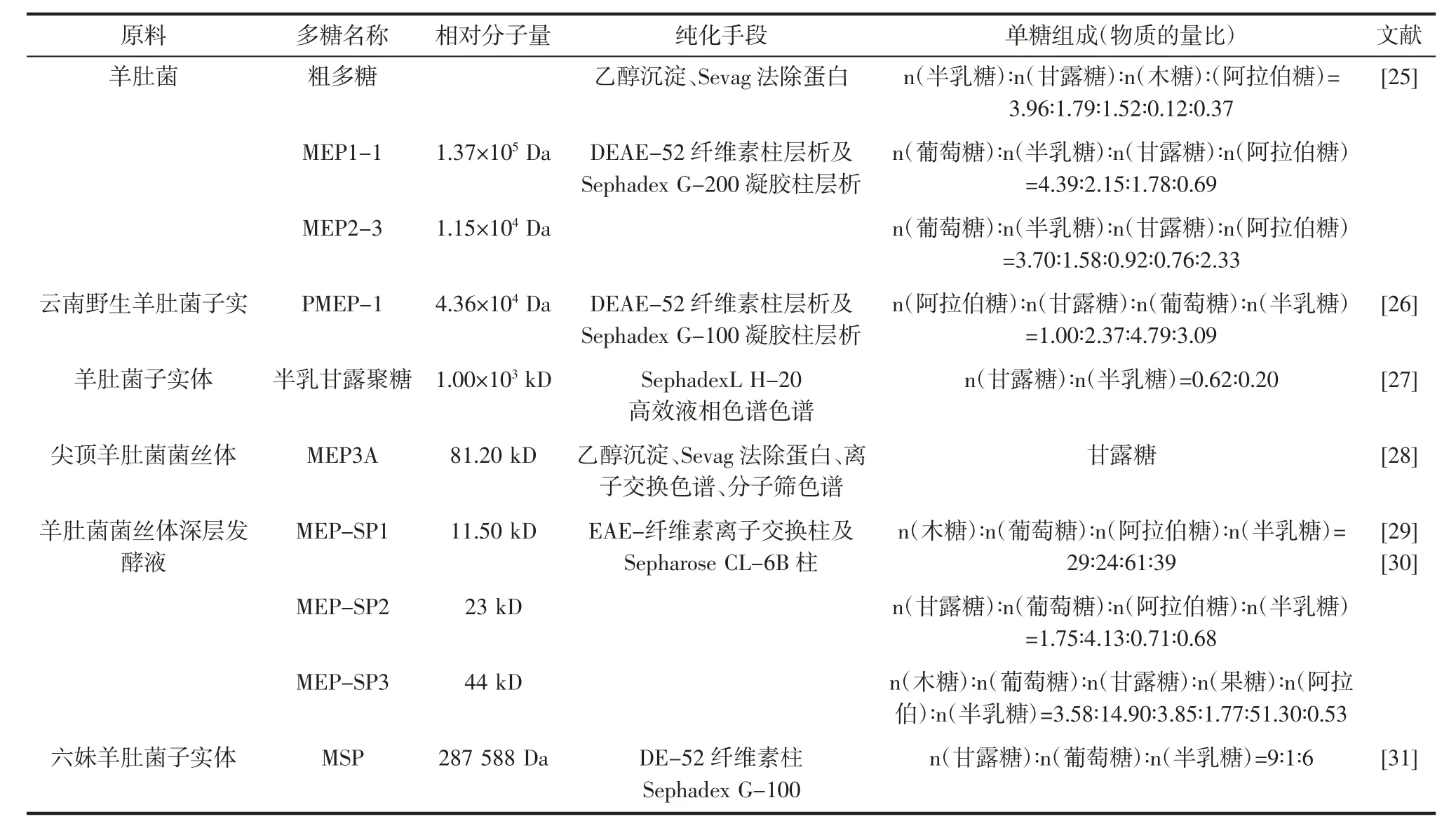
表1 羊肚菌多糖的纯化手段、相对分子质量及单糖组成Table 1 Purification methods,molecular weights and monosaccharide composition of Morchella polysaccharides
由表1可知,羊肚菌多糖为一种复合杂多糖,不同研究者研究的羊肚菌多糖的单糖组成,比例、种类等有一定差异,可能是原料的来源,提取方法及纯化手段不同导致。
4 羊肚菌多糖的保健功效
4.1 抗肿瘤
癌症已严重威胁人类的生命,现代研究表明羊肚菌多糖的具有显著的抗肿瘤活性,Liu 等[2]采用高压脉冲电场法获得羊肚菌多糖,并探究其对人结肠癌TH-29 细胞生长的抑制活性,研究结果表明,羊肚菌多糖具有显著抑制人结肠癌TH-29 细胞生长的作用,且多糖的量越大抑制效果越明显。LI 等[3]用羊肚菌与豆渣发酵获得羊肚菌粗多糖,经DEAE-Sephadex A-50 柱层析和Sephadex G-100 纯化后获得多糖组分MP-1,MP-3 和 MP-4,并对巨噬细胞(RAW267.4)、人肝癌细胞(HepG-2)、人宫颈癌细胞(HeLa 细胞)的活性进行评价,结果表明,MP-3 能增强巨噬细胞RAW264.7 细胞的免疫活性,MP-1 能有效抑制人肝癌细胞(HepG-2)的增长,当浓度为 50 μg/mL 时,抑制率为 68.01%。MP-1,MP-3 和 MP-4 能诱导人肝癌细胞(HepG-2)和宫颈癌细胞(HeLa 细胞)的凋亡。李谣等[4]以黑脉羊肚菌多糖为原料,研究羊肚菌多糖对人乳腺癌细胞MDA-MB-231 增殖和凋亡的影响。结果表明:在无细胞毒性范围内,羊肚菌多糖能显著抑制人乳腺癌细胞MDA 的增殖,半数有效浓度0.10 mg/mL,同时人乳腺癌细胞表现出多种细胞凋亡的形态学变化。
4.2 抗疲劳
段巍鹤等[5]以水提法获得羊肚菌胞外、胞内多糖并对小鼠应急性一次灌胃处理后进行负重游泳实验,结果表明,胞外多糖组和胞内多糖组小鼠游泳时间与对照组比较均具有显著性差异(P<0.05),胞外多糖组为(16.05±0.44)min,胞内多糖组为(14.56±2.86)min,对照组为(6.39±1.43)min,说明胞外多糖、胞内多糖对小鼠应急摄入后具有明显的抗疲劳作用。
4.3 抗衰老
马利等[6]以不同浓度尖顶羊肚菌Morchella conica Pers.胞外多糖提取物作用人皮肤成纤维细胞(human skin fibroblasts,HSF),检测对细胞形态、细胞增殖、衰老相关β-半乳糖苷酶活性、羟脯氨酸含量的影响,研究结果表明,125 μg/mL 尖顶羊肚菌胞外多糖提取物使HSF 细胞活力增加了25.20%,羟脯氨酸含量增加了12.10%,β-半乳糖苷酶活性降低了48.10%。说明适宜浓度尖顶羊肚菌胞外多糖提取物具有促进HSF细胞增殖、胶原蛋白合成,延缓细胞衰老的作用。
4.4 抗氧化
鲍敏等[7]利用粗柄羊肚菌菌丝体进行液体发酵培养,提取胞外多糖,并对胞外多糖体外抗氧化作用进行初步研究,结果表明:粗柄羊肚菌在1 mg/mL 时对DPPH 自由基和羟自由基以及超氧阴离子的清除率分别达到61.10%,32.80%和71.60%。表明,粗柄羊肚菌胞外多糖具有明显的抗氧化能力,具有开发为抗氧化类食品或药品的潜力。Fu 等[8]同样验证羊肚菌胞外多糖具有很强的清除自由基能力,能有效抑制血清丙二醛的形成,提高抗氧化酶的活性,且总抗氧化能力与多糖呈量效关系。
4.5 降血脂
明建等[9]对羊肚菌子实体多糖PMEP-1 降血脂作用进行动物试验,结果发现PMEP-1 显著降低了高脂大鼠的血清甘油三酯水平、血清低密度脂蛋白胆固醇和动脉粥样硬化指数,说明PMEP-1 具有降血脂作用,同时对冠心病及动脉粥样硬化也有一定的预防作用。
4.6 免疫调节
Su 等[10]采用 DEAE 纤维素和 Sephacryl S-300 HR色谱分离从羊肚菌中获得羊肚菌水溶性多糖(Morchella Water-soluble polysaccharides,MCP),并评价其免疫活性,结果表明,提取的MCP 可调节巨噬细胞内NO的生成,促进脾细胞增殖,经高效液相色谱、红外光谱和核磁共振谱分析表明,MCP 是均一的甘露聚糖,分子量为81.20 kDa,可作为一种有效的免疫调节剂。Huang 等[11]从尖顶羊肚菌中提取胞内多糖和胞外多糖,也具有很好的免疫活性,50 μg/mL~200 μg/mL 的胞外多糖和 25 μg/mL~200 μg/mL 的胞内多糖显著抑制巨噬细胞内NO 的产生。
4.7 抗菌
龙正海[12]等对羊肚菌子囊果多糖(Ascocarp polysaccharides)、菌丝体胞内多糖(Mycelium intracellular polysaccharides)、胞外多糖(Extracellular polysaccharides)进行体外抗菌实验表明,羊肚菌多糖对大肠杆菌Escherichia coli、枯草芽孢杆菌 Bacillus subtilis、金黄色葡萄球菌Staphylococcus aureus 以及放线菌Actinomycesbovis 的抗菌活性都比较强,而对霉菌Moulds 和酵母菌saccharomyce 的抗菌作用不明显。结论:3 种羊肚菌多糖均具有比较明显的抗细菌、抗放线菌活性。
5 展望
羊肚菌为世界性宝贵的食药用真菌,具有非常高的食用、药用价值。在食品、药品和保健品领域具有极大的开发潜力和广阔的应用前景。现代研究表明,用于羊肚菌多糖的提取方法主要有热水浸提法、超声波辅助提取法、酶提法、渗透压法、高压脉冲电场法;分离纯化方法有离子交换树脂法、凝胶过滤柱色谱法、亲和色谱法,膜分离法。以上方法各具独特的优势和弊端,建议研究者根据研究的目的、要求、条件及环境对其合理选择。试验表明羊肚菌多糖具有抗肿瘤、抗疲劳、抗衰老、抗氧化、降血脂、抗菌、免疫调节等功效。尽管羊肚菌多糖的保健功效已被大量试验证实,但仍存在一些问题亟须解决:1)羊肚菌多糖药理活性的作用机制尚未明确,多数保健功效仅以粗提物试验,对于如何开发符合临床需求的药物,还有待进一步深入研究;2)羊肚菌多糖的结构研究还处于一级结构中单糖的组成阶段,对于高级结构及构效关系、代谢机理等研究鲜有报道,有待进一步深入研究;3)目前羊肚菌栽培主要以六妹羊肚菌Morchella sextelata 和梯棱羊肚菌Morchellaimportuna 为主,七妹羊肚菌Morchella septimelata 也有少量种植[32],对于其它品种羊肚菌的规模化种植鲜有报道。到目前为止,羊肚菌的规模种植还存在产量不稳定、可重复性不高等问题。原因是羊肚菌易受气候条件、生长环境、自然灾害等影响,基于羊肚菌多糖的开发利用,攻克羊肚菌的人工规模化栽培迫在眉睫;4)以羊肚菌为原料开发的食品、保健品及药物制剂有具有保健功能的羊肚菌罐头[33]、羊肚菌茶[34]、保健酒[35],具有免疫调节、抗疲劳的羊肚菌多糖颗粒剂[36],预防或治疗更年期障碍的药剂[37]、但在市场上可见的羊肚菌产品仍然甚少,羊肚菌及羊肚菌多糖的开发利用及产品的工业化还需进一步加快步伐,具有巨大的市场前景。

