紫草素通过PI3K/Akt/mTOR 信号通路诱导人宫颈癌HeLa 细胞凋亡和自噬*
王书惠, 尹秀艳, 刘海英, 张亚男
(牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011)
宫颈癌(cervical cancer)是女性常见的恶性肿瘤之一,其发病率仅次于乳腺癌,为全球女性因癌致死的第2位病因,严重威胁女性健康[1]。中国每年新发病例达13.15万,宫颈癌死亡人数每年约5.3万,约占全部女性恶性肿瘤死亡人数的18.4%[2]。近些年宫颈癌的发病率呈不断上升的趋势,并且逐渐年轻化。近年来,中医中药治疗在肿瘤治疗中的作用越来越受到重视。紫草素(shikonin)为紫草干燥根的主要成分,具有抗菌、抗病毒、抗炎、促进伤口愈合和抗肿瘤等多种生物活性[3],尤其是其抗肿瘤作用,如乳腺癌、白血病、结肠癌、肝癌和人绒毛膜癌等,已被大量研究所证实[4-8]。也有研究证实,紫草素可抑制人宫颈癌HeLa细胞增殖和迁移侵袭,并诱导其凋亡[9-10]。但是有关紫草素对HeLa 细胞自噬(auto-phagy)的影响尚不清楚。因此,本研究观察了紫草素对HeLa 细胞凋亡和自噬的影响,以及凋亡和自噬的相互作用,并初步探讨PI3K/Akt/mTOR信号通路在其中的可能作用,为其在临床上治疗宫颈癌奠定实验和理论基础。
材 料 和 方 法
1 材料
1.1细胞株 人宫颈癌HeLa 细胞购于中国科学院上海细胞生物学研究所,接种在含10% 胎牛血清、青霉素链霉素混合液的RPMI-1640 培养液中,置于37 ℃、5% CO2细胞培养箱中培养,每隔2~3 d传代1 次,取对数生长期的细胞进行实验。
1.2药物与主要试剂 紫草素(纯度>99%)购自Axygen;二甲基亚砜(DMSO)、自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)和凋亡抑制剂Z-DEVD-FMK均购自Sigma;CCK-8试剂盒和Annexin V-PI 双染凋亡检测试剂盒均购自同仁化学研究所;微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3, LC3)、cleaved caspase-3磷酸化PI3K(p-PI3K)、磷酸化Akt(p-Akt)和磷酸化mTOR(p-mTOR)I 抗购自ATCC;相应Ⅱ 抗购自Santa Cruz。
1.3主要仪器 CO2培养箱(HERAcell 240i,Thermofisher Scientific);酶标仪(RT-6100, Rayto);低温高速离心机(GS-15R,BECKMAN);荧光显微镜(BX43,Olympus);电泳仪(PowerPac HV,BIO-RAD);蛋白成像系统(ChemiDoc XRS,BIO-RAD)。
1.4紫草素配制 紫草素溶解于DMSO(浓度<1%),配制成64 μmol/L溶液,-20℃保存,临用时,以RPMI-1640培养液稀释到所需浓度。
2 方法
2.1CCK-8法检测HeLa 细胞细胞活力 HeLa 细胞以1.5×104/well接种于96孔板,每孔100 μL,置于37 ℃、5% CO2饱和湿度的培养箱中培养24 h。待细胞贴壁后,以加入不同浓度(4、8、16、32和64 μmol/L)紫草素的细胞作为实验组,以加入等量RPMI-1640培养液的细胞作为对照组,另外设置不含细胞只加入等量RPMI-1640培养液的空白对照组,每组设3个复孔。37 ℃、5% CO2、饱和湿度的培养箱中分别培养24、48和72 h后。每孔加入用RPMI-1640培养液稀释成的含有10% CCK-8 试剂的工作液10 μL,轻轻摇匀,37 ℃、5% CO2、饱和湿度的培养箱继续孵育90 min。用酶标仪(波长450 nm)检测每孔吸光度(A)值,计算细胞活力及半数抑制浓度(IC50)。细胞活力(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组)×100%。
2.2Annexin V/PI 双染法检测HeLa细胞凋亡 HeLa 细胞以1.5×104/well接种于6孔板,每孔100 μL,置于37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。待细胞贴壁后,以加入不同浓度(8、16和32 μmol/L)紫草素的细胞作为实验组,以加入等量RPMI-1640培养液的细胞作为对照组,每组设3个复孔。37 ℃、5% CO2、饱和湿度的培养箱中培养24 h后。弃去原培养基,0.25%胰蛋白酶消化细胞,终止消化后,1 000 r/min离心5 min,弃上清,PBS 洗涤2 次。按照试剂盒说明书,以稀释的结合缓冲液重悬细胞。取100 μL 细胞悬液于5 mL 流式管中,然后加入Annexin V-FITC 5 μL,混匀,最后加入PI 染色液10 μL,轻轻混匀,用流式细胞仪检测HeLa 细胞凋亡率。
2.3GFP-LC3质粒转染分析观察HeLa 细胞自噬小体 HeLa 细胞培养操作和培养条件同“2.2”培养24 h。待细胞贴壁后,按照转染试剂说明书,将GFP-LC3质粒和Lipofectamine 2000 转染试剂分别加入无血清RPMI-1640培养基中,室温静置5 min 后混合,再次静置20 min,将其加入到细胞中,使之均匀分散。37 ℃、5% CO2培养箱中培养4 h 后更换培养基,继续培养48 h。以加入不同浓度(8、16和32 μmol/L)紫草素的细胞作为实验组,以加入等量RPMI-1640培养液的细胞作为对照组,每组设3个复孔。37 ℃、5% CO2、饱和湿度的培养箱中培养24 h后。弃去原培养基,PBS 洗涤3 次,置荧光显微镜下观察GFP-LC3 荧光聚集情况,如发生自噬则细胞内出现绿色点状聚集的自噬小体,否则呈现弥漫性绿色荧光。
2.4Western blot 分析检测自噬和凋亡相关蛋白及PI3K/Akt/mTOR信号通路蛋白的表达 HeLa 细胞以1.5×104/well接种于96孔板,每孔100 μL,置于37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。检测LC3和cleaved caspase-3蛋白水平:待细胞贴壁后,实验分为对照组(加入等量RPMI-1640培养液)、紫草素(shikonin)组(加入32 μmol/L shikonin)、3-MA组(加入5 mmol/L 3-MA)、Z-DEVD-FMK组(加入5 mmol/L Z-DEVD-FMK)、shikonin+3-MA组(加入32 μmol/L shikonin+5 mmol/L 3-MA)和shikonin+Z-DEVD-FMK组(加入32 μmol/L shikonin+5 mmol/L Z-DEVD-FMK)。检测LC3、p-PI3K、p-Akt和p-mTOR蛋白水平:待细胞贴壁后,分组同“2.2”。以上各组均设3个复孔。37 ℃、5% CO2、饱和湿度的培养箱中培养24 h。细胞经RIPA 裂解液冰上裂解30 min。4 ℃、12 000 r/min离心5 min,取上清。BCA 蛋白定量法测定蛋白浓度定量。沸水煮沸5 min,蛋白完全变性后,冷却。取40 μg蛋白上样进行10% SDS-PAGE,同时以GAPDH(或β-actin)转印到PVDF 上。用含5% 脱脂奶粉的PBST 封闭1 h,分别加入对应I 抗4 ℃孵育过夜,TBST 洗膜后,加入对应Ⅱ 抗室温摇床孵育2 h,TBST 洗膜3 次。滴入ECL 化学发光液后放入暗盒中压片并依次显影、定影,凝胶成像系统分析蛋白条带灰度值。结果以目的蛋白相对表达量表示。
3 统计学处理
实验数据用均数±标准差(mean±SD)表示,利用GraphPad Prism 5.0 软件进行统计学分析,各组数据采用单因素方差分析,组间两两比较采用SNK检验。以P<0.05表示差异有统计学意义。
结 果
1 紫草素对HeLa 细胞细胞活力的影响
CCK-8实验结果显示,不同浓度的紫草素作用于HeLa 细胞24、48和72 h后,与对照组比较,随着浓度的增加和时间的延长,细胞活力显著降低,呈一定的浓度-时间依赖关系(P<0.05或P<0.01),见图1。作用24、48和72 h,紫草素对HeLa 细胞的IC50分别为42.8、19.1和14.7 μmol/L。另外,由于4 μmol/L的紫草素作用于HeLa细胞24 h,细胞活力与对照组比较差异不具有统计学意义(P>0.05),因此,本研究采用8、16和32 μmol/L的紫草素作用于HeLa细胞24 h用于后续实验。
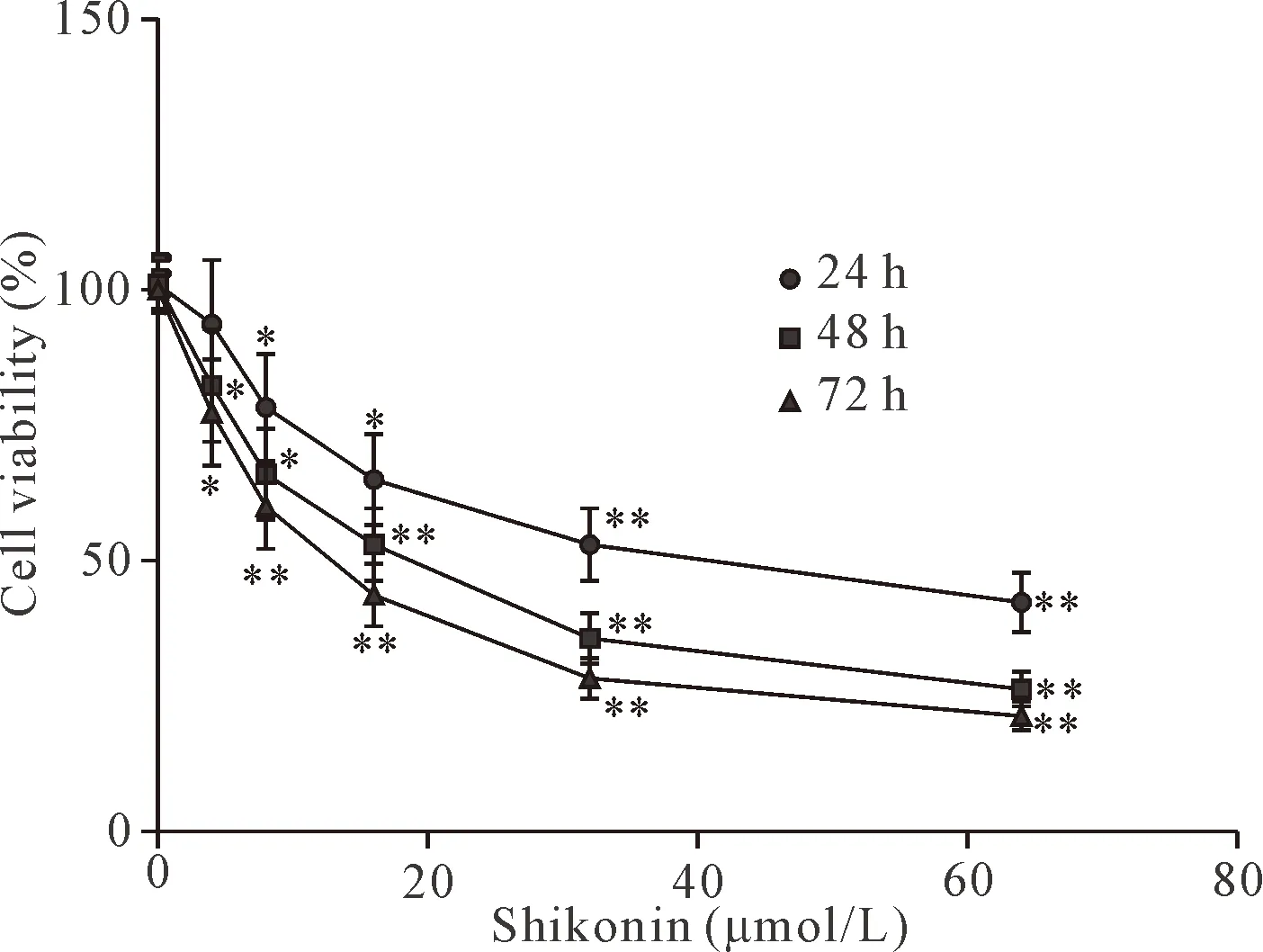
Figure 1.The effects of shikonin on the viability of HeLa cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group.
图1 紫草素对HeLa 细胞细胞活力的影响
2 紫草素对HeLa 细胞凋亡的影响
Annexin V-FITC/PI双染法结果显示,与对照组比较,HeLa细胞经8、16和32 μmol/L的紫草素作用后,凋亡率显著升高(P<0.05或P<0.01),见图2。
3 紫草素对HeLa 细胞自噬的影响
GFP-LC3质粒转染分析结果显示,转染GFP-LC3 质粒的HeLa细胞经8、16和32 μmol/L的紫草素作用后,细胞质中出现绿色点状聚集的自噬小体,而对照组细胞中极少观察到点状聚集的自噬小体形成,见图3。
4 紫草素对HeLa 细胞自噬相关蛋白表达的影响
Western blot 分析结果显示,HeLa 细胞凋亡经8、16和32 μmol/L的紫草素作用后,LC3-II/LC3-I显著升高(P<0.05或P<0.01),说明LC3-I向LC3-II转换增多,从而诱导自噬,见图4。
5 紫草素与自噬或凋亡抑制剂共同作用对细胞凋亡和自噬的影响
Western blot 分析结果显示,与shikonin组比较,shikonin+3-MA组由于自噬抑制剂的存在,LC3-II/LC3-I显著降低(P<0.01),说明LC3-I向LC3-II转换降低,自噬被抑制,而同时cleaved caspase-3 蛋白表达显著升高(P<0.05),说明凋亡作用显著增强,见图5A;与shikonin组比较,shikonin+Z-DEVD-FMK组由于凋亡抑制剂的存在,HeLa 细胞凋亡被显著抑制,表现为cleaved caspase-3 蛋白表达降低(P<0.01),而同时自噬增强,表现为LC3-II/LC3-I显著升高(P<0.05),见图5B。

Figure 2.The effects of shikonin on the apoptosis of the HeLa cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图2 紫草素对Hela细胞凋亡的影响

Figure 3.The effects of shikonin on the autophagy of the HeLa cells (×400).
图3 紫草素对HeLa 细胞自噬的影响

Figure 4.The effects of shikonin on the expression of LC3 in the HeLa cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图4 紫草素对HeLa 细胞LC3蛋白表达的影响
6 紫草素对HeLa 细胞PI3K/Akt/mTOR信号通路相关蛋白表达的影响
Western blot 分析结果显示,与对照组比较,HeLa细胞经8、16和32 μmol/L的紫草素作用后,p-PI3K、p-Akt和p-mTOR表达显著降低(P<0.05或P<0.01),见图6。
讨 论
凋亡和自噬是细胞程序性死亡的2种死亡方式,可共同作用于肿瘤细胞,促进肿瘤细胞死亡[11]。自噬又称为Ⅱ型程序性细胞死亡,是广泛存在于真核细胞中的一种程序性死亡方式,其通过单层或双层膜包裹自身细胞质蛋白或细胞器形成自噬小体,再与溶酶体融合形成自噬溶酶体,最终使被包裹的内容物降解,以实现“自身消化”和细胞器更新的过程[12-13]。本研究结果显示,紫草素可使转染GFP-LC3 质粒的HeLa 细胞中出现绿色点状聚集的自噬小体,提示紫草素可诱导HeLa 细胞自噬。在自噬过程中,LC3 发挥了重要作用。LC3 存在LC3-I 和LC3-II 2种形式,其中LC3-I 为非活化形式,自噬开始后,LC3-I 会酶解掉一小段多肽,转变为LC3-II 并聚集到自噬体膜上[14-15],因此LC3-II 水平在一定程度上反映了自噬的程度,为细胞内自噬水平的特异性蛋白标记物[16-17]。本研究结果显示,紫草素具有明显的抑制HeLa 细胞活力及促进LC3 的表型转换的作用,提示紫草素能够诱导HeLa 细胞自噬,从而抑制其细胞活力。
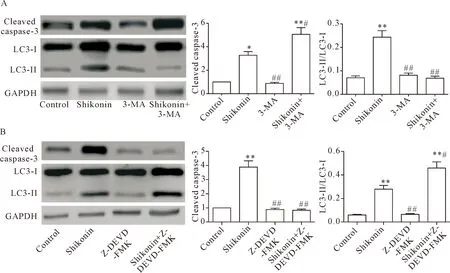
Figure 5.The effecfs of shikonin combined with 3-MA or Z-DEVD-FMK on the apoptosis (A) and autophagy (B) of the HeLa cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsshikonin group.
图5 紫草素与3-MA或Z-DEVD-FMK共同作用对HeLa 细胞凋亡和自噬的影响

Figure 6.The effect of shikonin on the protein levels of p-PI3K, p-Akt and p-mTOR in the HeLa cells. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图6 紫草素对Hela 细胞p-PI3K、p-Akt和p-mTOR蛋白表达的影响
本研究用流式细胞术检测细胞凋亡,结果显示,紫草素可诱导HeLa细胞凋亡。
凋亡与自噬的关系相当复杂,而其互补作用最为常见且被广泛认同[18]。本研究结果显示,紫草素与3-MA共同作用于HeLa 细胞后,cleaved caspase-3 蛋白表达升高,凋亡作用增强。同时紫草素与Z-DEVD-FMK共同作用于HeLa 细胞后,LC3-II/LC3-I显著升高,自噬作用也增强。以上结果提示,紫草素能够诱导HeLa 细胞凋亡和自噬,并且其凋亡和自噬作用具有协同作用,从而抑制其细胞活力。
PI3K/Akt/mTOR 信号通路由PI3K、Akt和mTOR 三种蛋白酶构成,激活PI3K/Akt /mTOR 信号通路可抑制多种刺激诱发的细胞凋亡和(或)自噬,促进细胞周期进程,从而促进肿瘤细胞的生存和增殖[19-20]。本研究结果显示,紫草素显著降低HeLa 细胞p-PI3K、p-Akt和p-mTOR的表达,以上结果提示,紫草素可能通过抑制PI3K/Akt/mTOR信号通路,从而诱导HeLa 细胞发生凋亡和自噬,并进一步抑制其细胞活力。
综上所述,紫草素可通过抑制PI3K/Akt/mTOR信号通路诱导HeLa 细胞发生凋亡和自噬,并进一步抑制其细胞活力。并且紫草素诱导HeLa 细胞凋亡和自噬具有协同作用,即紫草素与自噬抑制剂共同作用能够更好地诱导HeLa 细胞凋亡,紫草素与凋亡抑制剂共同作用能够更好地诱导HeLa 细胞自噬。

