CTAB-PdNPs聚集体对4-氯硝基苯的催化加氢研究
黄彬彬 梁凤仪 杨湛 谢寄托

摘 要:利用表面活性剂的静电作用和自组装特性,在CTAB诱导下合成CTAB-PdNPs聚集体.研究显示,阳离子表面活性剂与阴离子Pd前驱体之间的静电作用力能有效抵消阳离子亲水头基团CTA+之间的静电斥力,从而从分子水平驱动形成表面活性剂组装体. 研究选取水体中微污染物4-氯硝基苯为研究对象,以催化还原脱氯反应为探针反应,结果显示合成的CTAB-PdNPs聚集体具有高催化活性和强脱卤能力,可在90 min内将4-氯硝基苯完全脱氯形成苯胺. 研究进一步考察了Pd投加量、CTAB浓度、起始pH值、硼氢化钠的投加量等因素对4-氯硝基苯的催化脱氯过程的影响,最佳条件为:Pd投加量为0.125 mmol/L,CTAB濃度为1.00 mmol/L,起始pH值为5,硼氢化钠的投加量为15 mmol/L.该CTAB-PdNPs聚集体还显示了较强的催化稳定性,8次循环实验后仍可达到81.9%的脱氯效率.本研究不仅报道了一种简易的合成特定规则形状PdNPs组装体的新方法,还为环境中微污染物的修复去除提供了一种可行技术.
关键词:催化还原;对氯硝基苯;贵金属纳米颗粒聚集体;表面活性剂
中图分类号:X592 文献标志码:A
Study on Catalytic Hydrogenation of P-Chloronitrobenzene
by CTAB-Pd Nanoparticles
HUANG Binbin1,2,LIANG Fengyi1,2,YANG Zhan1,2,XIE jituo1,2
(1. College of Environmental Science and Engineering,Hunan University,Changsha 410082,China;
2. Key Laboratory of Environmental Biology and Pollution Control (Hunan University),
Ministry of Education,Changsha 410082,China)
Abstract: This research mainly used the electrostatic interaction and self-assembly of surfactant to induce the formation of CTAB-PdNPs aggregation. The results showed that the electrostatic interaction between the cationic surfactant and anionic Pd precursor can shield the electrostatic repulsion between the hydrophilic groups of CTA+. It drives the formation of CTAB-PdNPs aggregation on the molecular level. This study chose p-CNB as target pollutant and its catalytic reduction as probe, showing that CTAB-PdNPs have high catalytic activity and dehalogenation ability which can convert p-CNB into aniline in 90 minutes. Besides, this study further investigated the effect of Pd dosages,CTAB concentration, initial pH and NaBH4 dosages on the catalytic reduction. The optimum conditions were Pd dosage value of 0.125 mmol/L,CTAB concentration value of 1.0 mmol/L,initial pH value of 5 and NaBH4 dosage value of 15 mmol/L. The dechlorination efficiency of p-CNB can reach up to 81.9% after eight times recycle tests,which proves the aggregation has an outstanding catalytic stability. Above all,this study not only reports a new method of synthesizing PdNPs assembly with special regular shapes,but also provides a feasible technology for the removal of micro-pollutants in the environment.
Key words:catalytic reduction;p-chloronitrobenzene;noble metal nanoparticles aggregation;surfactant
氯硝基苯类物质是一类在环境中具有长期残留性、高毒性、生物富集性、迁移性以及难被生物降解的化合物. 同时,氯硝基苯类化合物还是一类具有致癌、致畸、致突变“三致”效应,且具有遗传毒性的有机化合物[1-3]. 它可以通过多种途径被人体摄取,
从而对人体和环境构成持久性威胁.对氯苯胺以及其它苯胺类物质是制药、染料和农药等工业生产过程中的重要中间体;由氯硝基苯类物质还原制备上述中间体是精细化工领域的重要方向之一.通过贵金属纳米催化剂对4-氯硝基苯类物质进行催化加氢反应,具有产生废气废液少、废物易处理、反应条件温和、能耗低、产物易分离、催化剂可循环使用等优点[4]. 在所有贵金属催化剂中,钯具有高催化活性,以及强加氢能力,被广泛应用到有机物的催化加氢过程中[5].
与传统的贵金属催化剂相比,超细贵金属Pd纳米颗粒(PdNPs),具有更大的比表面积和表面能,催化性能得到显著提高. 然而,PdNPs的团聚会使其催化性能及稳定性受到很大影响. 因此,近年来,许多科研工作者致力于研究合适的载体材料来使纳米材料免于发生团聚,从而保持很高的分散性,进而维持优良的催化性和稳定性.根据载体的理化性质,可将其分为无机载体和有机载体. 常见的无机载体如二氧化硅、四氧化三铁、二氧化钛、氧化铝以及活性炭等碳基材料,具有易分离、比表面积大、机械性能良好等优点,是很好的载体材料[6-7]. 表面活性剂、封端剂、聚合物以及金属有机骨架(MOFs)等高分子有机化合物,因其结构具有自组装及可调控特性,也可用来作为软模板合成具有有序形状和高分散的纳米催化剂[7]. 尤其,表面活性剂为自组装提供了一种潜在合成有序及超细纳米金属颗粒的方法.表面活性剂的存在,一方面由于其丰富的官能团和离子性质而可作为金属前驱体的吸附结合位点,进而合成具有很高分散性和稳定性的金属纳米颗粒;另一方面,表面活性剂的胶束结构能诱导其合成颗粒组装体. 氯硝基苯类物质具有疏水特性,很难溶解到水中,而良好的溶解性是异相催化反应的关键. 基于上述问题,利用疏水作用及有机物表面丰富的官能团结构,研究提出能否设计出一种新型反应体系,在稳定分散纳米金属颗粒的同时,能够吸附富集具有疏水特性的有机卤化物. 这样,便在同一体系中高度集中了催化剂、反应物等,在热力学上更利于脱卤加氢反应的发生.本研究选取十六烷基溴化铵(CTAB)为代表性表面活性剂,以Pd为催化剂,拟合成表面活性剂诱导下的PdNPs聚集体,考察不同影响因素对4-氯硝基苯的催化脱氯加氢性能的影响,并揭示相关原理.
1 材料和方法
1.1 实验材料与仪器
实验过程中所用到的主要实验试剂为:十六烷基三甲基溴化铵(CTAB),购于天津市光复精细化工有限公司(分析纯);氯化钯、4-氯硝基苯(p-CNB)、4-氯苯胺(CAN)、苯胺(Aniline)、硼氢化钠(NaBH4),均购于国药集团化学试剂有限公司(分析纯).
实验过程中所用到的主要仪器有数显控磁力搅拌器(金坛市大地自动仪器厂85-2);紫外可见分光光度计(德国Specord 50plus);pH计(上海仪电科学仪器有限公司PHS-3C);高效液相色谱仪(美国Agilent 1100).
1.2 实验方法
1.2.1 贵金属纳米催化剂的制备方法
称取一定量的氯化鈀溶于10 mL、pH为1.0的盐酸溶液中,再将溶液转移至容量瓶中,配置浓度为1 mmol/L的氯钯酸(H2PdCl4)溶液. 将5 mL的氯钯酸溶液和5 mL的CTAB溶液加入100 mL的圆底烧瓶中,在600 r/min的转速下搅拌20 min,使其充分混合,得到淡粉色溶液即为前驱体溶液;称取0.018 9 g硼氢化钠溶于100 mL超纯水中,滴定10 mL该溶液于前驱体溶液中. 前驱体溶液由淡粉色转变成黑色,暗示着合成了表面活性剂诱导下的PdNPs聚集体(CTAB-PdNPs).
1.2.2 对氯硝基苯的催化加氢实验
在合成的CTAB-PdNPs催化剂体系中,加入一定量超纯水和4-氯硝基苯溶液,用1 mol/L的盐酸溶液和1 mol/L的氢氧化钠溶液调节反应体系的起始体系pH,并且使得反应体系总体积为40 mL.取初始样,将体系密封,然后注射一定量的硼氢化钠,以此为反应起始时间,分别在反应的1、3、5、10、20、30、45、60、90、120 min取样. 本实验主要是对CTAB-PdNPs催化还原4-氯硝基苯实验进行实验参数优化,优化参数为体系中Pd的投加量、CTAB的投加量、反应起始pH值以及硼氢化钠的投加量.
1.3 测试及表征方法
样品中的反应产物主要是通过高效液相色谱仪(HPLC)对样品进行定量分析.本实验研究所用的色谱柱为Agilent ZORBAX Eclipse Plus C18(4.6×250 mm,5 μm). 检测分析条件如下:流速为1.0 mL/min,流动相为乙腈和水体积比(60 ∶ 40),波长为256 nm,柱温为25 ℃.
本实验研究采用了超高分辨透射扫描电子显微镜(HRTEM,JEM-3010,operated at 200 kV)、X射线能量散射光谱(EDS,JEM-3010)、动态光散射(DLS,Zetasizer Nano-ZS90)对贵金属纳米晶簇催化剂进行表征分析.
2 结果和讨论
2.1 纳米催化剂CTAB-PdNPs的表征
图1为Pd在有CTAB修饰和无CTAB修饰的条件下分别合成的CTAB-PdNPs和Pd0颗粒所对应的TEM图以及EDS能谱图. 从图1中可以清晰地观察到,图1(a)中CTAB-PdNPs为边界清晰的立方体结构,而图1(b)中Pd颗粒为较大的球形聚集体.这是由于表面活性剂CTAB在水中是以CTA+的形式存在,CTAB之间会因为所带电荷而产生一定的静电排斥力. 而负价态的贵金属盐离子(氯钯酸)可通过静电吸引与CTA+相互结合,从而掩蔽了表面活性剂分子之间的静电排斥力[8]. 因此,从分子水平驱动CTAB与贵金属盐离子形成表面活性剂组装体,当加入硼氢化钠还原时,并不破坏聚集体的结构,成功地合成了具有特定规则形状的PdNPs聚集体.该聚集体呈纳米立方体形,大小为100 nm左右,如图1(a)所示.通过DLS数据分析显示(见1(a)),该体系合成的纳米颗粒尺寸为99.7 nm,与TEM结果一致,所制备的聚集体颗粒大小均一、分散.而当溶液中无CTAB存在时,形成的Pd颗粒易发生团聚作用,形成较大颗粒.实验中发现无CTAB修饰的Pd颗粒在还原合成几分钟后,迅速发生沉积并部分黏附到器壁上.
2.2 实验参数对4-氯硝基苯催化还原实验的影响
2.2.1 CTAB-PdNPs催化还原4-氯硝基苯
图2为CTAB-PdNPs纳米催化体系催化还原p-CNB的反应过程图.该实验的反应条件为:25 ℃,1 000 r/min,0.5 mmol/L p-CNB,1.0 mmol/L CTAB,0.125 mmol/L Pd,pH为5,15 mmol/L NaBH4.由图2可知,p-CNB催化还原加氢反应主要分为两个过程,首先在3 min内迅速转化为4-氯苯胺,然后4-氯苯胺逐渐转化为苯胺,整个反应过程在90 min内全部完成,显示出极强的催化性能.研究推测,在体系中,4-氯硝基苯的还原过程主要分为3个步骤:首先,4-氯硝基苯在质量转移扩散的动力学控制下,从溶液中扩散到催化剂颗粒表面.然后,4-氯硝基苯与纳米催化剂形成中间过渡态. 4-氯硝基苯上硝基基团的N原子和O原子都有很高的电负性,致使硝基基团具有电负性. 另外,4-氯硝基苯上的氯因为具有孤对电子,也具有电负性. 需要指出的是,硝基基团的电负性大于氯的电负性,即硝基基团的吸电子能力大于氯的吸电子能力.由于CTAB中N原子的高电负性以及贵金属单质本身的特性,致使催化剂表面处于富电子的状态. 因此,硝基基团会优先氯吸附在催化剂表面,并且与催化剂形成中间过渡态. 这是4-氯硝基苯催化还原过程中至关重要的一个环节. 最后,电子及质子从催化剂转移到4-氯硝基苯与催化剂形成的过渡态化合物上,从而引发4-氯硝基苯还原. 4-氯硝基苯上的硝基基团先被催化还原成氨基,即生成4-氯苯胺;然后再进一步还原,发生脱氯反应生成苯胺. 一方面是因为硝基基团优先氯吸附在催化剂表面,因此催化剂表面的电子和质子会首先攻击硝基基团;另一方面,是因为硝基基团上的O原子比N原子更具有电负性,导致N—O的极化.因此N原子带部分正电荷具有更大的电负性,使得硝基基团更容易被还原.硝基基团還原成氨基后,反应体系中的电子由纳米Pd的空d轨道传递到4-氯苯胺的大π键上,激活了苯环,降低了反应能,从而促进了活化氢对苯环的亲电加成,从而诱导C—Cl断裂,最终生成苯胺[9-12].
2.2.2 纳米催化体系中Pd投加量对还原实验的影响
在CTAB-PdNPs催化降解4-氯硝基苯实验过程中,所有的化学反应主要是在PdNPs纳米颗粒表面进行. 因此,实验体系中Pd的投加量对催化降解反应具有重要影响.本研究考察了Pd投加量对4-氯硝基苯催化去除的影响,分别选取0、0.025、0.050、0.075、0.100、0.125 mmol/L 6个不同的Pd浓度梯度,结果如图3所示. 该实验的反应条件为:25 ℃,1 000 r/min,0.5 mmol/L p-CNB,1.0 mmol/L CTAB,pH为5,15 mmol/L NaBH4.
研究结果显示,当Pd的投加量分别为0、0.025、0.050、0.075、0.100和0.125 mmol/L时,4-氯硝基苯的脱氯效率分别为0%、83.5%、90.7%、97.4%、98.6%、100.0%.当继续增加Pd的投加量,4-氯硝基苯的脱氯速率会有进一步提高,如当将Pd的投加量增加到0.20 mmol/L时,对比0.125 mmol/L Pd,完全脱氯时间从90 min降低至60 min. 由此看出,随着实验体系中Pd投加量的增加,CTAB-PdNPs对4-氯硝基苯的催化还原速率随之增加,4-氯硝基苯的脱氯效率也逐渐增加.这是因为随着Pd投加量的增加,CTAB-PdNPs聚集体中PdNPs也随之增加.这意味着,更多的PdNPs加入反应中,催化剂表面参加反应的活性位点也相对增加. 因此,一方面反应体系供氢体NaBH4的水解速率会增加,即活化性氢的产生速率增大;另一方面可催化还原的活性位点也更多,即4-氯硝基苯催化降解速率增大. 综合考虑脱氯效率及催化剂成本,研究选取0.125 mmol/L为最佳催化剂投加量.
2.2.3 体系中CTAB的负载量对还原实验的影响
确定最佳Pd的投加量以后,再确定体系中CTAB的最佳投加量. 体系中CTAB的浓度一方面会影响CTAB-PdNPs聚集体的形状和结构,另一方面也会对4-氯硝基苯的催化还原速率产生潜在影响.研究选取CTAB的浓度分别为0、0.25、0.50、1.00、2.00、10.00 mmol/L 6个梯度,考察其对4-氯硝基苯催化还原的影响,结果如图4所示. 该实验的反应条件为:25 ℃,1 000 r/min,0.5 mmol/L p-CNB,0.125 mmol/L Pd,pH为5,15 mmol/L NaBH4 .
图4中显示了不同CTAB投加量对4-氯硝基苯的脱氯效率的影响.当体系中CTAB的加入量分别为0、0.25、0.50、0.75、1.00、2.00和10.00 mmol/L时,4-氯硝基苯的脱氯效果分别为16.4%、94.6%、95.2%、96.6%、100.0%、94.2%和89.2%.分析实验数据得到,4-氯硝基苯的脱氯效率随着CTAB负载量的增加呈现先增加再减小的趋势.这是由于CTAB的存在一定程度上可以抑制PdNPs之间的相互聚集沉降,致使CTAB负载后的PdNPs具有良好的分散性和稳定性.并且CTAB上极性部分的吸电子效应和传递电子效应,从而进一步提高了CTAB-PdNPs的催化性能.CTAB的投加量越大,CTAB-PdNPs的分散性、稳定性越良好,CTAB传递电子的速率越快.但是由于CTAB与PdNPs的结合会占据其表面上的活性位点,因此当CTAB的投加量过多时,CTAB占据了PdNPs颗粒表面过多的活性位点,从而抑制了4-氯硝基苯的脱氯反应. 此外,当CTAB的负载量过多时,体系中会有多余的CTAB再形成胶束,因此4-氯硝基苯不再只自发扩散到CTAB-PdNPs内,还会溶解于CTAB胶束内,也抑制了4-氯硝基苯与PdNPs接触而无法被还原脱氯.当CTAB负载量为10.00 mmol/L时,反应120 min后仍有3.9%的4-氯硝基苯未被催化还原.综上,CTAB-PdNPs对4-氯硝基苯的催化还原实验中,CTAB的最佳负载量为1.00 mmol/L.
2.2.4 体系中反应起始pH值对还原实验的影响
图5为反应体系中不同初始pH值对CTAB-PdNPs催化还原对氯硝基苯的影响.本实验研究是以硼氢化钠为供氢源,而硼氢化钠的水解是一个十分容易受反应体系pH值影响的反应,因此需要探究实验反应体系初始pH值的影响,确定最佳反应pH值.该实验的反应条件为:25 ℃,1 000 r/min,0.5 mmol/L p-CNB,1.0 mmol/L CTAB,0.125 mmol/L Pd,15 mmol/L NaBH4 .
由图5可知,体系反应起始pH对催化剂CTAB-PdNPs催化4-氯硝基苯的脱氯效率有一定的影响.当体系反应起始pH分别为2、5、7、9时,4-氯硝基苯的脱氯效率分别为85.5%、100.0%、92.8%、88.3%.随着体系的反应起始pH值的升高,4-氯硝基苯的脱氯效率和反应速率均随之先增加后减小,但是其脱氯反应的起始时间随体系起始pH值的升高而延后.因为硼氢化钠的水解十分容易受反应体系pH值影响,当反应体系为酸性条件时,大量H+会催化促进硼氢化钠的水解,产生大量的氢气,此时硼氢化钠的水解反应如方程(1)所示;当反应体系为中性环境时,体系中H+较少,硼氢化钠的水解反应主要为方程(2)所示;当反应体系为碱性时,硼氢化钠水解产氢的反应会受到抑制,硼氢化钠发生耦合反应,如方程(3)所示[13-14].
BH-4 + 4H+ + 3H2O→B(OH)3 + 4H2 (1)
BH-4 + 4H2O→B(OH)3 + OH- + 4H2 (2)
BH-4 + 8OH-→BO-2 + 6H2O + 8e- (3)
当反应起始pH为2时,即反应体系为酸性环境,体系中有很多的氢离子,硼氢化钠会与其迅速反应生成大量的氢气,但是PdNPs催化裂解氢气的速率不足以将产生的全部氢气裂解. 因此,大量的氢气会释放到反应装置的顶空,随着反应的进行再逐渐溶解、裂解为活性氢,从而致使反应速率大大降低,120 min时4-氯硝基苯的脱氯效率不高. 当反应起始pH值为5时,此时体系仍旧有H+会促进硼氢化钠水解,产生的氢气能有效地被Pd催化剂裂解转化为活性氢. 当反应体系起始pH值为7时,硼氢化钠水解产氢的反应速率会降低,水解反应过程如方程(2)所示[15]. 当反应体系起始pH为9时,体系为碱性环境,此时硼氢化钠水解产氢的反应受到部分抑制而发生耦合反应.此外,硼氢化钠反应还会产生的偏硼酸盐或硼酸盐致使反应体系的pH值升高,导致脱氯效率下降. 实验测得反应体系不同起
始pH条件下,120 min催化还原反应后体系的最终pH值,分别为8.56、9.82、9.99、10.11.
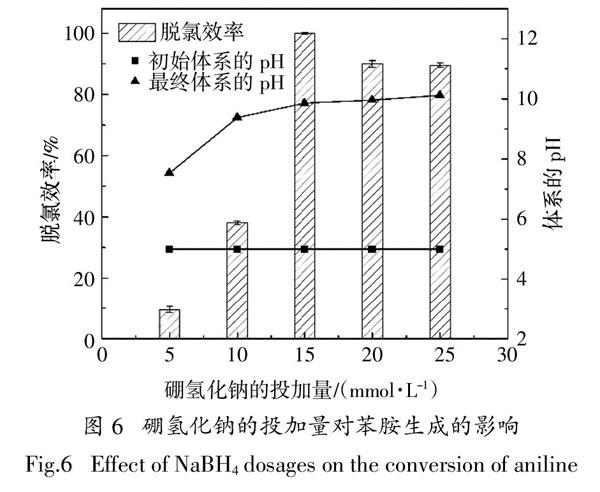
2.2.5 体系中硼氢化钠的投加量对还原实验的影响
在本实验研究中,NaBH4主要是作为供氢体,利用硼氢化钠与水反应分解产生氢气,氢气在贵金属Pd表面吸附并被裂解为活性氢,活性氢再参与4-氯硝基苯的催化加氢反应.在之前Pd最佳的投加量和CTAB最佳负载量优化确定的基础上,对反应体系中供氢体的投加量即硼氢化钠的投加量进行优化研究.研究选取硼氢化钠的投加量分别为5、10、15、20和25 mmol/L,图6显示了不同硼氢化钠的投加量对CTAB-PdNPs催化还原4-氯硝基苯的影响.该实验的反应条件为:25 ℃,1 000 r/min,0.5 mmol/L p-CNB,1.0 mmol/L CTAB,0.125 mmol/L Pd,pH为5.
从图6中的实验数据得到,当硼氢化钠的投加量分别为5、10、15、20和25 mmol/L时,CTAB-PdNPs对4-氯硝基苯催化还原的脱氯效率分别为9.5%、38.0%、100.0%、89.9%和89.5%,即意味着4-氯硝基苯催化还原的脱氯效率随着硼氢化钠的投加量的增加呈现先增大再减小的趋势.分析导致上述结果的主要原因,一方面是供氢量是否足够,另一方面是反应体系的pH值. 理论上,催化还原一份4-氯硝基苯为苯胺需要一份硼氢化钠. 但是,氢气在水中的溶解度非常小,能有效利用的氢源相对也少.当硼氢化钠水解时不仅产生氢气,還会生成偏硼酸盐,偏硼酸盐的生成会导致反应体系的pH值在反应几分钟后迅速升高.硼氢化钠的投加量分别为5 、10 、15、20和25 mmol/L时,对应的反应完成后体系的最终pH值分别为7.53、9.38、9.86、9.96和10.12.对比之前的研究分析,硼氢化钠的投加量为5 mmol/L和10 mmol/L时的体系pH值并不是4-氯硝基苯的最佳反应环境,且产生的氢气不足以将全部4-氯硝基苯全部脱氯,因此该条件下4-氯硝基苯的脱氯效率不高,特别是硼氢化钠的投加量为5 mmol/L时. 当硼氢化钠的投加量分别为15、20和25 mmol/L时,产生的氢气足以将4-氯硝基苯全部脱氯. 但是,当硼氢化钠投加量为15 mmol/L时,所对应的反应体系的pH为发生脱氯反应的最适宜环境.综上实验现象及相关分析,硼氢化钠最佳投加量为15 mmol/L,此时4-氯硝基苯催化还原为苯胺的脱氯率及反应速率最佳.
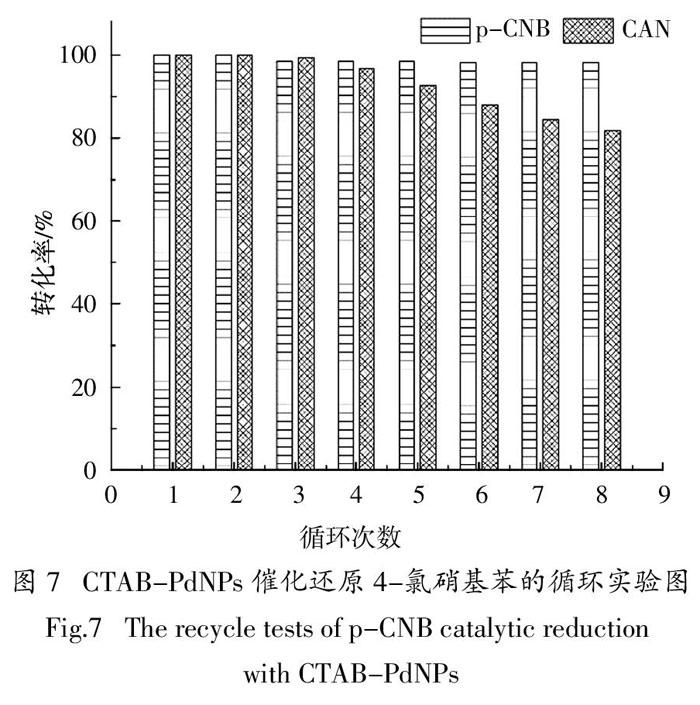
2.3 对氯硝基苯催化还原的循环实验
图7是CTAB-PdNPs聚集体对4-氯硝基苯催化加氢循环实验图. 该循环实验的反应条件为:
25 ℃,转速1 000 r/min,pH为5,CTAB为1 mmol/L,PdNPs为0.125 mmol/L,循环反应时间为90 min.
从图7中可以明显看出,随着循环次数的增加,CTAB-PdNPs对p-CNB催化加氢的脱氯效率逐渐降低,催化剂CTAB-PdNPs的水力半径逐渐增大.8次循环后对应的4-氯硝基苯的去除效率分别为100.0%、100.0%、98.6%、98.6%、98.6%、98.3%、98.2%和89.2%,并转化为4-氯苯胺.但是,4-氯苯胺的脱氯效果在循环第3次开始有一定下降,CTAB-PdNPs循环实验中对4-氯苯胺的去除率分别为100.0%、100.0%、99.5%、96.8%、92.7%、87.9%、84.5%和81.9%,最终的反应产物为苯胺. 即使循环8次后,4-氯苯胺的脱氯效率仍可达到81.9%,可见CTAB-PdNPs的催化性能很稳定.
3 结 论
本研究利用CTAB自组装诱导,以H2PdCl4为前驱体,采用NaBH4还原方法成功制备了具有立方体结构的PdNPs聚集体,并考察了其对4-氯硝基苯的催化加氢性能,分别考察了体系Pd的投加量、CTAB的负载量、反应起始pH值以及硼氢化钠的投加量对脱氯效果的影响.
其中,反应体系中Pd的投加量考察的6个浓度,4-氯硝基苯的脱氯效率和反应速率均随着Pd投加量的增大而增大;随着CTAB的浓度的增大呈现先增加再减小的规律;随着pH的升高而先增加再降低;随着硼氢化钠投加量的增加而呈现先增加后减小的现象.综上研究,最佳的反应条件为Pd的投加量为0.125 mmol/L,CTAB的投加量为1.00 mmol/L,反应起始pH值为5,硼氢化钠的投加量为15 mmol/L.在最佳条件下,CTAB-PdNPs可在90 min内对4-氯硝基苯实现全部脱氯,显示了其极强的催化脱氯活性. 在该条件下即便进行8次循环实验,4-氯硝基苯的脱氯效率仍达到了81.9%.
这表明了本研究中这种简易的合成方法成功地合成了具有一定特定规则形状的CTAB-PdNPs自组装聚合物,该聚集体具有很高的催化活性和稳定性,为去除环境中污染物4-氯硝基苯提供了一种简易、反应条件温和的技术.
参考文献
[1] HUANG B B,LEI C,WEI C H,et al. Chlorinated volatile organic compounds (Cl-VOCs) in environment-sources,potential human health impacts,and current remediation technologies[J]. Environment International,2014,71:118—138.
[2] PANKAJ K A,CH S,CH V R. Degradation of chlorinated nitroaromatic compounds[J]. Applied Microbiology and Biotechnology,2012,93(6):2265—2277.
[3] LI Q,MASAYASU M,TOMOYKI H,et al. Acute immunotoxicity of p-chloronitrobenzene in mice Ⅱ. effect of p-chloronitrobenzene on the immunophenotype of murine splenocytes determined by flow cytometry[J]. Toxicology,1999,137:35—45.
[4] 吴少伟. 石墨烯负载铱、金催化对氯硝基苯選择性加氢的研究[D]. 大连:大连理工大学化工学院,2015:2—8.
WU S W. Selective catalytic hydrogenation of p-CNB over grapghene supported iridium and Au catalyst[D]. Dalian:College of Chemical Engineering,Dalian University of Technology,2015:2—8. (In Chinese)
[5] HUANG B B,WANG T,LEI C,et al. Highly efficient and selective catalytic hydrogenation of acetylene in N,N-dimethylformamide at room temperature[J]. Journal of Catalysis,2016,339:14—20.
[6] HUANG B B,QI C Y,YANG Z,et al. Pd/Fe3O4 nanocatalysts for highly effective and simultaneous removal of humic acids and Cr(VI) by electro-Fenton with H2O2 in-situ electro-generated on the catalyst surface[J]. Journal of Catalysis,2017,352:337—350.
[7] 黎方正,周秋兰,欧恩才,等.溶胶凝胶法制备Pd/rGO纳米复合材料[J].湖南大学学报(自然科学版),2017,44(12):103—107.
LI F Z,ZHOU Q L,OU E C,et al. Preparation of Pd/rGO nano composite by sol-gel method[J]. Journal of Hunan University(Natural Sciences),2017,44(12):103—107. (In Chinese)
[8] HU J Y,YANG Q W,YANG L F,et al. Confining noble metal (Pd,Au,Pt) nanoparticles in surfactant ionic liquids:active non-mercury catalysts for hydrochlorination of acetylene[J]. ACS Catalysis,2015,5(11):6724—6731.
[9] HU C Y,LIN K Q,WANG X L,et al. Electrostatic self-assembling formation of Pd superlattice nanowires from surfactant-free ultrathin Pd nanosheets[J]. Journal of the American Chemical Society,2014,136(37):12856—12859.
[10] PEDRO S,AVELINO C. Transforming nano metal nonselective particulates into chemoselective catalysts for hydrogenation of substituted nitrobenzenes[J]. ACS Catalysis,2015,5(12):7114—7121.
[11] ZHANG P,ZHAO Z B,BORIS D,et al. In situ synthesis of cotton-derived Ni/C catalysts with controllable structures and enhanced catalytic performance[J]. Green Chemistry,2016,18(12):3594—3599.
[12] ZHU B W,LIM T T. Catalytic reduction of chlorobenzenes with Pd-Fe nanoparticles reactive sites,catalyst stability,particle
aging,and regeneration[J]. Environmental Science Technology,2007,41:7523—7529.
[13] DU Y P,ZHANG Y W,SUN L D,et al. Atomically efficient synthesis of self-assembled monodisperse and ultrathin lanthanide oxychloride nanoplates[J]. Journal of the American Chemical Society,2009,131(9):3162—3163.
[14] WU Z J,MAO X K,ZI Q,et al. Mechanism and kinetics of sodium borohydride hydrolysis over crystalline nickel and nickel boride and amorphous nickel-boron nanoparticles[J]. Journal of Power Sources,2014,268:596—603.
[15] GUELLA G,ZANCHETTA C,PATTON B,et al. New insights on the mechanism of palladium-catalyzed hydrolysis of sodium borohydride from 11B NMR measurements[J]. Journal of Physical Chemistry B,2006,110(34):17024—17033.

