利塞膦酸钠和阿仑膦酸钠治疗对股骨粗隆下侧皮质骨密度变化的影响对比研究
钟亚春 陆璇 徐立
武汉市第一医院,湖北武汉430022
双膦酸盐(bisphosphonates,BPs)是目前最常用于治疗骨质疏松症并降低骨质疏松相关骨折风险的药物。自从这类药物开发和临床应用以来,腰椎和髋部(全髋或颈部)的骨密度(bone mineral density,BMD)增加一直是评估其有效性以及降低脆性骨折风险的主要焦点[1]。尽管BPs药物在预防骨质疏松性骨折中起到显著的作用,但是最近研究报道了它们在长期给药后与非典型股骨骨折(atypical femoral fracture,AFF)的强烈关联[2]。长期摄入 BPs后过度抑制骨重建被认为是导致骨质恶化并导致骨折前病变。股骨外侧皮质受到影响,而不是内侧股骨皮质,表现为骨膜组织的损伤和影像学检测出现黑线[3-4]。在局部应力作用中,股骨粗隆下区的外侧股骨皮质处于相当大的拉伸应力下,而该区域的内侧皮质处于压缩应力下。皮层骨在拉伸应力下比在压应力下更弱,这意味着外侧皮质更容易受到结构损伤和修复[5]。另一方面,阿仑膦酸盐和利塞膦酸盐的药代动力学的差异会导致骨矿物质沉积的差异[6]。此外,最近的文章报道了不同的BPs导致不同的AFF风险[7-8]。在这种情况下,笔者推测特定于每种BPs剂的药代动力学差异可能对转子下侧皮质(subtrochanteric lateral cortex,STLC)引起不同的皮质反应。这可能是BPs治疗患者之间AFF风险差异的合理解释之一。因此,本研究通过使用连续双能X射线吸收测定(dual energy X-ray absorptiometry,DXA)追踪检查BMD的变化,回顾性地评估两种BPs药物对STLC的反应是否不同。
1 材料和方法
1.1 临床资料
本研究纳入从2014年1月至2016年7月在武汉市第一医院门诊进行BPs抗骨质疏松症治疗并定期使用骨密度仪进行骨密度评估的患者。纳入标准:这些受试者在服用BPs(阿仑膦酸盐或利塞膦酸盐)作为初次使用者或仅仅进行健康检查后的两年或更长时间内进行了连续DXA检查。排除标准:在第1次DXA检查时已经服用血压药的受试者被排除在外。仅接受一次DXA检查或在使用BPs后间隔少于2年的连续DXA检查的受试者也被排除在外。另外,排除了可能影响BMD内分泌疾病,服用类固醇类激素或肝肾功能异常出现的内分泌异常的受试者。最后,包括了第1次和随访DXA检查间隔2~4年的168例受试者。其中46例未服用任何抗骨质疏松药物(对照组),69例使用阿仑膦酸钠(阿仑膦酸钠组),53例使用利塞膦酸盐(利塞膦酸盐组)。根据病历记录每组的基线特征,包括平均年龄、DXA检查之间的时间间隔和体质量指数(body mass index,BMI)。药物组中患者的药物治疗持续时间被视为DXA检查之间的时间间隔,因为所包括的患者是初始患者并且在第1次DXA检查时开始服药。
在不改变DXA扫描仪的软件或硬件的情况下,技术人员使用相同的Lunar Prodigy扫描仪(GE Lunar,Medison,WI,USA) 对每个患者中进行连续DXA检查。在研究间隔期间没有发生可能导致基本扫描技能发生任何变化的事件。腰椎(L1-L4)后外侧(PA)和单侧髋关节(所有患者均为右侧髋关节)进行DXA检查。根据供应商推荐的扫描方法和患者定位协议进行DXA检查。整个扫描数据源备份在单独存储设备上。在本研究中,源扫描数据用于测量BMD。在阿仑膦酸盐和利塞膦酸盐组中测量腰椎(L1-L4)和右髋部在药物治疗前后的骨密度;随后通过放置供应商提供的感兴趣区域(region of interest,ROI),在全髋、颈、转子和 Ward区域测量髋部BMD。使用GE-Lunar Encore软件(版本13.6)对检测部位的BMD进行测量。腰椎和股骨颈的精度分别为1.6%和1.9%。所有测量的BMD数据记录为g/cm2。上述技术人员进一步测量转子下皮质骨的BMD。对于每位患者位于小转子远端水平,在STLC和转子下内侧皮质(subtrochanteric medial cortex,STMC)测量BMD。皮质上绘制了矩形 ROI。ROI的近端到远端长度统一为1 cm(图1)。所有测量的 BMD数据记录为 g/cm2。髋轴长度(hipaxislength,HAL)反映了髋关节力臂,笔者推测该值将反映股骨转子下皮质的负荷和最大应力并且可能影响STLC的BMD变化[9]。沿着延伸的股骨颈轴测量HAL,直到每个方向上的骨边缘(图1),将平均值记录为cm。

图1 股骨粗隆皮质的骨密度测量和髋轴长度的测量Fig.1 Bone mineral density measurement and hip axis length measurement of femoral trochanter cortex
为了测试第1次和第2次DXA检查之间BMD变化的差异,需要标准化BMD变化,因为当基线BMD不同时,相同数量的BMD变化不能被认为是相同的。因此,笔者以变化百分比表示。计算STLC、STMC、腰椎和全髋的百分比变化,并在下面考虑两个方面进行统计评估:比较药物组和对照组之间髋部和腰椎BMD的百分比变化以及根据所使用药物来测试外侧皮质百分比变化的差异。
1.2 统计学分析
所有计量数据均以均数±标准差表示,其中连续变量的范围以及分类变量使用计数和百分比表示。使用组内相关系数(intraclass correlation coefficient,ICC)评估转子下皮质的BMD测量的结果一致性。为了评估对照组,阿仑膦酸盐组合利塞膦酸盐组中髋、腰椎或STLC中BMD的百分比变化是否存在差异,采用协方差分析(ANCOVA)模型来控制5个独立变量。变量是STMC的年龄、BMI、BMD百分比变化、HAL以及DXA检查之间的时间间隔。同时,本研究评估了除药物(无阿仑膦酸盐或利塞膦酸盐)之外的任何变量是否都会影响BMD的变化百分比。HAL被包括作为要评估的变量之一,以控制可能影响BMD变化的STLC的几何形状,如上所述[9]。使用ANCOVA模型获得每组的髋部BMD、脊柱BMD和STLC BMD的百分比变化的最小二乘平均值,并且进行多重比较以评估组间差异;随后使用Bonferroni校正的t检验进行事后成对比较。使用SPSS 19.0软件进行所有统计学分析。P<0.05表示差异有统计学意义。
2 结果
表1总结了受试者的年龄、第1次和第2次DXA检查之间的间隔、BMI和HAL。其中在转子下区域的皮质BMD测量两次,在第1次和第2次测量的内侧皮质的平均BMD值分别是(2.13±0.25)g/cm2(范围:1.59~2.80)和(2.14±0.27)g/cm2(范围:1.55~2.78)。外侧皮质的平均BMD值分别为(1.83±0.33)g/cm2(范围:1.22~2.55)和(1.80±0.34)g/cm2(范围:1.25~2.52)。从转子下区域的皮质BMD的两个单独测量获得的总ICC值是0.89,其在近似完全一致的范围内。

表1 三组患者的有关特征比较Table 1 Comparison of relevant characteristics among the three groups
在ANCOVA分析中,腰椎BMD的百分比变化受药物(P<0.001)和DXA检查之间的时间间隔(P<0.05)影响。在该分析中,DXA间隔的每月腰椎BMD的百分比变化为 0.12±0.07。此外,在ANCOVA分析中,髋部BMD百分比变化也受药物影响(P<0.001)和DXA检查之间的时间间隔(P<0.05)影响。每个月DXA间隔的髋部BMD百分比变化增加0.07±0.02。在控制因变量后评估药物组中腰椎的BMD百分比变化差异时,对照组、阿仑膦酸盐和利塞膦酸盐组中腰椎BMD百分比变化分别为-0.17±1.13、6.14±1.05 和 4.95±0.93。在多重比较分析中,利塞膦酸盐(调整后的P=0.001)和阿仑膦酸盐(调整后的P<0.001)组显著高于对照组的百分比变化(图2A)。在控制因变量后,利塞膦酸盐和阿仑膦酸盐组中髋部BMD百分比变化差异的评估中,对照组、阿仑膦酸盐和利塞膦酸盐组的髋部BMD百分比变化分别为-1.82±0.78、1.15±0.67和1.88±0.59。在多重比较分析中,利塞膦酸盐(调整后的 P<0.001)和阿仑膦酸盐(调整后的 P<0.05)组显著高于对照组的百分比变化(图2B)。
在 ANCOVA中,STLC的 BMD(P=0.004)和STMC的BMD(P=0.002)的百分比变化均受药物影响。在该分析中,STLC BMD的百分比变化随STMC BMD每增加1%而增加0.22±0.08。对照组、阿仑膦酸盐和利塞膦酸盐组BMD百分比变化分别为 1.47±1.51、2.24±1.27 和 6.98±1.23。利塞膦酸盐组的BMD百分比变化显著高于对照组(调整后的P=0.010)或阿仑膦酸盐组(调整后的 P=0.011)(图 3)。
3 讨论
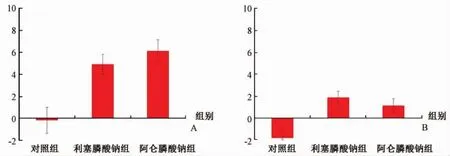
图2 组间比较脊柱(A)和髋部(B)骨密度的百分比变化Fig.2 Percentage changes of bone mineral density at spine(A)and hip(B)between groups
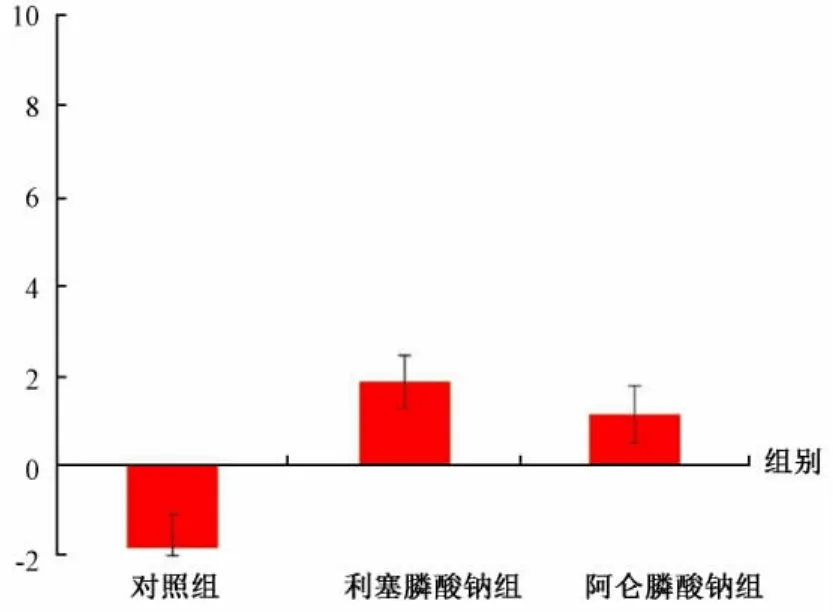
图3 转子下侧皮质的骨密度评估Fig.3 Bone mineral density assessment of the subtrochanteric lateral cortex(STLC)
本研究中两种药物阿仑膦酸盐和利塞膦酸盐均可以显著增加腰椎和髋部的BMD,在控制年龄、BMI、STMC百分比变化、HAL和DXA检查之间的时间间隔等因变量后,观察到利塞膦酸盐组的STLC BMD的增加显著高于阿仑膦酸盐组。有研究表明,阿仑膦酸盐对腰椎和髋部的BMD改善效果较利塞膦酸盐更加显著[10]。然而,虽然没有关于阿仑膦酸盐对利塞膦酸盐在骨小梁和骨密度增加方面优势的争论,但仍然存在关于皮质骨的这种优势的争论[11]。另外,在患者下肢具有正常机械轴的基础上,股骨干STLC上的张力应变在转子下区域中最高。预计STLC中拉伸应力下的皮质骨受到高代谢和重塑需求的影响;尽管一些研究者提出异议,但STLC的增厚曾被认为是长期BPs患者AFF发展的重要因素[12-13]。笔者认为阿仑膦酸盐与利塞膦酸盐的药代动力学差异如上所述,STLC对代谢和重塑需求的影响可能会对BMD的增加产生不同的影响,这种差异支持本研究结果[14]。
先前文章报道,矿物质结合亲和力显著影响椎体和肋骨的骨小梁中新形成的皮质骨周围的BPs分布[15]。对羟基磷灰石具有较低结合亲和力的BPs,例如利塞膦酸盐,具有更大的能力到达骨骼深处的这些区域,其中最脆弱的骨细胞存在其中;即使不影响骨细胞,这些药物在整个皮质中的更广泛分布也可以使重塑更均匀地降低[15]。根据本研究结果和上述关于这两种BPs药物动力学的文章,笔者认为这种广泛的矿物质STLC中的分布和法呢基焦磷酸合成酶的强抑制导致利塞膦酸盐组中STLC的BMD增加大于阿仑膦酸盐组。笔者认为,利塞膦酸盐和阿仑膦酸盐在本研究中BMD增加的差异可能对这些BPs药物之间AFF风险的差异有一个合理的解释。
长期使用BPs被认为可能与AFF和颌骨坏死有关[16]。大多数报道的AFF病例是阿仑膦酸盐使用者,这可能与阿仑膦酸盐被引入的时间有关。1995年在市场上使用阿仑膦酸盐与2005年引入的利塞膦酸盐相比使用的时间更长。2007年,新加坡报告了第一个与BPs相关的AFF综合病例系列。该病例系列报道,在13例持续AFF的患者中,9例患者服用阿仑膦酸盐数年[17]。至于比较不同BPs用户群之间AFF风险的大型调查,研究者小组分析了美国食品药品管理局不良事件报告系统和BPs和AFF国际安全工作的数据。研究表明,阿仑膦酸盐使用者的比例报告率和比值比大约是利塞膦酸盐使用者的两倍[8]。另一方面,Schilcher等[2]分析了59例AFF患者,发现阿仑膦酸钠和利塞膦酸盐使用者的AFF风险没有差异。然而,他们最近报道,阿仑膦酸盐使用者的多变量调整奇数比率几乎是利塞膦酸盐使用者的3倍[18]。虽然需要进一步研究以确定BMD增加的差异是否是解释为什么阿仑膦酸盐组显示出比利塞膦酸盐组更大的AFF风险的唯一参数,本研究结果证明STLC的BMD值治疗后差异作为原因之一。
STLC作为通过使用各种成像模式监测AFF发生的位置而引起关注。XLC射线照片的局部骨膜或骨内增厚在此之前被定义为2010年美国骨与矿物研究协会特别工作组发布的上一份报告的一个次要特征[19]。然而,最近STLC的变化已经升级为第2次报告中的一个主要特征,在AFF的5个主要特征中,有3个与外侧皮质有关,已经仔细检查了STLC的细微变化是否可以用作AFF发生的预测因子[20]。
本研究结果表明,不仅基于图像的形态学变化,而且STLC的BMD测量是可行的,并且可以用作与AFF发生相关的调查的监测工具。没有开发供应商提供的软件来自动检查STLC和STMC的BMD,因此担心在顺序捕获的DXA中重复测量BMD的错误。尽管如此,测量皮质骨密度的整体ICC值仍接近完全一致。本研究有几个局限性。首先,登记患者的数量和随访年数不够大,由于研究的回顾性,这是不可避免的。其次,直接评估受试者的股骨的机械强度和压力是不可能的,这预期会影响STLC上BMD的变化。第三,STLC和STMC的BMD测量不是公认的方法,但是,笔者认为这个问题已经通过本研究中的测量重复性测试得到了解决。总之,本研究观察到利塞膦酸盐使用者组中STLC的BMD百分比变化与阿仑膦酸盐使用者和对照组相比更为显著。

