幕上高血压脑出血不同手术方式的疗效对比分析
黄金钟, 邱伟智, 王佳音, 骆良钦, 李亚松, 高宏志
自发性脑内出血是临床工作中的常见病,占所有卒中患者的15%~20%。随着人口老龄化的加剧,以及更多抗凝、抗血小板药物用于预防缺血性疾病,自发性脑出血的发病率不断上升,其发病后1月的死亡率最高可达40%,而10%~15%的幸存者则表现为生活无法自理[1-2]。Gregson等指出,脑出血后,除脑出血本身的占位形成高颅压危及患者生命外,继发的细胞毒性及脑水肿较出血本身所致的损害更重,从而提出早期清除脑内血肿、改善功能预后的思想,并指出手术治疗的必要性[3]。脑出血的外科手术治疗方式主要有3种:常规骨瓣开颅血肿清除术、神经内镜手术以及导管穿刺血肿引流。目前,3种手术方法的疗效仍存有争议。本研究通过回顾性分析和比较这3种手术的治疗效果,旨在为临床合理选择治疗自发性高血压脑出血的手术方式提供理论依据。
1 对象和方法
1.1 对象 收集2015年1月1日—2018年5月1日经手术治疗的幕上高血压脑出血患者90例,男性57例,女性33例,年龄(64.25±7.82)岁(44~78岁)。入组标准:(1)高血压脑出血,年龄为18~75岁;(2)格拉斯哥评分(Glasgow coma scale,GCS)为5~14分;(3)幕上血肿量>30 mL;(4)发病到手术的时间<24 h。排除标准:(1)多处颅内出血、脑干出血;(2)脑肿瘤、动脉瘤、动静脉畸形或其他血管病变导致的继发出血;(3)脑疝患者;(4)凝血障碍或有口服抗凝药物病史;(5)既往有脑卒中病史或患有严重痴呆、残疾的患者;(6)资料不完整或随访丢失。
根据手术方式,将90例患者分为3组:常规骨瓣开颅手术组(开颅组)、血肿穿刺引流组(穿刺组)和神经内镜手术组(内镜组),每组30例。除开颅组1例颞顶叶血肿,内镜组1例颞叶血肿,穿刺组1例顶叶血肿,余均为基底节区血肿。3组患者的性别、年龄、收缩压、入院时GCS评分、出血量、高血压病和糖尿病病史等术前临床资料比较,差别均无统计学意义(表1)。
表13组患者基本资料比较
Tab 1Comparison of general information of the three groups

分 组年龄/岁n男/女入院时GCSV血肿量/mL开颅组64.83±8.3619/119.67±2.6757.77±6.47穿刺组64.00±7.5421/99.67±2.6357.40±6.98内镜组63.93±7.7617/139.57±2.4758.07±7.06
n=30. GCS:格拉斯哥评分.
1.2方法
1.2.1手术方法 内镜组手术均为同一术者操作完成,穿刺组及开颅组手术为具有相似手术经验的术者完成,手术方法基本一致。具体方法如下:(1)开颅组:全身麻醉下,常规骨瓣开颅(骨瓣大小9 cm×10 cm)。硬膜打开后,以皮层造瘘的方式进入血肿腔,并在显微镜下行血肿清除手术,仔细处理活动性出血。血肿清除后,适当升高血压,以确认止血效果,严密缝合硬脑膜。根据患者的术前情况和术中脑组织塌陷情况决定是否保留骨瓣。(2)穿刺组:患者行CT检查后,穿刺部位选择血肿直径最大的层面,并远离重要的皮质功能区域。术中通过CT引导确认导管进入血肿腔,用注射器轻轻地抽出部分液化血肿(首次抽吸量不超过原血肿的50%)。术后留置引流管2~4 d,每日通过导管注射尿激酶1~2次,促进血肿溶解引流,待血肿清除量>80%后拔除引流管。术后24~48 h再次行CT扫描。(3)内镜组:全身麻醉下,取皮层距血肿中心的最短距离处头皮,采用长4.0~5.0 cm的纵形切口,铣刀铣下直径约2.5 cm的骨瓣。十字切开硬膜后电灼脑表面,使用透明穿刺导引器穿刺脑血肿,置入透明塑料套筒,内镜手术通道建立完成。使用吸引器和双极电凝配合,在内镜直视下清除脑内血肿。术中对于与脑组织粘连比较紧密的血凝块可予保留,此处常为出血点。血肿腔覆盖止血纱布,根据情况决定术区是否留置引流管,退出透明套筒,常规关颅。术后镇静镇痛6 h后,复查颅脑CT。
1.2.2术后治疗和评估 术后患者均进入重症监护室治疗,收缩压严格控制在160 mmHg以下(1 mmHg=133.3 Pa),术后1,3,7 d及出院时均复查头颅CT。拷贝CT扫描所得的DICOM数据,导入安装有3D-Slicer软件的电脑中,建立血肿、脑水肿范围的三维模型,计算血肿量及脑水肿体积[4]。
术后24 h血肿清除率=(术前血肿量-术后血肿量)/术前血肿量×100%
1.2.3结果评价指标 收集患者的相关指标:手术时间;术中失血量;术后第1,3,7天的GCS评分;术后第1天的血肿清除率;术后第7天复查头部CT描述术区水肿情况;住院时间;并发症(包括再出血、肺炎和颅内感染);术后1月的死亡率;术后6月改良Rankin量表(modified Rankin scale, mRS)评估残疾程度。

2 结 果
2.1 手术结果比较 患者均随访6月以上。开颅组存活22例,死亡8例(死因:术后再出血后脑水肿2例,颅内感染2例,重症肺炎4例),去骨瓣减压12例。穿刺组存活24例,死亡6例(死因:术后再出血后脑水肿4例,重症肺炎2例)。内镜组存活26例,死亡4例(死因:术后再出血后脑水肿1例,重症肺炎3例)。术后第7天的脑水肿体积:开颅组、穿刺组及内镜组分别为(74.07±4.43),(43.53±4.37)及(56.97±3.87)mL,3组间两两比较差别均有统计学意义(P<0.05,表2)。
2.2GCS评分比较 术后第7天,开颅组、穿刺组及内镜组的GCS评分分别为(11.73±2.48),(13.07±1.8)及(12.90±1.45),3组间两两比较差别均有统计学意义(P<0.05)。而术后第1天及第3天的GCS评分比较,3组间两两比较差别则无统计学意义(P>0.05,表2)。
2.3术后并发症比较 开颅组:颅内感染2例,肺炎10例;穿刺组:颅内感染7例,肺炎3例;内镜组:颅内感染1例,肺炎3例。内镜组的颅内感染发生率低于其余两组(P<0.05),其肺炎发生率也低于开颅组(P<0.05,表2)。
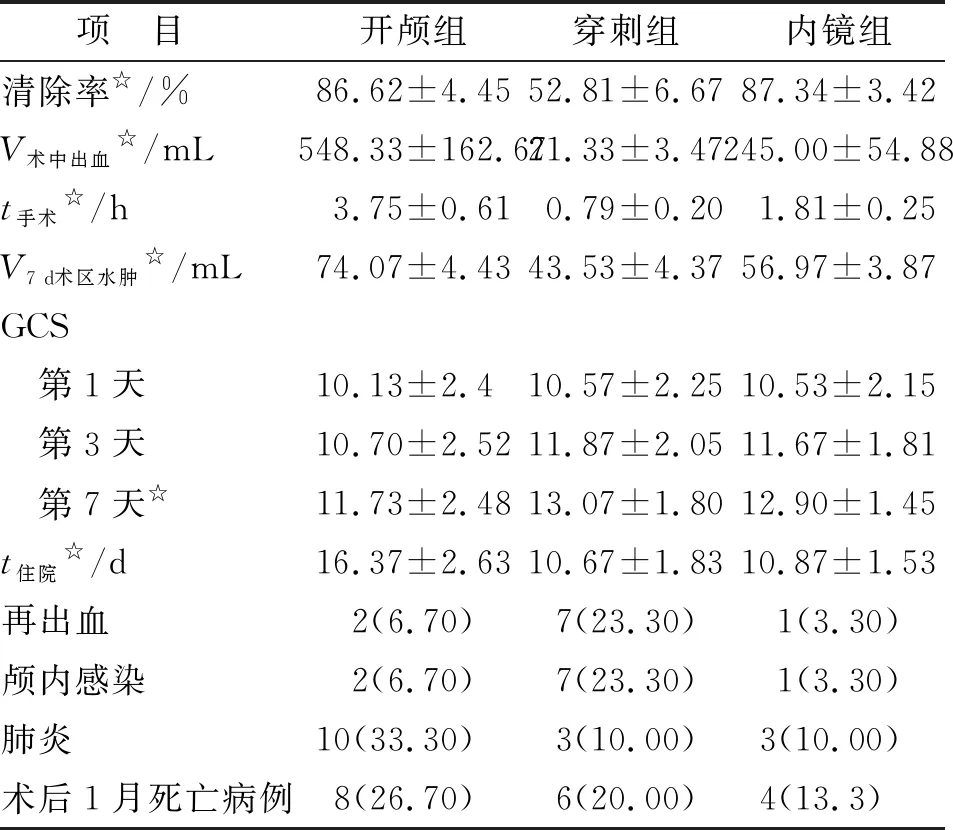
表2 3组患者术后情况比较
n=30. 表中再出血、颅内感染、肺炎及术后1月死亡病例的数据为n(%). 组间两两比较,☆:P<0.05.
2.4随访结果 开颅组、穿刺组及内镜组的术后6月mRS评分分别为(3.27±1.12),(2.25±0.79)及(2.61±1.30),3组间比较差别均有统计学意义(P<0.05)。3组中,入院时血肿量>60 mL的患者,6月mRS评分分别为(4.25±0.95),(3.25±0.50)及(2.67±0.71),3组间比较差别有统计学意义(P<0.05);而入院时GCS评分为5~8分的患者,6月mRS评分分别为(4.50±0.54),(3.00±0.53)及(2.8±0.78),3组间比较差别有统计学意义(P<0.05,表3)。
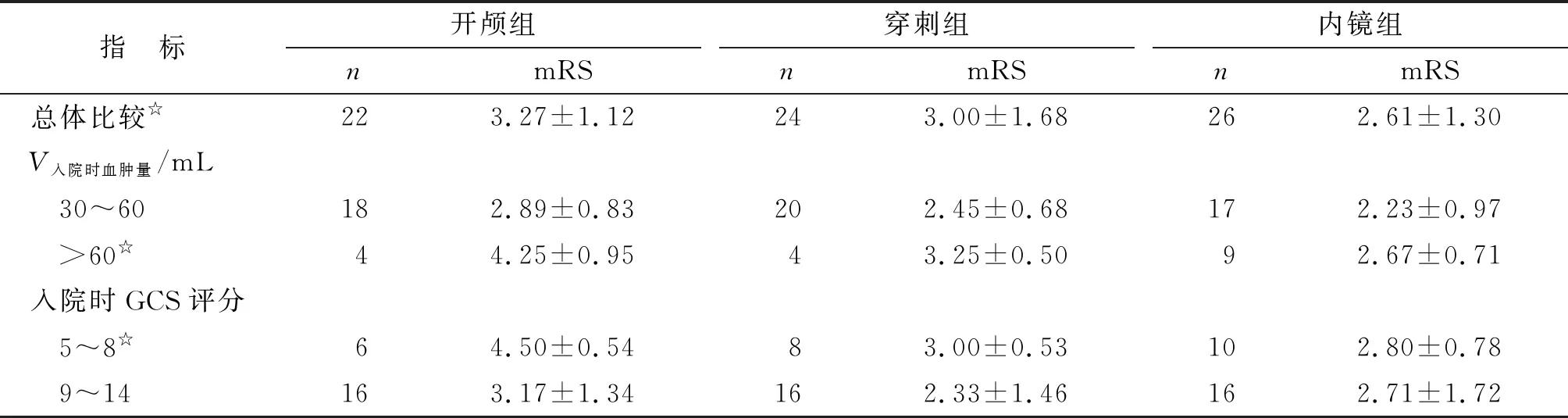
表3 3组患者细分组后的6月mRS评价比较
表中数据为mRS分值. 组间两两比较,☆:P<0.05.
3 讨 论
高血压脑出血以高致残率、高致死率为主要特点,其病理生理学改变主要有两个阶段:第一个阶段是急性出血及早期血肿扩大过程中对神经细胞的直接损伤;第二个阶段是血肿液化分解过程中释放多种损伤神经细胞的活性物质,进一步引起脑水肿等。出血后血肿占位效应,导致颅内压急剧升高,脑疝是导致出血患者发病后12 h内死亡的主要原因[5]。而血肿周围脑水肿也与患者的预后关系密切,可增加患者术后90 d内的死亡率[6]。因此,早期行开颅血肿清除术可尽早清除血肿,减少血肿液化分解产生的细胞毒性活性物质,降低颅内压,改善局部脑组织血液循环,缓解脑水肿,从而明显降低死亡率并改善患者的预后[7-8]。
常规骨瓣开颅手术对血肿的清除效果确切,可同时行去骨瓣减压术,相较于其他两种手术方式,是降低颅内压的最有效方法,尤其是对于血肿量大、病情进展迅速或早期即发生脑疝的患者,其缺点是手术创伤大。另外,因目前对术中骨瓣的去留仍无明确的标准,在常规骨瓣开颅的手术过程中,术者常因追求最大程度的减压效果,而导致去骨瓣减压术的过度使用。本研究显示,常规骨瓣开颅组患者中,有近40%的患者行去骨瓣减压术。而神经内镜治疗手术,其手术切口仅需4~5 cm、骨瓣直径约2.5 cm,手术创伤大幅减少,术中出血量也较少。
常规骨瓣开颅术中,虽也应用显微镜,可在一定程度上减少对脑组织的牵拉,但因显微镜存在一定盲区,术中对脑组织的牵拉程度仍较神经内镜手术明显。内镜下手术最大的优点是可深入血肿腔内,在直视下止血,避免显微镜的死角问题;其工作鞘通道式操作,也可减少对脑组织的反复牵拉,术后脑水肿反应轻微。文献报道,经额叶皮层穿刺进行基底节血肿清除,可避免损伤皮质脊髓束及左侧颞叶语言区[9]。术后头部CT显示的术区脑水肿的影像学表现,可间接提示医源性损伤的程度[10]。本研究中,术者选择经血肿距离皮层最近处建立内镜通道,与常规骨瓣开颅手术组比较,术后7 d,内镜组患者的血肿周围脑水肿体积较小,提示其对血肿周围组织的损伤较低。另有文献报道,开颅手术的并发症发生率为41.2%、死亡率为27.2%[11],尤其对于>80岁的患者,开颅手术会加剧其基础病,造成病情恶化,往往由于严重的组织损伤而未能改善患者的临床预后[12-13]。本研究也显示,常规骨瓣开颅组的6月mRS得分也较其他两组差,也证实了以上观点。
与常规骨瓣开颅手术比较,血肿穿刺组和神经内镜组的手术和住院时间均更短,术后意识状态恢复也较快,神经功能预后良好[14]。本研究显示,常规骨瓣开颅的手术时间为(3.75±0.61)h,明显长于其他两组,且在术后第7天的GCS评分改善方面,其他两组也表现出一定的优势。
血肿穿刺引流术的手术时间最短,且对脑组织的损伤最小。然而,盲穿下无法直接对出血点进行止血处理,术后再出血率高。本研究显示,其术后再出血率达23.3%,明显高于内镜组(3.3%)。而再出血对脑组织的再次损伤,同样可导致不良预后。另外,为减少再出血的风险,血肿穿刺术术中一般仅可清除部分血肿,短时内的减压效果有限,术后仍需向血肿腔内反复注入尿激酶以促进血肿液化引流,增加了颅内感染的机会[15]。本研究中,穿刺组第1天的血肿清除率仅为(52.81±6.67)%,明显低于内镜组的(87.34±3.42)%,而其颅内感染率却高达23.3%。并发症的增加,不但延长了住院时间,增加了住院费用,也严重影响患者的预后。
值得注意的是,依入院时的GCS及血肿量细分组后发现,病情较严重(血肿量>60 mL或GCS为5~8)的患者,从穿刺引流术和常规骨瓣开颅手术中获得的益处明显少于内镜手术。说明神经内镜治疗在改善脑出血患者长期功能恢复方面可能有优势,特别是在病情严重的情况下[16]。
综上所述,相较于其他两种术式,神经内镜手术治疗可更安全、更有效地清除血肿,再出血率较低,神经功能改善更大,特别是对于血肿量>60 mL或GCS为5~8的患者。然而,神经内镜手术也有局限性,如学习曲线较长、对术者技术要求高、设备昂贵、基层医院不易开展等。本研究也存在几个局限性,首先作为一个回顾性研究,可能存在一定程度的偏倚;此外,分组时未能保证患者被随机分配,术者常倾向于选择开颅减压手术作为治疗严重患者的首选。今后将联合多中心,收集更多的病例,设计良好的前瞻性研究,以进一步研究这3种手术的安全性及神经功能预后情况。

