微管相关蛋白tau转基因细胞和动物模型的建立及tau蛋白病变表征
马登磊 张 旭 罗 艺 黄 蕊 李雅莉 李 林 张 兰*
(1.首都医科大学宣武医院药学部,北京 100053;2.神经变性病教育部重点实验室,北京 100053;3.北京市神经药物工程研究中心,北京 100053;4.首都医科大学宣武医院中心实验室,北京 100053)
微管相关蛋白tau(microtubule-associated protein tau,MAPT)是一种微管结合蛋白,在细胞中发挥正常的生理功能。在神经元中tau蛋白主要富集于神经元轴突内,与微管结合并调节微管的组装与解聚,维持微管的稳定性[1]。而当tau蛋白发生异常病变时,如发生基因突变、过度磷酸化等,会引起tau蛋白的结构发生变化,无法发挥正常生理功能,并自身发生异常聚集而引起病理改变,最终导致一类tau蛋白相关疾病(tauopathy)的发生[2]。Tau蛋白病通常以tau蛋白异常磷酸化或异常聚集为特征,包括阿尔茨海默病(Alzheimer’s disease,AD)、连锁于17号染色体tau突变伴帕金森综合征的额颞叶痴呆(frontotemporal dementia with Parkinsonism linked totaumutations on chromosome 17,FTDP-17)、皮质基底节变性等[3]。
在tau蛋白相关研究[4]中,tau转基因动物模型可以模拟AD及其他tau蛋白病的一些疾病特征,被广泛应用于相关疾病的病理机制研究及药物研发中。在FTDP-17患者家系中发现了tau基因突变,P301位点导致的突变会引起患者出现痴呆为主的临床表现[5]。因此,以P301L和P301S突变tau蛋白转基因模型可以模拟AD及其他tau蛋白病(tauopathy)的一些疾病特征,例如tau蛋白的磷酸化和病理性沉积、神经元死亡、认知功能障碍等[6-7]。而目前在国内,tau蛋白相关的疾病模型尚较少,因此本研究拟通过建立细胞和动物的转P301S/L模型,并观察其tau蛋白病理改变,进而为基于tau蛋白模型的研究提供参考。
1 材料与方法
1.1 模型的构建
1.1.1 P301S/L质粒的构建
由南通大学刘飞教授惠赠的tau40质粒进行点突变。其中tau40质粒:PCI-neo,酶切位点:sal1+not1,表达最长人源tau基因(tau441,2N4R; NCBI序列号: NM_005910.5),和一个HA的标签。突变的位点是位于exon10上面的301号脯氨酸(对应的碱基序列是901~903:CCG):其中P301S将CCG突变成TCG;P301L将CCG突变成CTG。
点突变引物设计:Mut-P301S-up:5′-ATAATATCAAACACGTCTCGGGAGGCGG-3′,Mut-P301S-down:5′-AGACGTGTTTGATATTATCCTTTGAGCCACA-3′,Mut-P301L-up:5′-TAATATCAAACACGTCCTGGGAGGCGGC-3′,Mut-P301L-down:5′-AGGACGTGTTTGATA TTATCCTTTGAGCCAC-3′。
1.1.2 P301L转基因小鼠的繁育
rTg4510[即Tg(Camk2a-tTA)1Mmay+Tg(tetO-MAPT*P301L)#Kha/J小鼠]转基因小鼠由Tg(tetO-MAPT*P301L)#Kha/J转基因小鼠和Tg(Camk2a-tTA)1Mmay转基因工具小鼠配种,得到的阳性F1代[8]。其中Tg(tetO-MAPT*P301L)#Kha/J由北京理工大学庆宏教授惠赠(购自The Jackson Laboratory,批号:015815)。B6;CBA-Tg(Camk2a-tTA)1Mmay/JNju小鼠购自南京大学-南京生物医药研究院,实验动物许可证号:SCXK(苏) 2015-0001。转基因小鼠由Tg(tetO- MAPT*P301L)#Kha/J转基因小鼠和Tg(Camk2a-tTA)1Mmay转基因工具小鼠配种,F1代中两个基因型均为阳性的小鼠为表达P301L-tau蛋白的rTg4510转基因阳性小鼠。
1.1.3 P301S转基因小鼠的繁育
由B6;C3-Tg(Prnp-MAPTP301S)PS19VleJnju转基因小鼠与C57BL/6J野生型小鼠交配,得到F1代,进行基因鉴定为阳性的即为PS19-P301S转基因突变小鼠[9]。
1.2 动物饲养
动物饲养于屏障环境中。采用12 h/12 h昼夜间断照明,饲养温度20~26 ℃,湿度40%~70%,自由进食饮水。繁育期间定时观察小鼠情况,记录仔鼠的出生日期、只数等,并于出生后14 d左右剪脚趾编号,21 d进行离乳和雌雄分笼。新生仔鼠的编号剪下的脚趾用于基因型鉴定。使用KAPA快速基因分型试剂盒进行基因分型(KAPA Biosystems公司,美国)。
1.3 细胞转染
人胚胎肾细胞HEK293T于5%(体积分数) CO2、37 ℃培养箱内进行培养,每2~3 d更换1 次含10%(体积分数)胎牛血清的DMEM完全培养基。细胞生长至足够丰度时,将105个/mL细胞接种于12 孔培养板中;24 h后更换新鲜的完全培养基,用Polyplus转染试剂进行转染,质粒DNA∶转染试剂=1 μg∶2 μL,放人培养箱继续培养; 24 h后更换新鲜的完全培养基,继续培养24 h后,使用超声细胞粉碎机超声,裂解细胞提取蛋白。
1.4 实验分组
本研究的细胞模型部分,分别在HEK293细胞中转染不同的质粒,过表达相关的基因,分为空载体组(vector)、野生型tau蛋白(tau40)、P301L突变tau蛋白(P301L)和P301S突变tau蛋白(P301S)细胞模型组。在动物模型部分,本研究应用了P301L转基因小鼠组(rTg4510)及同笼对照小鼠(nTg-1),P301S转基因小鼠组(PS19)及同笼对照小鼠组(nTg-2),7月龄时分别取各组小鼠(n=3)做免疫组织化学实验,11月龄时取各组小鼠(n=4)进行蛋白表达检测。
1.5 动物组织的取材
1.5.1 新鲜组织裂解
待转基因小鼠饲养到11月龄时,分别取转基因阳性鼠rTg4510和PS19小鼠及相应的转基因阴性小鼠的大脑皮质,加入含有蛋白酶和磷酸酶抑制剂的RIPA 裂解液裂解匀浆,超声裂解后室温静置30 min,4 ℃离心机以12 000 r /min 的转速离心15 min 后取上清,测定各组中蛋白的浓度。加入蛋白上样缓冲液,95 ℃变性5 min,得到蛋白样本用于Western blotting法检测。
1.5.2 固定组织取材及冰冻切片
分别取7月龄的转基因阳性鼠rTg4510和PS19小鼠及相应的转基因阴性小鼠,麻醉后分别灌注0.9%(质量分数)氯化钠注射液及4%(质量分数)多聚甲醛固定液。固定后取出脑组织,脱水后在冰冻切片机(620E,购自美国Thermo公司)中行冠状位冰冻切片,切片厚度分别为30 μm。
1.6 Western blotting 法检测蛋白表达
将等量蛋白上样样本按顺序缓慢匀速加入丙烯酰胺凝胶的孔中,恒压100 V 电泳、恒压90 V电转120 min,将蛋白转移到PVDF膜上,5%(质量分数)脱脂奶粉封闭(室温,2 h),一抗tau5抗体(识别总tau蛋白,1∶1 000,购自德国Calbiochem公司),pS199/202抗体(识别Ser199/202位点磷酸化的tau,1∶1 000,购自美国Invitrogen公司),PHF-1抗体(识别Ser399/404位点磷酸化的tau,1∶1 000,购自美国Abcam公司),pS396抗体(识别Ser396位点磷酸化的tau,1∶1 000,购自美国Invitrogen公司),pS404抗体(识别Ser404位点磷酸化的tau,1∶1 000,购自美国Invitrogen公司),内参抗体GAPDH(1∶1 000,购自美国CST公司);一抗4 ℃孵育过夜后,二抗室温孵育2 h,随后TBST洗膜3次。在化学凝胶成像系统(Flour ChemHD2)中,加入化学发光液(购自德国Millipore公司),得到合适的曝光条带,进一步进行蛋白半定量分析。
1.7 免疫组织化学及免疫荧光法
冰冻切片提前切片于载玻片上,10%(体积分数)血清封闭。室温封闭2 h后,孵育一抗β-(Ⅲ)-tubulin(1∶200,美国CST公司)AT8(识别Ser202/205位点磷酸化的tau,1∶1 000,美国Thermo公司),一抗用抗体稀释液稀释,4 ℃过夜。PBST洗去一抗后,免疫组织化学法孵育免疫组织化学二抗及三抗。PBST漂洗后用DAB显色液进行显色(中杉金桥公司)。脱水,中性树胶封片,并在显微镜(日本Olympus公司)下观察。免疫荧光法则孵育荧光二抗,用含DAPI的封片剂封片,并在荧光显微镜下观察。
1.8 统计学方法

2 结果
2.1 过表达tau40、P301L和P301S细胞模型中tau蛋白表达
在HEK293细胞中分别转入等量的空质粒(vector),以及分别含有tau40、P301L和P301S突变tau的质粒。Western blotting法检测结果显示(表1),转染tau40、P301L和P301S的HEK293细胞均过表达了总tau蛋白,与空质粒组比较,差异均有统计学意义(P<0.05),而各组间差异无统计学意义(P>0.05)。进一步检测了主要的tau蛋白磷酸化位点(与总tau相比较得到相对tau蛋白的磷酸化水平),丝氨酸199/202以及396/404位点的磷酸化水平在转染tau40、P301L和P301S,均显著高于空质粒组(P<0.05),其中P301S的在这些位点的磷酸化水平要高于tau40和P301L组,详见表1、图1。
2.2 过表达tau40、P301L和P301S对HEK293细胞骨架形态的影响
本研究应用β-tubulin识别细胞微管。与空质粒组相比,过表达tau蛋白的细胞微管形态均发生了改变,未均匀分布在细胞质中,发生了收缩或聚集,且在P301L和P301S组中尤其明显(图2)。
2.3 P301L和P301S转基因小鼠中tau蛋白及磷酸化tau蛋白的表达
取11月龄转基因小鼠的脑组织进行Western blotting检测,与转基因阴性小鼠相比,转基因阳性小鼠tau蛋白表达均显著增加(P<0.01),而且rTg4510小鼠的tau蛋白表达量也显著高于PS19小鼠(P<0.05,图3)。进一步检测tau蛋白磷酸化水平(与总tau相比较),转基因阳性鼠在丝氨酸199/202、396、404位点的磷酸化水平均显著高于转基因阴性小鼠(P<0.05),其中丝氨酸199/202、396磷酸化水平rTg4510小鼠略高于PS19小鼠,丝氨酸404位点的磷酸化水平rTg4510小鼠略低于PS19小鼠,详见表2。

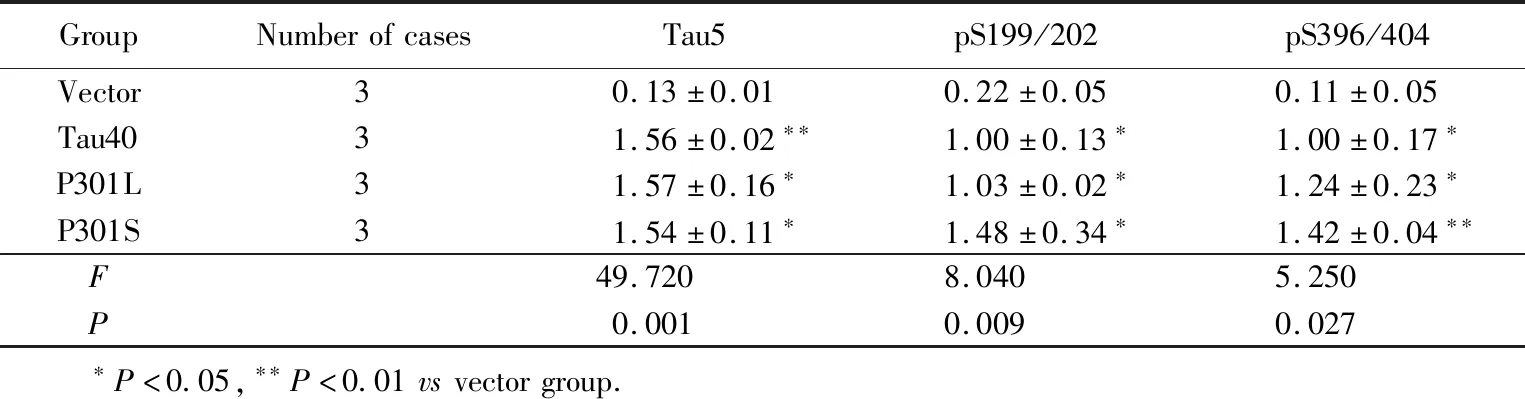
GroupNumberofcasesTau5pS199/202pS396/404Vector30.13±0.010.22±0.050.11±0.05Tau4031.56±0.02∗∗1.00±0.13∗1.00±0.17∗P301L31.57±0.16∗1.03±0.02∗1.24±0.23∗P301S31.54±0.11∗1.48±0.34∗1.42±0.04∗∗F49.7208.0405.250P0.0010.0090.027 ∗P<0.05,∗∗P<0.01vsvectorgroup.
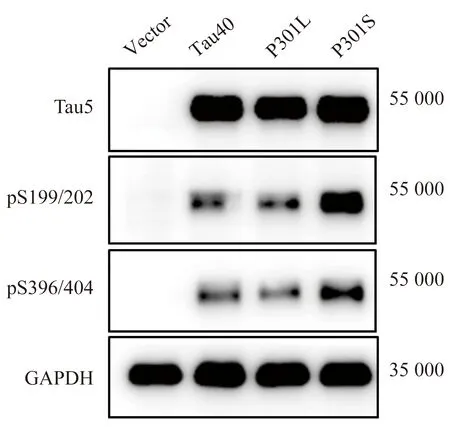
图1 Western blotting法检测HEK293细胞中转染tau40、P301L和P301S质粒后tau蛋白及磷酸化tau的表达Fig.1 Western blotting for tau and relative level of phosphorylated (p)-tau in tau40/P301L/P301S-plasmid transfected HEK293 cells
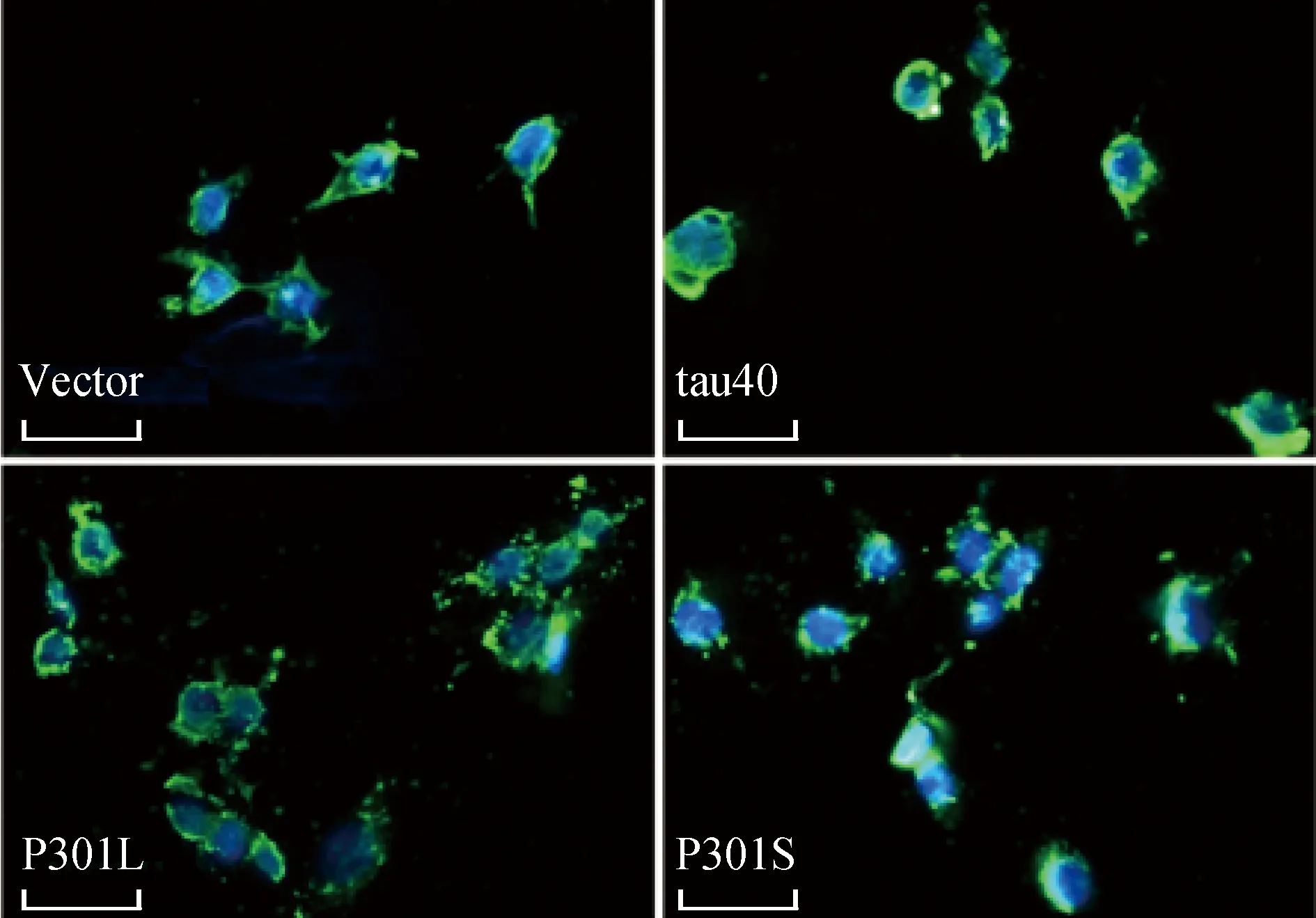
图2 HEK293细胞中转染tau40、P301L和P301S质粒后微管形态的变化Fig.2 Changes of microtubules in tau40/P301L/P301S-plasmid transfected HEK293 cells (Scale bar=20 μm)
Representative images of immunofluorescence staining for β-tubulin labeled microtubules.
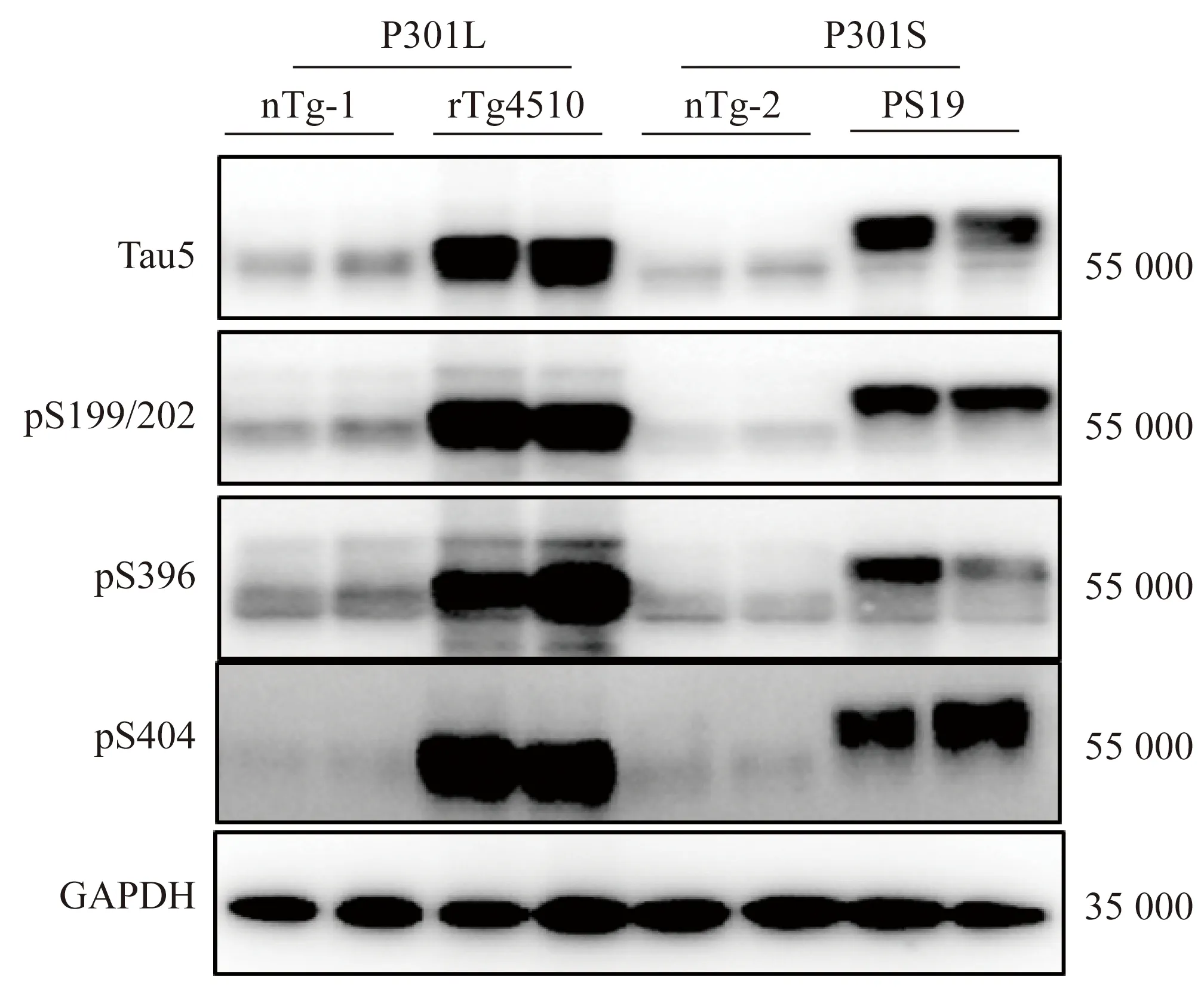
图3 Western blotting法检测tau蛋白转基因小鼠皮质tau蛋白及磷酸化tau的表达Fig.3 Western blotting for tau and relative level of phosphorylated (p)-tau in tau transgenic mice models
nTg-1:negative transgenic control of rTg4510 mice;nTg-2:negative transgenic control of PS19 mice;PS19:transgenic mice model for P301S tau.
2.4 P301L和P301S转基因小鼠中磷酸化tau蛋白免疫组织化学染色
应用AT8抗体(识别Ser202/205位点磷酸化的tau蛋白)利用免疫组织化学的方法检测tau蛋白病理情况。在8月龄的rTg4510小鼠和PS19小鼠的内嗅皮质区域均显示了AT8抗体的阳性。其中rTg4510小鼠的阳性细胞数量要多于PS19小鼠该区域的阳性细胞数量(图4)。

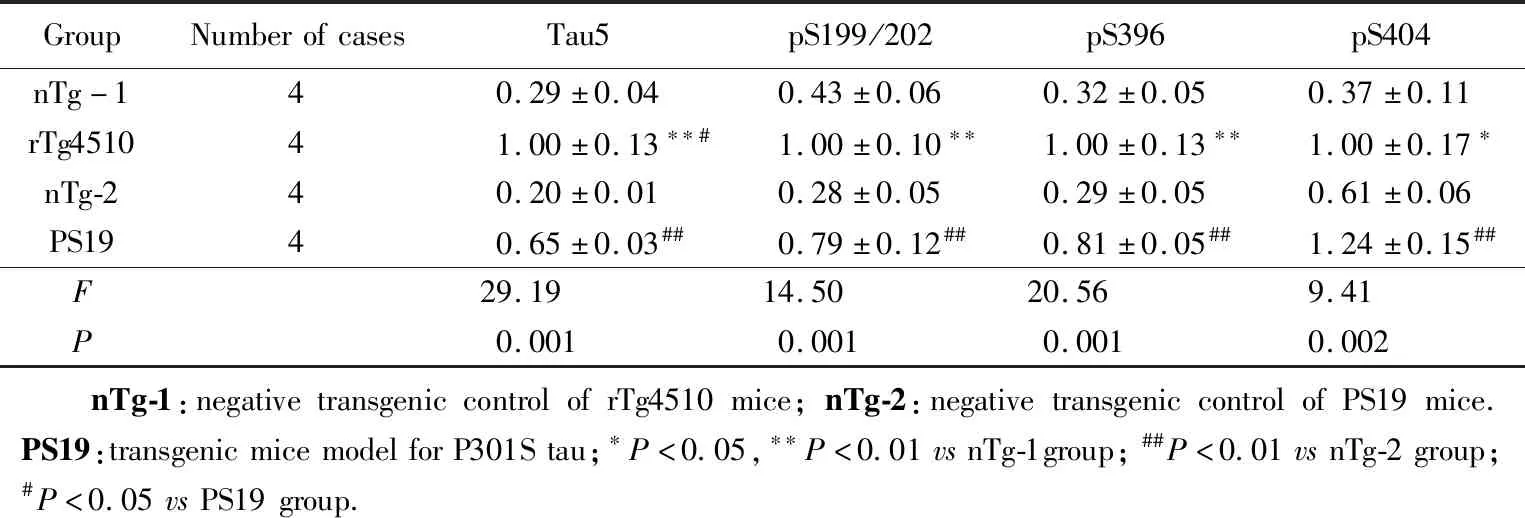
GroupNumberofcasesTau5pS199/202pS396pS404nTg-140.29±0.040.43±0.060.32±0.050.37±0.11rTg451041.00±0.13∗∗#1.00±0.10∗∗1.00±0.13∗∗1.00±0.17∗nTg-240.20±0.010.28±0.050.29±0.050.61±0.06PS1940.65±0.03##0.79±0.12##0.81±0.05##1.24±0.15##F29.1914.5020.569.41P0.0010.0010.0010.002 nTg-1:negativetransgeniccontrolofrTg4510mice;nTg-2:negativetransgeniccontrolofPS19mice.PS19:transgenicmicemodelforP301Stau;∗P<0.05,∗∗P<0.01vsnTg-1group;##P<0.01vsnTg-2group;#P<0.05vsPS19group.
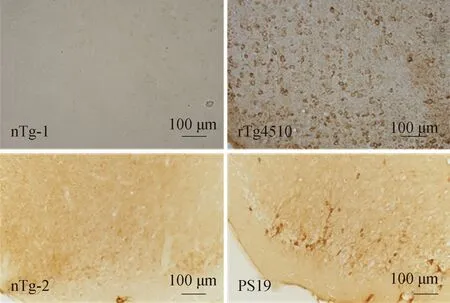
图4 Tau蛋白转基因小鼠皮质AT8免疫组织化学染色Fig.4 Immunohistochemistry staining of AT8 in the entorhinal cortex of tau transgenic mice models (Scale bar=100 μm)
Representative images of Immunohistochemistry staining of AT8 (against PHF-tau at Ser202/205) in the entorhinal cortex of tau transgenic mice models.nTg-1:negative transgenic control of rTg4510 mice;PS19:transgenic mice model for P301S tau;nTg-2:negative transgenic control of PS19 mice;PHF:paired helical filaments.
3 讨论
在AD等神经系统疾病的研究中,tau蛋白受到了越来越多的关注,tau蛋白相关的机制研究和以tau蛋白为靶点治疗AD及tau蛋白相关疾病成为国内外研究的热点。在tau蛋白在AD等相关疾病中的机制研究中发现,tau蛋白的过度磷酸化是导致病理改变最重要的原因[10]。tau蛋白的磷酸化主要通过两个方面影响正常的生理功能。一方面tau蛋白的过度磷酸化可以降低tau蛋白与微管的正常结合,引起tau蛋白与微管结合能力降低和微管的解体[11]。另外一方面,tau蛋白从微管解离可以引起细胞内游离tau蛋白增加,而过度磷酸化的tau蛋白则可以进一步促进游离tau蛋白的异常聚集[12]。Tau蛋白发生异常聚集后可以进一步损伤微管和轴浆运输,影响细胞的正常生理功能[13]。
本研究分别应用国际上比较认可的tau蛋白转基因动物模型,rTg4510转基因小鼠(过表达~13倍于内源性tau 的人P301L突变的4R0N-tau蛋白)以及PS19转基因小鼠(过表达3~5倍于内源性tau的人源P301L突变4R1N-tau蛋白)。首先在细胞模型中过表达了tau及P301位点突变的tau蛋白,引起tau蛋白水平以及tau蛋白磷酸化水平的增加,同时也导致微管的形态发生了改变,提示了过表达tau蛋白引起的tau蛋白过度磷酸化可能通过影响了微管的形态和生理功能,发挥毒性作用。同时,表达突变tau蛋白的细胞内磷酸化水平及微管病变与野生型tau蛋白略有差异,提示突变tau蛋白可能会产生更大的毒性作用。突变tau蛋白会引起tau蛋白构象等改变,进而导致tau蛋白更易发生聚集或形成缠结,进而产生tau蛋白病变[14]。因此,多个tau突变被用于构建动物模型,模拟tau蛋白引起的病理改变,其中以P301L/S突变构建的转基因小鼠模型种类较多,表型相对明显[15]。与之前研究[8]报道结果一致,本研究中rTg4510小鼠可以过表达tau蛋白,显著高于对照组内源tau的表达。同时,PS19小鼠tau蛋白表达量也显著高于对照小鼠,且低于同月龄的rTg4510小鼠,这也与PS19过表达tau蛋白的量较低的报道[9,16-17]是一致的。在本研究检测的磷酸化位点中,转基因小鼠的磷酸化水平均显著高于转基因阴性小鼠,但是不同位点的相对磷酸化水平的高低两个小鼠略有差异,提示不同的突变类型可能造成不同位点的磷酸化水平产生差异。
综上所述,本研究通过构建并表征了3个过表达tau及突变tau蛋白的细胞模型,繁育并检测了两个突变tau蛋白转基因小鼠模型。并通过检测tau蛋白表达、tau蛋白磷酸化的水平以及微管的形态等初步比较了不同模型间的差异。通过本研究得到的结果,能够为tau蛋白及tau蛋白相关疾病的研究提供了可选择的病理模型。
——水芹主要害虫识别与为害症状

