海洋拟诺卡菌来源的天然产物
王聪 雷福厚 谭学才 李小燕 杨立芳 朱晨
(广西林产化学与工程重点实验室,广西高校食品安全与药物分析化学重点实验室,广西民族大学化学化工学院,南宁 530006)
海洋拟诺卡菌由于其独特的代谢途径和生理功能,成为海洋放线菌活性天然产物的重要来源。朱伟明教授课题组对2010—2013年初的海洋放线菌新天然产物的统计表明,对拟诺卡菌的研究仅次于链霉菌[1]。海洋拟诺卡菌来源的新天然产物的研究始于2001年,Davidson课题组报道了首例海洋拟诺卡菌来源的天然产物kahakamides A(7)和B(8)[1];截止至2018年6月的17年时间里,已报道了65个海洋拟诺卡菌新天然产物。这些天然产物的结构类型包括吡喃酮类、二酮哌嗪类、多肽类等;并具有多种生物活性,包括抗菌、抗肿瘤和抗炎等。因此海洋拟诺卡菌来源的天然产物可能是海洋微生物药物先导化合物的重要来源,本文从海洋拟诺卡菌的菌株来源、化合物结构和生物活性出发,综述了65个海洋拟诺卡菌来源的新天然产物。
1 海洋动物来源拟诺卡菌的新天然产物(图1)
拟诺卡菌(Nocardiopsissp.)HB383(德国波罗的海,海绵Halichondria panicea)代谢产生γ-吡喃酮类化合物nocapyrones A~D(1~4)[3]。无色拟诺卡菌(Nocardiopsis alba,广西斜阳岛,柳珊瑚)代谢产生一个新的二酮哌嗪类化合物nocarazepine A(5)[4]。
2 海洋植物来源拟诺卡菌的新天然产物(图1)
丁内酯类化合物3'-hydroxy-N-(2-oxo-2,5-dihydrof uran-4-yl)propionamide(6)分离自卢森坦拟诺卡菌(Nocardiopsis lucentensissp.)ASMR2(红海,海洋植物)[5]。2-吡喃酮类化合物nocapyrones A~C(7~9)分离自一株拟诺卡菌(Nocardiopsissp.)A00203(福建,红树林树叶)[6]。
3 海洋沉积物来源拟诺卡菌的新天然产物(图1~2)
2个新的吲哚核苷类化合物kahakamides A~B(10~11)分离自达松维尔拟诺卡菌(Nocardiopsis dassonvillei,夏威夷的考艾岛)。化合物10对枯草芽孢杆菌(Bacillus subtilis)有弱的抑菌活性[7]。拟诺卡菌属M0349(太平洋深海)代谢产生一个新的环四肽化合物MKN-349A(12)[8]。Cho等[9]从美国巴哈马群岛盐池沉积物来源的卢森坦拟诺卡菌(Nocardiopsis lucentensis)CNR-712中分离出4个新的肽类化合物lucentamycins A~D(13~16)。其中含有苯环或吲哚环结构的化合物13和14对HCT-116细胞系具有良好的细胞毒性,IC50值分别为0.20和11μmol/L,而化合物15和16显示弱的活性,由此可以表明芳香环可能是这类分子抗肿瘤活性的药效官能团。2012年又从该菌中分离得到1个新的肽类似物lucentamycin E(17)[10]。一株拟诺卡菌(Nocardiopsissp.)GQ374440(斐济)代谢产生糖苷类化合物fijiolides A~B(18~19),化合物18具有强的抑制人肿瘤坏死因子TNF-α介导的NFκB和激活醌还原酶的作用(IC50为0.57μmol/L),而化合物19对核因子NFκB的抑制作用弱于化合物18,且对醌还原酶无作用[11],说明该类化合物乙酰化活性提高。另一株拟诺卡菌(Nocardiopsissp.)TFS65-07(挪威特隆赫姆海湾)产生的环肽TP-1161(20)对多种耐万古霉素的革兰阳性菌均有很强的抑制作用(MIC值为0.25~1.0μg/mL)[12]。
Raju等[13]从拟诺卡菌(Nocardiopsissp.)CMBM0232(澳大利亚布里斯班南莫尔岛)中获得了异戊烯基化的二酮哌嗪化合物norcardioazines A~B(21~22),其中化合物21能逆转多重耐药结肠癌细胞对多柔比星的耐药,在20μmol/L时可以抑制肿瘤细胞SW620,Ad300对多柔比星的多重耐药性,且无细胞毒,初步判断异戊烯基环化活性升高。叶涛等[14]采用化学全合成证明了化合物22的绝对构型。塘拟沽诺卡菌(Nocardiopsis tangguensis)HBUM 174826(日本高知)代谢产生δ-内酯类化合物3,6,7-tri-epi-invictolide(23)和24[15]。达松维尔拟诺卡菌(Nocardiopsis dassonvillei)HR10-5(东营黄河河口)代谢产生α-吡喃酮类化合物nocapyrones E~G(25~27)、二酮哌嗪类化合物nocazines A~C(28~30)及噁唑啉类化合物nocazoline A(31),其中化合物25~27有中等的抗芽孢杆菌活性的MIC值分别为26、14和12μmol/L)[16]。无色拟诺卡菌(Nocardiopsis alba)SCSIO 03039(印度洋深海)代谢产生2个新的二酮哌嗪类化合物32和33[17]。(Nocardiopsissp.)KMF-001(韩国东海)代谢产生3个新颖的吡喃酮类化合物nocapyrones H~J(34~36),化合物34能降低促炎因子的含量,如细胞炎症因子NO、前列腺素E2(PGF2)和白细胞介素1β(1L-1β),在10μmol/L的浓度下,化合物34对抑制NO产生的效果比白介素(chrysin)强5.82%[18],该类化合物取代基为异丁基时,活性强于取代基正丙基和正丁基。Nocardiopsissp.CNX037(圣地亚哥)代谢产生两个环六肽化合物nocardiamides A~B(37~38),并通过全合成且确定了该类化合物中氨酸残基的绝对构型[19]。新的聚酮类化合物nocardiopsin C(39)、nocardiopsin D(40)和nocardiopyrone A(41)分离自Nocardiopsissp.CMB-M0232(南莫尔岛)[20]。氨基咪唑类化合物nocarimidazoles A~B(42~43)分离自海洋放线菌(Nocardiopsissp.)CNQ115(南加利福尼亚)。化合物42和43对乙酰胆碱酯酶(AChE)有弱的抑制活性(浓度为100μg/mL)。化合物42对枯草芽孢杆菌(Bacillus subtilis)和表皮葡萄球菌(Staphylococcus epidermidis)显示弱的抑菌活性(MIC值均为64μg/mL)。化合物43对枯草芽孢杆菌Bacillus subtilis有弱的抑菌活性(MIC值为64μg/mL)[21]。(Nocardiopsissp.)KM2-16(日本冲绳西表岛)代谢产生二酮哌嗪类化合物44[22]。放线菌(Nocardiopsissp.)SCSIO 10419(广西北海斜阳岛)代谢产生5个新的α-吡喃酮类化合物4-deoxyphomapyrone C(45)、4-Deoxy-11-methylphomapyrone C(46)、4-deoxy-11-hydroxyphomapyrone C(47)、(-)-4-Deoxy-8-hydroxyphomapyrone C(48)和4-deoxy-7R-hydroxyphomapyrone C(49),一个新的α-吡喃酮类化合物10-hydroxymucidone(50)来自于Nocardiopsissp.SCSIO 04583(中国南海)[23]。Nocardiopsissp.SCSIO KS107(南极海区)代谢产生2个新的α-吡喃酮类化合物germicidin H(51)和4-hydroxymucidone(52)。化合物46和50对藤黄微球菌(Micrococcus luteus)的MIC值为32μg/mL。化合物45对枯草芽孢杆菌(Bacillus subtilis)SCSIO BS01的MIC值为64μg/mL[23]。

图1 化合物1~33的结构Fig.1 Structures of compounds 1~33
Nocardiopsissp.CNQ-675(拉霍亚)代谢产生化合物marinopyrone D(53),该化合物对LPS诱导的RAW264.7巨噬细胞抑制NO的生成,IC50为13μmol/L[24]。化合物2-[(2R-hydroxypropanoyl)amino]benzamide(54)分离自Nocardiopsissp.G057(越南广宁省姑苏群岛海岸),化合物54对大肠埃希菌(Escherichia coli)的MIC值为16μg/mL(阳性对照链霉素为32μg/mL)[25]。Isomethoxyneihumicin(55a和55b)是无色拟诺卡菌(Nocardiopsis alba)KM6-1(日本小笠原群岛父岛)产生的一对互变异构体,该化合物(15.0μmol/L)在12h内细胞周期被阻滞在G2/M(66%),在20h内对Jurkat细胞的IC50为6.98μmol/L[26]。5个新的α-吡喃酮类化合物nocapyrones O-S(56~60)分离自Nocardiopsissp.YIM M13066(深海海泥)[27]。该菌株还代谢产生两个新的二酮哌嗪类化合物nocazine F(61)和nocazine G(62),化合物61对H1299、HeLa、HL7702、MCF-7、PC3细胞的IC50分别为3.87、4.47、7.10、3.86和8.17μmol/L。化合物62对H1299、HeLa、HL7702、MCF-7和PC3细胞的IC50分别为2.60、3.97、8.73、6.67和16.7μmol/L。化合物62对枯草芽孢杆菌Bacillus subtilisATCC6051的MIC值为25.8μmol/L。化合物可以剂量依赖性抑制SPI-1效应分子SipC的分泌[28]。Nocardiopsis dassonvilleisubsp.dassonvilleiDSM43111(T)(北冰洋深海)代谢产生一个新的α-吡喃酮类化合物nocapyrone S(63)[29]。从Nocardiopsissp.NHF48(中国南海)中分离得到一个新的α-吡喃酮类化合物64,对小鼠黑色素瘤细胞B16的GI50为61.7μg/mL[30]。大环内酰胺类化合物fluvirucin B6(65)分离自海洋放线菌(Nocardiopsissp.)CNQ-115(南加州海岸),化合物65对枯草芽孢杆菌(Bacillus subtilis),嗜根考克菌(Kocuria rhizophila)和金黄色葡萄球菌(Staphylococcus aureus)的MIC值分别为64、32和32μg/L[31]。
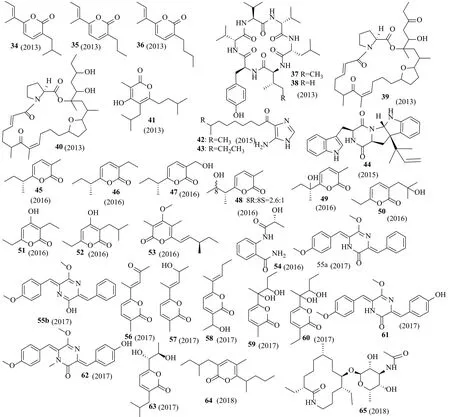
图2 化合物34~65的结构Fig.2 Structures of compounds 34~65
4 总结
综上,从2001年报道的首例海洋拟诺卡菌来源的天然产物kahakamides A(7)和B(8)到2018年6月的17年时间里,一共报道了65个海洋拟诺卡菌来源的新天然产物(表1)。其结构类型呈现多样性,涉及吡喃酮类、二酮哌嗪类、多肽类、吲哚糖苷类、氨基咪唑类及大环内酰胺等;且29%的海洋拟诺卡菌来源的天然产物表现出抑菌、细胞毒、抗炎等生物活性(表1),是发现海洋活性天然产物的重要资源。
(1)从海洋拟诺卡菌新天然产物的数量看,新化合物的数量在2010—2011年、2013年以及2016—2017年报道较多。2011年最多,报道数量为11个(图3)。
(2)从海洋拟诺卡菌的样品来源看,产生新化合物最多的海洋链霉菌的来源依次是海洋沉积物(56个)、海洋动物(5个)和海洋植物(4个),分别占86.2%、7.7%和6.1%(图4)。
(3)从化合物的结构类型看,化合物最多的类型依次是吡喃酮(30个),占海洋拟诺卡菌海洋天然产物总数的46.2%(图5)。
(4)29%的海洋拟诺卡菌(65个)表现出抗菌、肿瘤细胞毒、抗炎等生物活性,而抑菌活性(10个)和肿瘤细胞毒活性(7个)是主要的活性类型,分别占活性化合物总数的52.6%和36.8%(图6)。

表1 海洋拟诺卡菌来源的天然产物Tab.1 New natural products from the marine-derived Nocardiopsis spp.
(5)我国学者在11篇学术文章中贡献了32个海洋拟诺卡菌来源的海洋天然产物,约占化合物总数的50%(图7)。
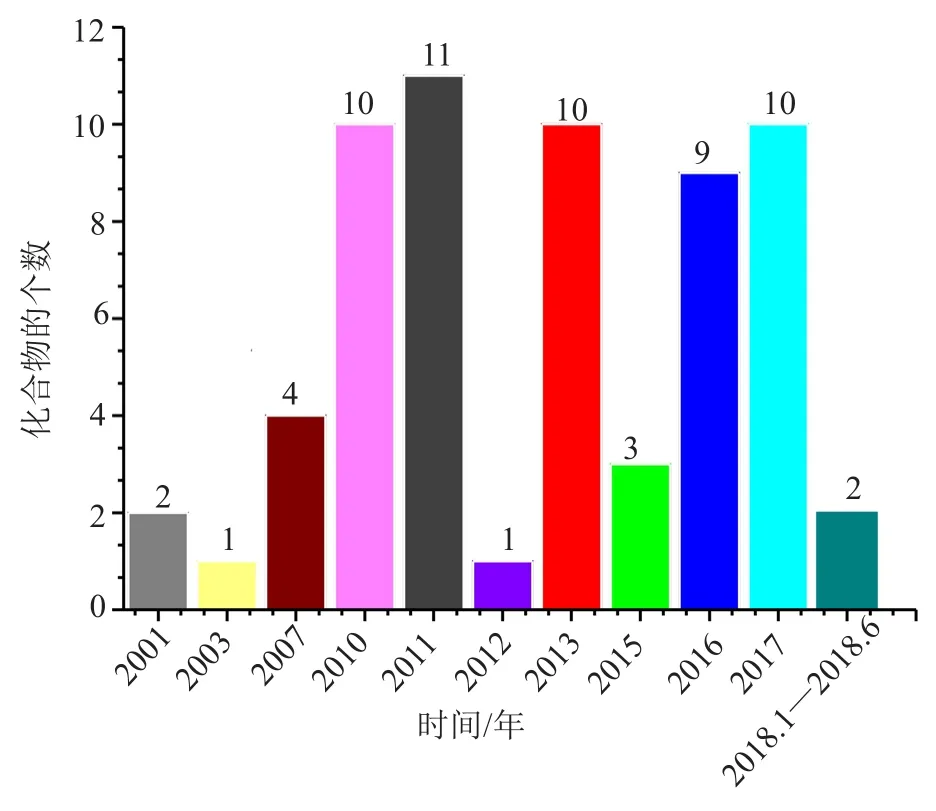
图3 每年从海洋拟诺卡菌中分离的天然产物的数量Fig.3 Annual number of marine natural products from marinederived Nocardiopsis spp.

图4 海洋拟诺卡菌天然产物的来源Fig.4 Origin categoriesof marine natural products from marinederived Nocardiopsis spp.
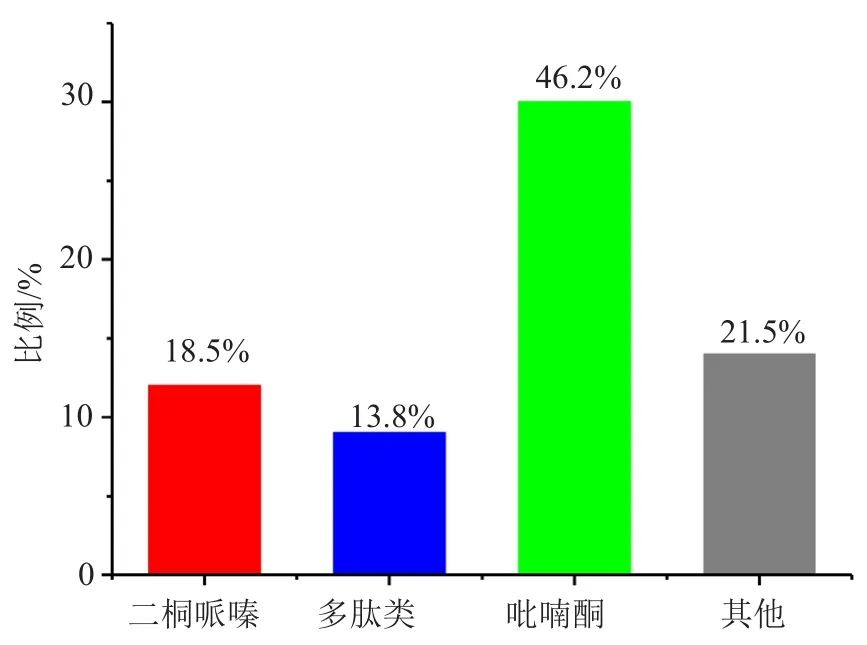
图5 海洋拟诺卡菌天然产物的结构分类Fig.5 The main structure types of marine natural products from marine-derived Nocardiopsis spp.
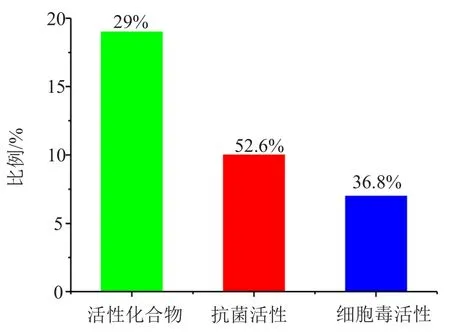
图6 海洋拟诺卡菌天然产物的活性分类Fig.6 Bioactive categories of marine natural products from marine-derived Nocardiopsis spp.
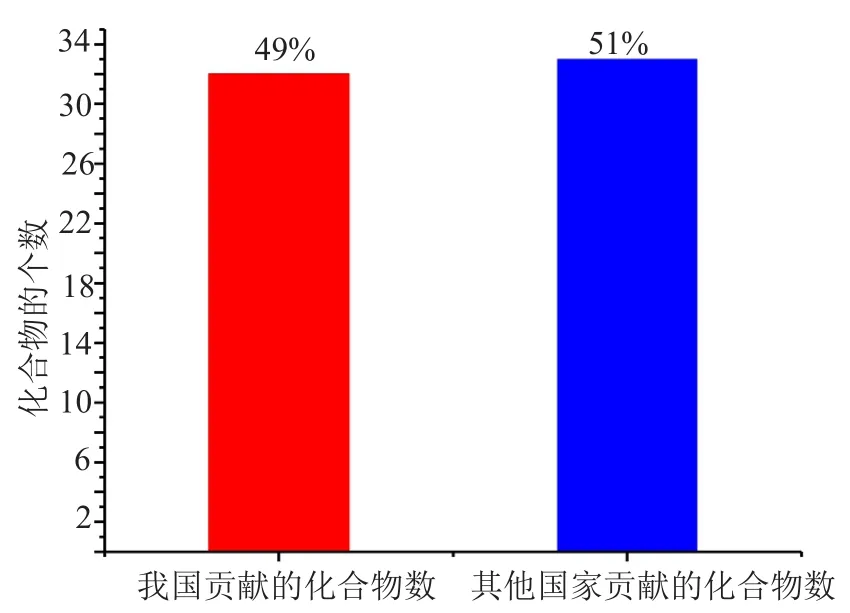
图7 中国学者发表的化合物比例Fig.7 The proportion of compounds of chinese scholars