鲫CyHV-2病毒病的诊断及组织病理损伤研究
熊关庆,段 靖,冯 杨,倪 萍,黄小丽*,汪开毓,邓永强,耿 毅,陈德芳,欧阳萍,杨世勇
(1.四川农业大学动物科技学院,成都 611130;2.四川农业大学动物医学院,成都 611130;3.四川省农业厅,成都 610016)
鲤疱疹病毒Ⅱ型(Cyprinid herpesvirus 2,CyHV-2),也称为金鱼(Carassius auratus)造血器官坏死病病毒(goldfish haematopoietic necrosis virus,GFHNV)[1]。CyHV-2 具有极强的宿主特异性,只感染金鱼、鲫鱼及其普通变种[2]。1995年Stephens[3]首次在日本金鱼体内发现CyHV-2。接着在美国[4]、中国台湾[5]、英国[6]等国家和地区也相继发现金鱼感染该病毒,并可造成严重的经济损失。随着时间的推移,该病毒的感染范围不断扩大。2011年,匈牙利的A.Doszpoly[7]首次在养殖的鲫鱼体内检测到CyHV-2。随后,捷克[8]、意大利相继也有了关于CyHV-2 感染鲫鱼的报道。直到2012年,Wang L.等[9]才首次在我国东部地区养殖的鲫鱼体内发现CyHV-2。
鲫(Carassius auratus)是我国重要的淡水养殖品种之一,具有食性杂、适应能力强、肉质鲜美和营养丰富等优点[10]。近年来,我国鲫鱼的养殖规模越来越大,2013年中国鲫鱼的年产量达到259.44 万t[11],在水产养殖中占有举足轻重的地位。由于养殖密度不断增大、种质退化以及管理不善等多方面因素的影响,我国鲫鱼养殖业受到疾病的威胁和挑战越来越大。其中,鳃出血症是近年来危害鲫鱼健康养殖的主要疾病,给鲫鱼养殖造成了极大的经济损失。鳃出血症成为了阻碍鲫鱼健康养殖的巨大瓶颈,鲫鱼鳃出血症的正确诊断与防治对于鲫鱼养殖具有重要意义。
2016年5月,四川某鲫鱼养殖场的鲫鱼出现以烂鳃、鳃出血及鳃发黑为主要症状,并伴有鱼鳍末端发白、鳃盖出血的大规模死亡现象,死亡率极大,给养殖户造成了巨大的经济损失。本研究通过剖检观察、寄生虫学检测、细菌学检测、病毒学检测等方法,对发病鲫鱼进行诊断,结合组织病理技术检测组织病理损伤程度,拟探寻该病的主要损伤靶器官并分析致病原因,为相关疾病的诊断提供参考借鉴。
1 材料和方法
1.1 试验动物
具有典型患病症状的鲫鱼5 尾,来自四川某鲫鱼养殖场,体长15~18 cm,用于剖检观察和病料采集。送检时病鱼存活。
1.2 剖检观察
将患病鲫鱼用MS222 麻醉后剖检。首先检查病鱼体表完整性及其他体表症状,同时取少量鳃丝和体表黏液压片,显微镜下观察有无寄生虫感染。打开围心腔、腹腔依次观察各内脏器官大体病变情况。
1.3 细菌学检测
无菌操作条件下从患病鱼的肝脏、脾脏中取样于LB 培养基上划线接种,22 ℃恒温培养,48 h 后观察细菌生长状况。
1.4 病毒学检测
参照T.B.Waltzek 等[12]设计引物对患病鱼组织进行CyHV-2 PCR 检测(表1)。取患病鱼肝胰脏、脾脏、肾脏和鳃等组织,根据TRIzol 试剂盒说明书快速提取DNA,接着进行PCR 扩增。PCR 扩增体系为:12.5 μL Mix-reaction buffer,上、下游引物各 1 μL,加入 cDNA 模板 2 μL,8.5 μL ddH2O。PCR 扩增条件:95 ℃预变性 5 min,95 ℃变性 1 min,53 ℃复性30 s,72 ℃延伸 1 min,30 个循环,72 ℃延伸 10 min。反应结束后取10 μL 扩增产物进行1.5%琼脂糖凝胶电泳,在凝胶成像系统下分析结果。PCR 产物经DNA 纯化试剂盒纯化后,送成都擎科生物技术有限公司进行序列测定。将测序结果在GenBank 上进行BLAST 比对。

表1 CyHV-2 扩增引物Table 1 CyHV-2 amplification primers
1.5 系统发育树构建
将测序结果通过NCBI 的BLAST 查找同源性序列,利用DNAMAN 进行序列编辑和比对分析,MEGA7.0 邻近法构建系统进化树进行分析。
1.6 组织病理损伤观察
分别取患病鲫的鳃、肝脏、脾脏、肾脏、心脏、肠、脑等组织器官,用10%的中性缓冲福尔马林固定液固定,水洗过夜,梯度酒精脱水,二甲苯透明,石蜡包埋,常规切片,苏木精-伊红(H.E)染色,中性树脂胶封片,光学显微镜下观察组织病理损伤,并拍照记录。
2 结果与分析
2.1 尸检与大体病理学观察
患病鲫鱼主要表现为尾鳍末端发白;鳃丝末端轻微腐烂,鳃丝颜色加深,出血样表现。打开腹腔后,可见少量带血腹水流出(图1)。寄生虫检查结果表明,鳃丝和体表黏液未见明显的寄生虫寄生。
2.2 细菌学检测
无菌条件下,从患病鱼的肝脏、脾脏接种细菌至LB 培养基,连续观察一周,未观察到细菌生长。

图1 患病鲫鱼临床特征Figure 1 Clinical characteristics of diseased crucian carp
2.3 PCR检测结果
提取患病鲫鱼的组织的DNA,进行PCR 扩增,经1.5%琼脂糖凝胶电泳,检测结果显示(图2),位于约370 bp 处均可见特异性DNA 扩增条带,与CyHV-2 预期大小相符,阴性对照泳道无明显条带。将测序结果在GenBank 上进行BLAST 比对,该序列与GenBank 中CyHV-2 基因有高度同源性,PCR检测结果显示患病鲫鱼为CyHV-2 阳性。
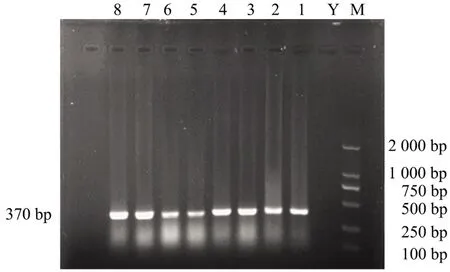
图2 PCR 检测结果Figure 2 PCR test results
2.4 系统发育树构建
将测序结果上传到NCBI-GenBank 获得基因登录号:NBK53701,通过MEGA 7.0 软件利用邻接法构建系统进化树(图3),结果显示,FJY 株与CyHV-2聚为一支。同源性分析表明,本试验所分离的病毒与CyHV-2 亚洲株有相对较高的核酸同源性,同源性达到80%。

图3 基于FJY 利用邻近法构建CyHV-2 进化树Figure 3 CyHV-2 phylogenetic tree constructed by proximity method based on FJY
2.5 病理组织学观察
经石蜡切片,H.E 染色后观察发现,该病靶器官主要为脾脏、鳃、肠道、肾脏、心脏和肝脏,所有鱼均表现为重度坏死性脾炎、重度出血性坏死性鳃炎、重度坏死性肠炎、中度至重度坏死性肾炎、中度坏死性心肌炎和心内膜炎、轻度至中度脂肪肝和轻度坏死性肝胰腺炎,其余组织未发现明显病变。
脾脏:表现为重度坏死性脾炎。低倍下可观察到脾脏严重的充血,淋巴细胞减少(图4A);脾实质中可见桥状相连的坏死灶,伴有有大量的炎性细胞浸润(图4B);脾血管系统受损严重,椭圆体壁及血窦内皮细胞严重坏死、淡染、空泡化,可见部分细胞缩小,染色质固缩、崩解成大小不等的团块(图4C)。
鳃:鳃表现为重度出血性坏死性鳃炎。低倍下可观察到大面积鳃丝出血(图4D);高倍下可见鳃小片坏死、脱落中(图4E);鳃丝间有脱落堆积的红细胞和炎性细胞(图4F)。
肠道:肠道表现为重度坏死性肠炎。肠道黏膜下层和固有层内可见大量炎性细胞浸润(图4G);黏膜下层及固有层内毛细血管充血,大量红细胞充盈(图4H);严重的可见肠绒毛顶端上皮细胞大量坏死脱落,固有层明显裸露,内可见严重充血的毛细血管(图4I)。
肾脏:肾脏表现为中度至重度坏死性肾炎。肾小管上皮细胞缩小,胞浆浓缩、红染,上皮细胞脱落,与基膜分离,部分消失(图4J);肾间质排列紊乱,细胞稀疏,间质内毛细血管内皮细胞造血母细胞染色质浓缩、坏死、崩解成大小不等的团块(图4K)。肾球囊扩张,可见肾小球内毛细血管内皮细胞坏死,细胞核浓缩、崩解(图4L)。
心脏:心脏表现为中度坏死性心肌炎和中度心内膜炎。心内膜内皮细胞坏死,细胞体积缩小,染色质浓缩、消失,心肌纤维横纹消失,染色不均(图4M);部分心肌细胞核大量减少,呈指环样变,偶尔可见心肌纤维内白细胞浸润,心肌纤维胞浆消失,将白细胞包裹在内,部分区域心肌纤维呈小灶样坏死,纤维溶解消失,被大量炎性细胞浸润取代(图4N)。
头肾:头肾为轻度炎症。低倍下可观察到头肾轻微的充血和少量的炎性细胞(图4O)。
肝胰脏:肝脏表现为轻度至中度脂肪肝和轻度坏死性肝胰腺炎。肝血窦大面积淤血(图4P),肝细胞肿胀,脂肪变性,部分细胞坏死、溶解,肝血窦内可见炎性细胞(图4Q)。胰腺细胞轻度坏死(图4R)。
3 讨论与结论
CyHV-2 是危害鲫鱼健康的一种常见病毒,可使机体处于缺氧、营养不足、废物积累的内环境状态,加剧主要的器官组织的损伤,造成鲫鱼大量死亡。本研究发现,感染CyHV-2 后,鲫鱼出现尾鳍末端发白,鳃出血,解剖后腹腔有少量红色腹水等症状。经组织病理学观察发现患病鱼表现为明显的重度坏死性脾炎、中度至重度出血性坏死性鳃炎、重度坏死性肠炎、中度至重度坏死性肾炎、中度坏死性心肌炎和心内膜炎、轻度至中度脂肪肝和轻度坏死性肝胰腺炎,说明脾脏、鳃、肠道、中肾、心脏是其主要靶器官,对肝脏和头肾亦有轻微损伤。2016年林秀秀等[13-14]亦发现感染CyHV-2 的鲫鱼在头肾、脾脏、肠道、肝胰腺、鳃中均出现明显的病理损伤,而本研究进一步明确了鲫鱼感染CyHV-2 后的主要病理靶器官及病变程度,为临床上相关疾病的研究提供了参考。
聚合酶链式反应(PCR)是检测CyHV-2 感染较为常用且精准的方法,可以检测到组织中极微量的病毒DNA[15]。本研究参照T.B.Waltzek[16]的检测方法,该方法能够有效地检测出不同地方的CyHV-2分离株,最终发现本次发病的鲫鱼为CyHV-2 阳性。目前,还有更多的检测方法用于CyHV-2 检测。A.E.Goodwin 等[17]建立了实时定量PCR,此方法特异性强,免疫性高,不仅能在表现临床症状的鱼中检测出CyHV-2 病毒,还可以检测出处于潜伏期的病鱼。He J.等[18]建立环介导等温扩增来检测CyHV-2,证实该方法比传统的PCR 和实时PCR 灵敏度更高。CyHV-2 检测技术仍在发展,未来还有很多更快更好的方法会创造出来,能够在生产一线发挥更大的作用。
CyHV-2 在鱼体内形成潜在的感染源。该病毒的暴发与温度有很大关系,潜伏感染的病毒在温度不适宜时长期潜伏在鱼体内,表现与正常鱼无任何差异。但是当养殖水温升高到22 ℃时,潜伏在鱼体内的病毒被激活,导致宿主开始发病并造成疾病的传播,引起鱼群的大量死亡[19]。因此在春夏季水温升高时,要注意养殖鲫鱼的生长情况,经常打样检测,一旦发现有疑似感染CyHV-2 的症状要及时检测并处理,避免大量暴发造成损失。另外2009年A.E.Goodwind 等[20]证实了CyHV-2 也可垂直传播,因此在养殖过程中需要严格选择亲鱼,并加强对亲鱼场、苗种场的管理。目前,国内外对CyHV-2 携带者的处理尚未有明确的要求和相关的参考,因此当在亲鱼和鱼苗中一旦发现CyHV-2 携带者,必须及时淘汰,避免造成更大的损失。由于我国对于疱疹病毒的研究还处于起步阶段,对于该病的治疗目前尚无特效药。张琳琳等[21]对CyHV-2 灭活疫苗进行相关研究,发现注射疫苗后相对免疫保护力有一定上升,并降低了感染CyHV-2 的异育银鲫死亡率,因此应尽快研制该病毒的灭活疫苗,从源头上控制该病。
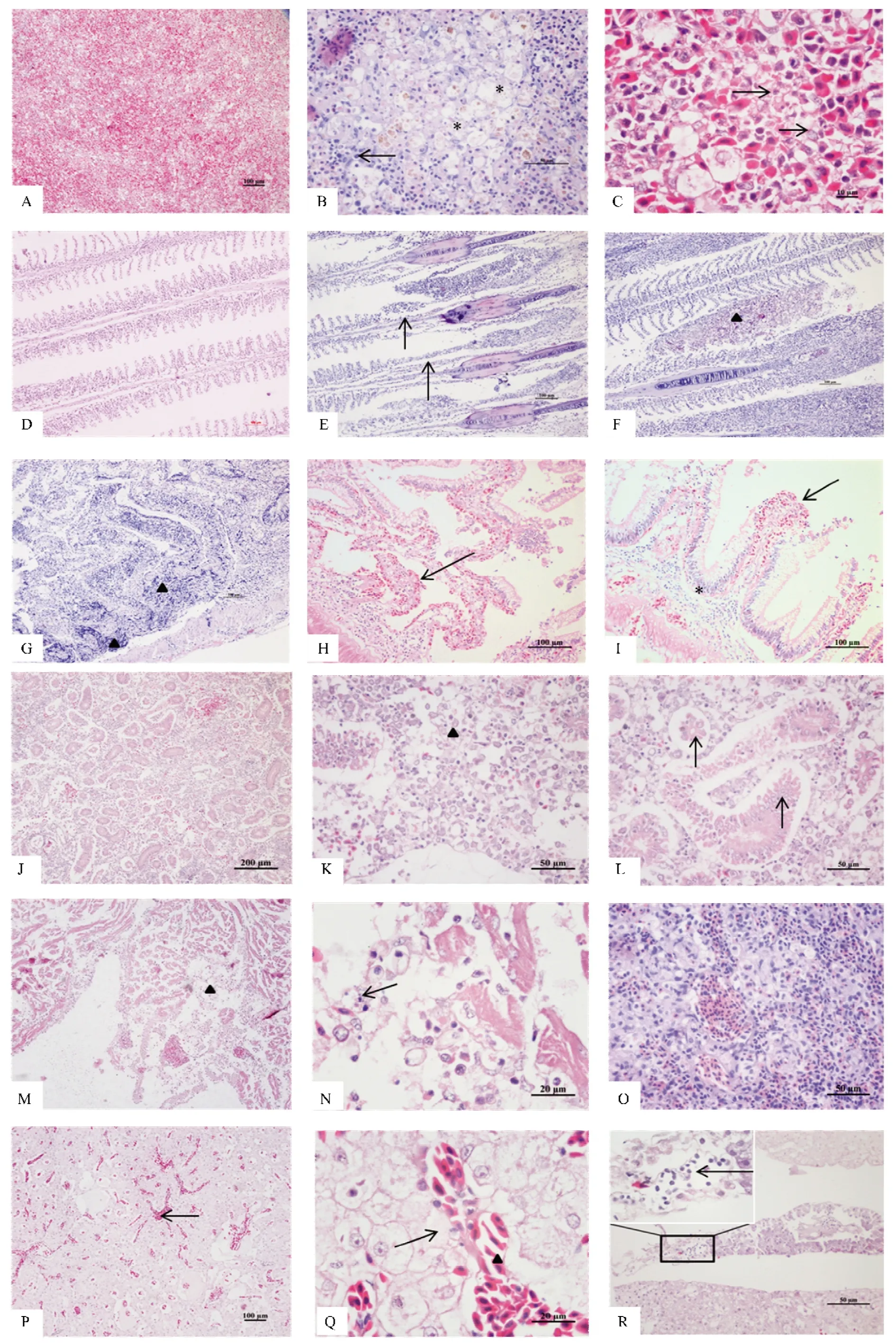
图4 患病鲫组织病理学表现Figure 4 Histopathological manifestations of diseased crucian carp

