抗草甘膦与磷高效吸收基因双价表达载体的构建及对甘蓝型油菜的遗传转化
王朋宝,张晶晶,石菁,王威,曹智,张金文
(1.甘肃省作物遗传改良与种质创新重点实验室,甘肃省干旱生境作物学重点实验室,甘肃农业大学农学院,甘肃 兰州 730070;2.甘肃农业大学资源与环境学院,甘肃 兰州 730070)
油菜(Brassicanapus)属十字花科(Cruciferae)芸薹属(Brassica),是产油效率较高的油料作物,菜籽油产量占到我国油料作物总产油量的一半以上.栽培油菜主要分为白菜型、芥菜型和甘蓝型3种,其中甘蓝型油菜是全世界种植面积最广,产量最大的油菜类型[1].它的籽粒中含有相当丰富的脂肪酸和蛋白质,生长过程需要大量的磷素供给,其供应正常与否对油菜的生长发育以及最终产量和品质都有很大影响[2,3].若磷素缺乏会导致其品质降低,产量大幅下降.前人研究发现,土壤中有效磷的含量越高,油菜各个器官中的含磷量也就越高,并且茎与叶的含磷量始终大于根[4].但是土壤中的有效磷含量非常低,大约在0.02%~0.2%之间[5],绝大多数磷素都以有机态植酸形式存在,需要经过一系列转化才能被作物直接吸收利用.农业生产中,杂草防治也是一项亟待解决的问题.杂草造成的直接经济损失巨大,大约可以占到农作物总产值的1/5[6].我国50%~90%的油菜易发生草害,常年造成减产15%~20%,因此,防治草害对油菜生产有十分重要的意义[7].随着社会经济不断发展,农业劳动力数量急剧下降及成本不断上涨,致使传统的人工除草已不能合理的跟上生产步伐,高效除草方法已经成为迫切需求.抗除草剂作物俨然是一种较佳选择.张瑜等[8]成功从抗草甘膦油菜DNA中扩增得到EPSPS基因,以期用于油用亚麻抗除草剂的研究.May等[9]将CP4EPSPS基因导入‘珂字棉312’,验证发现转化植株产生了草甘膦抗性.万丽丽等[10]构建了PCAMBIA-GOX-CP4EPSP植物双元表达载体,利用农杆菌介导的遗传转化方法转化甘蓝型油菜并获得转基因植株,该转基因株系可在喷施400倍农达的条件下存活.Mudge等[11]将植酸酶基因转入拟南芥中,结果表明转基因植株的磷素吸收效率和植物生物量显著高于野生型.Hong等[12]用甘薯的贮藏蛋白启动子在马铃薯中超表达具有酸性磷酸酶和植酸酶活性的基因,获得的转基因马铃薯植株可在以植酸作为唯一磷源时增加对磷的吸收.因此为同时解决甘蓝型油菜生长过程中的草害及有效磷匮乏问题,本试验构建了含有草甘膦抗性基因和植酸酶基因的双价植物表达载体,并利用农杆菌介导法转化甘蓝型油菜,以期得到高效磷素吸收利用兼有草甘膦抗性的甘蓝型油菜新材料,并为甘蓝型油菜种质创新提供相关理论依据.
1 材料与方法
1.1 植物材料
试验所用植物材料均为本实验室保存的甘蓝型油菜,主要包括新疆农科院自育自交系(‘新疆21109’)、‘陇油10号’恢复系C20(‘陇上东’)和‘青杂5号’恢复系(‘1831R’).
1.2 质粒和主要试剂
质粒pMD-nos(含nos终止子)、根癌农杆菌LBA4404(Agrobacterium tumefaciens LBA4404)以及植物表达载体pCEPSP(本实验室用草甘膦抗性基因(EPSPS)替换pCMBIA1300中的潮霉素抗性基因(hyg)所得)均由甘肃农业大学省部共建干旱生境作物学重点实验室植物代谢功能基因组学实验室保存;质粒pTOPO-EPSPS(含CP4EPSPS基因)由甘肃省农科院张建平研究员馈赠,质粒PGA1611-E-PhpAO(含phyA基因)由中国农业科学院生物技术研究所陈茹梅研究员馈赠.PCR及qRT-PCR引物合成及DNA序列测定由苏州金唯智生物科技(苏州)有限公司完成;限制性内切酶、普通琼脂糖凝胶DNA回收纯化试剂盒均购自北京全式金生物(北京)技术有限公司;普通测序载体pMD19-T、T4 DNA连接酶、标准DNA Marker和高保真DNA酶(PrimeSTAR HSRDNA Ploy-merase)均购自;其他药品试剂均是进口或国产分析纯.
1.3 rbcS的生物信息学分析
登录网站GenBank(https://www.ncbi.nlm.nih.gov/genbank/),检索油菜Rubisco小亚基(rbcS)序列(ID:X07367.1).通过CBS Predition servers(http://www.cbs.dtu.dk/services)中的TargetP 1.1 Server和ChloroP 1.1 Server预测其亚细胞定位、编码氨基酸序列中的转运肽及其剪切位点.
1.4 引物设计
根据表达载体的酶切位点,并参照nos基因序列(ID:AF485783)、eCTP基因序列(ID:X07367.1)、EPSPS基因序列(ID:KJ701603.1)、Pht1;2基因序列(ID:AT5G43370)、phyA基因序列(ID:AF353576.1)和Actin2.1基因序列(ID:FJ529167.1),采用Oligo7设计PCR扩增引物和qRT-PCR引物.
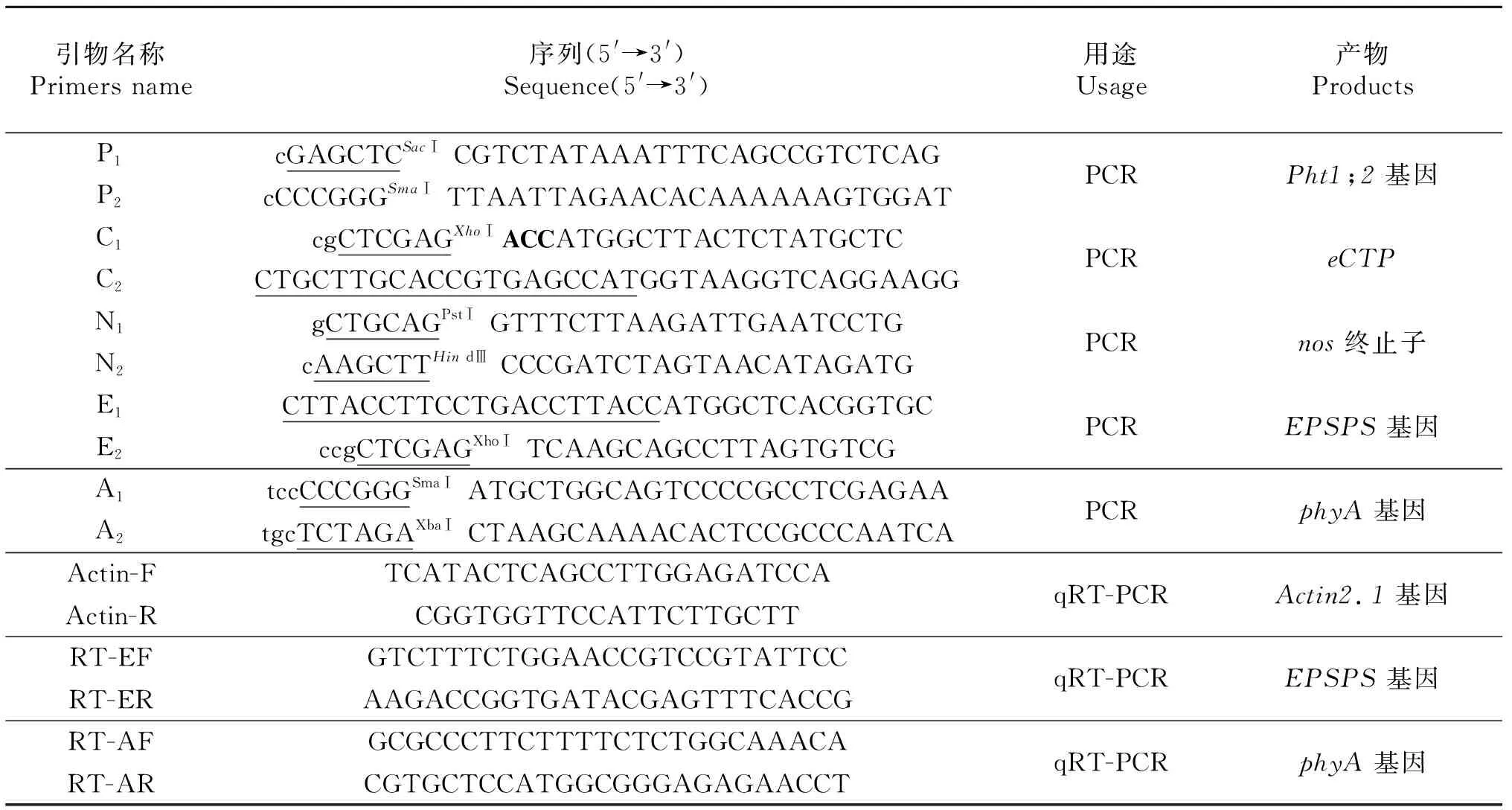
表1 引物序列
小写部分为保护碱基,短下划线部分为酶切位点,加粗部分为kozka序列,长下划线互为重叠部分.
The lower case is the protectived base,the short underlined parts are the cleavage site,the bold part is the kozka sequence,and the long underline are the overlapping parts.
1.5 目的基因克隆
以质粒pMD-nos为模板,采用特异性引物对N1/N2亚克隆nos终止子;以甘蓝型油菜RG2 cDNA为模板,采用特异性引物对C1/C2克隆叶绿体转运肽eCTP;以质粒pTOPO-EPSPS为模板,采用特异性引物对E1/E2亚克隆EPSPS基因;以提取的野生型拟南芥DNA为模板,采用特异性引物对P1/P2克隆根特异性启动子Pht1;2;以质粒PGA1611-E-PhpAO为模板,采用特异性引物对A1/A2亚克隆phyA基因;以回收的EPSPS基因和eCTP为模板,采用特异性引物对C1/E2,运用重叠PCR方法扩增融合片段L;利用凝胶回收试剂盒回收PCR扩增产物,分别与pMD19-T连接,送至江苏金唯智生物公司进行测序,分别将含有目的片段的正确重组子命名为pMD-nos、pMD-eCTP、pMD-EPSPS、pMD-Pht1;2、pMD-phyA、pMD-L.
1.6 植物表达载体构建
采用酶切连接的方法,依次在基础载体pCEPSP中插入nos终止子、融合片段L、根特异性启动子Pht1;2及植酸酶基因phyA,最终构建获得了植物重组表达载体pC-NLTA(图1),并利用冻融转化法将其整合到农杆菌LBA4404中,提取阳性菌落质粒,用特异性引物对P1/P2、C1/E2、A1/A2进行PCR鉴定,将阳性农杆菌工程菌保存,用于后续遗传转化.
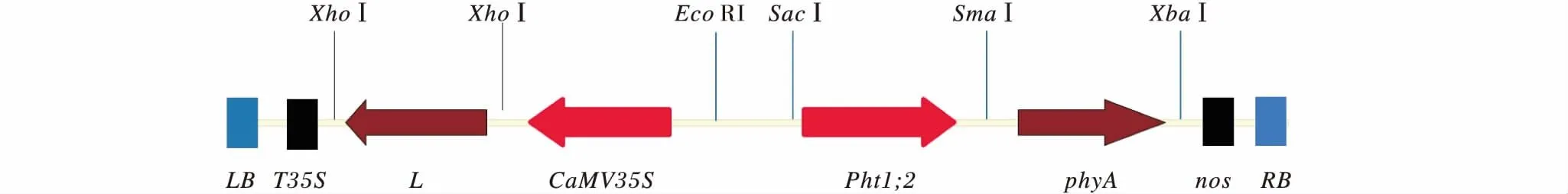
图1 表达载体示意图Figure 1 Schematic representation of expression vectors
1.7 农杆菌介导的甘蓝型油菜遗传转化及鉴定
以甘蓝型油菜品种‘新疆21109’、‘陇上东’和‘1831R’无菌苗茎段为受体材料进行侵染.首先截取长约5~7 mm的无腋芽茎段,置于培养基上预培养2 d;使用培养至对数生长期(D600=0.5)的农杆菌工程菌侵染5~8 min后,擦干外植体外部多余菌液,接种到共培培养基上暗培养2 d;随后接种至脱菌培养基进行愈伤组织诱导和脱菌;4周后转入分化培养基促进分化,3周后转接至筛选培养基继续诱导分化出芽;当芽长约2 cm时,切下转入生根培养基诱导生根.最后,对成活的抗性植株进行分子检测.试验所用不同培养基的成分及配比见表2.
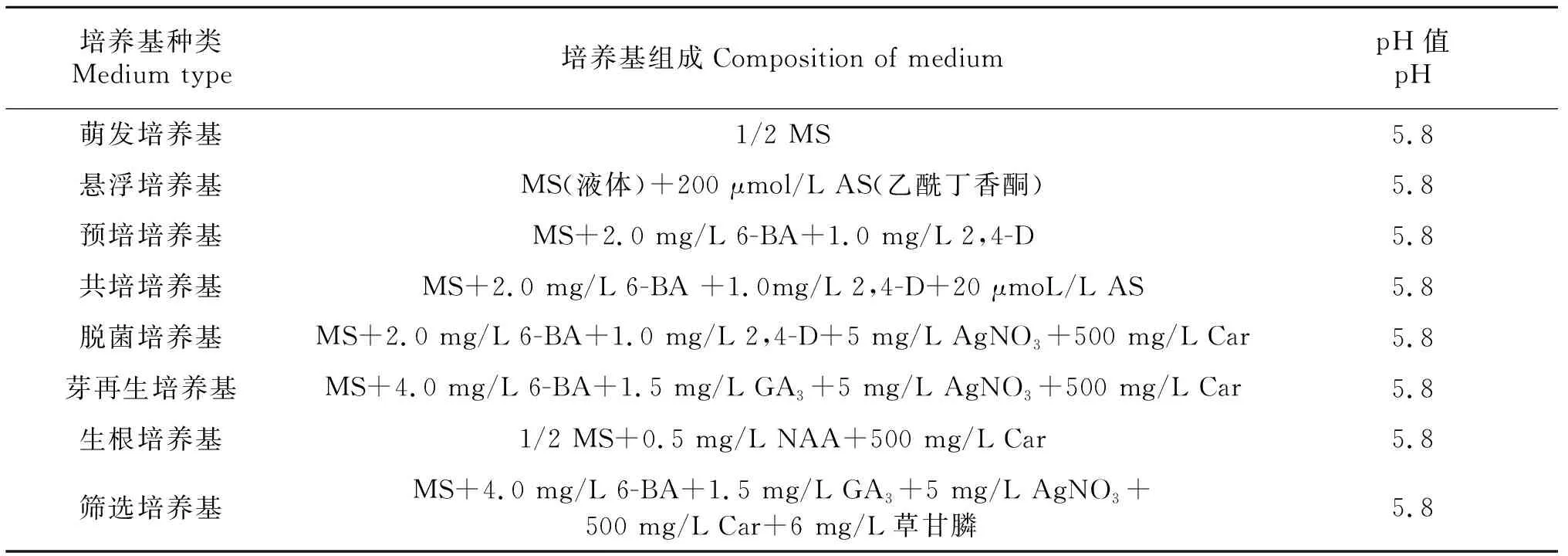
表2 甘蓝型油菜遗传转化培养基
1.8 转基因植株靶标基因转录水平检测
采用实时定量PCR(qRT-PCR)检测转基因阳性植株中植酸酶基因phyA和草甘膦抗性基因EPSPS的表达.采用TRIzol法提取转基因植株总RNA,用QuantScript RT Kit cDNA试剂盒合成cDNA第1链,将cDNA样品稀释8倍作为模板上机检测,以油菜Actin2.1为内参基因(ID:FJ529167.1),设3次重复,应用公式2-ΔΔCt计算在样本处理前后的相对表达量,ΔΔCt=(ΔCt处理样品-ΔCtActin2.1)-(ΔCt对照样品-ΔCtActin2.1)[13].
2 结果与分析
2.1 rbcS的生物信息学分析结果
TargetP 1.1 Server分析结果见表3,结果显示rbcS序列共编码181个氨基酸,cTP、mTP、SP及other分数分别为0.737、0036、0.249和0.068.预测定位在叶绿体,可信程度为3,前序长度可能为54个氨基酸长度.ChloroP 1.1 Server分析结果见表4,结果显示rbcS序列共编码181个氨基酸,第二步网络的输出分数0.581,预测序列中含有转运肽cTP,且建议切割位点评分为6.923,cTP长度为54个氨基酸长度.在此基础上,再结合NCBI注释,本试验采用rbcSN端的77个氨基酸编码序列为候选片段,碱基长度共231 bp,将其命名为eCTP.
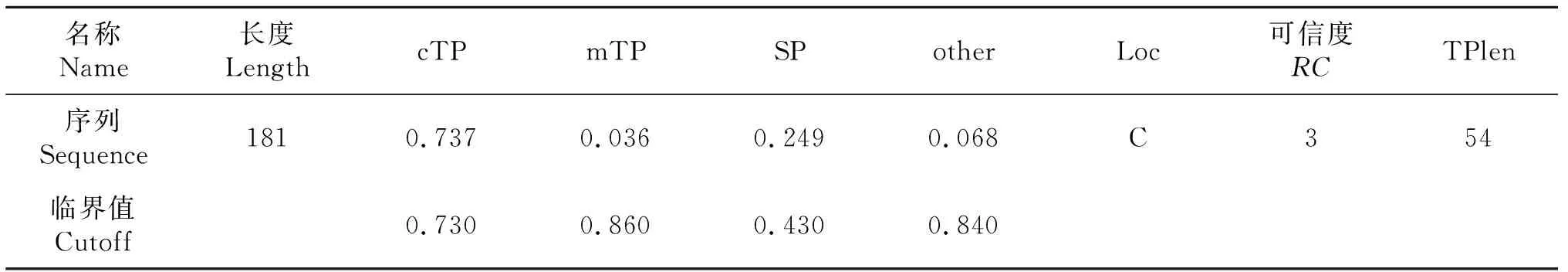
表3 TargetP 1.1 Server分析结果

表4 ChloroP 1.1 Server分析结果
2.2 目的基因的克隆
分别以质粒pMD-nos、pTOPO-EPSPS和PGA1611-E-PhpAO为模板,特异性引物对N1/N2、E1/E2和A1/A2亚克隆得到了nos终止子(图2-A)、EPSPS基因(图2-C)和phyA基因(图2-F);分别以野生型拟南芥的DNA和甘蓝型油菜RG2 cDNA为模板,特异性引物对P1/P2和C1/C2克隆得到了根特异性启动子Pht1;2(图2-E)和叶绿体转运肽eCTP(图2-B);以回收的EPSPS基因和eCTP为模板,采用特异性引物对C1/E2,运用重叠PCR方法,得到了融合片段L(图2-D);以上各基因扩增片段大小均与预期相符,测序结果显示与GenBank中注册序列同源性较高.
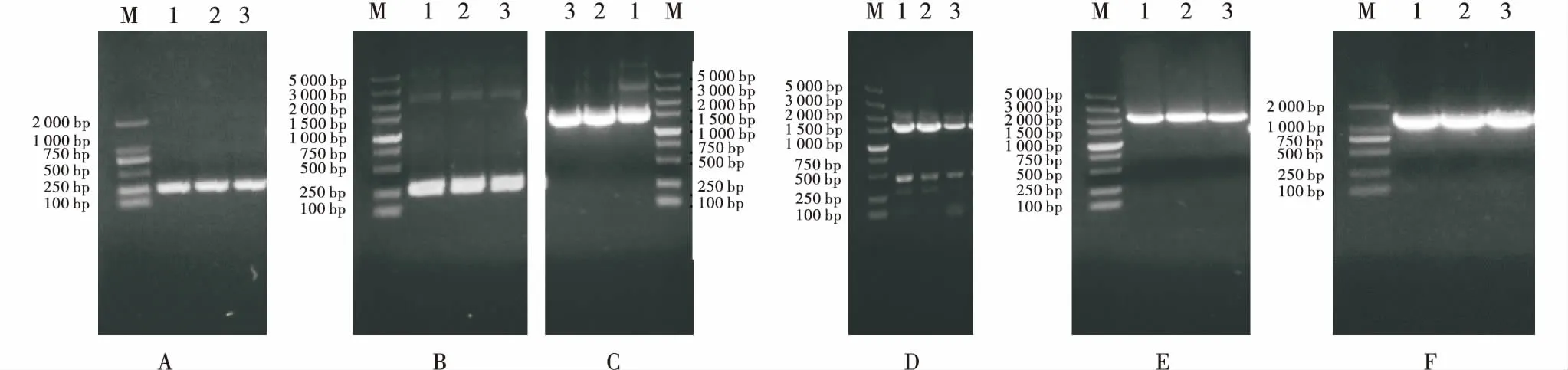
M:DNA Marker;A/B/C/D/E/F-1、2、3:PCR产物M:DNA Marker;A/B/C/D/E/F-1,2,3:PCR products图2 PCR扩增产物Figure 2 PCR amplification products
2.3 植物表达载体构建
利用凝胶回收试剂盒回收PCR扩增产物,分别与pMD19-T连接,转化DH5α感受态,挑菌抽提质粒,送至江苏金唯智生物公司进行测序,分别将含有正确目的片段的重组子命名为pMD-NOS、pMD-eCTP、pMD-EPSPS、pMD-L、pMD-Pht1;2和pMD-phyA,再经PstⅠ和HindⅢ(图3-A)、KpnⅠ和PstⅠ(图3-B)、SacⅠ和HindⅢ(图3-C)、XhoⅠ(图3-D)、SacⅠ和SmaⅠ(图3-E)、SmaⅠ和XbaⅠ(图3-F)等限制性内切酶酶切后得到的片段大小与预期结果相符.
用HindⅢ和PstⅠ同时酶切pMD-NOS和载体pCEPSP,用T4连接酶连接,得到载体命名为pC-N,用HindⅢ和PstⅠ双酶切检测(图4-A),证明成功构建载体pC-N;用XhoⅠ同时酶切pMD-L和载体pC-N,回收目的条带,用T4连接酶连接,得到载体命名为pC-NL,用XhoⅠ酶切检测(图4-B),结果表明已成功构建载体pC-NL.用SacⅠ和SmaⅠ同时酶切pMD-Pht1;2和载体pC-NL,回收目的条带,用T4连接酶连接,得到载体命名为pC-NLT,用SacⅠ和SmaⅠ双酶切检测(图4-C),证明成功构建了载体pC-NLT.用SmaⅠ和XbaⅠ同时酶切pMD-phyA和载体pC-NLT,回收目的条带,用T4连接酶连接,得到载体命名为pC-NLTA,用SmaⅠ和XbaⅠ双酶切检测(图4-D),证明成功构建了pC-NLTA载体.

M:DNA Marker;A-1,2/B-1,2/C-1,2/D-1/E-1,2,3,4/F-1,2:酶切产物.M:DNA Marker;A-1,2/B-1,2/C-1,2/D-1/E-1,2,3,4/F-1,2:Restriction products.图3 重组子双酶切验证Figure 3 Recombinant double enzyme digestion verification
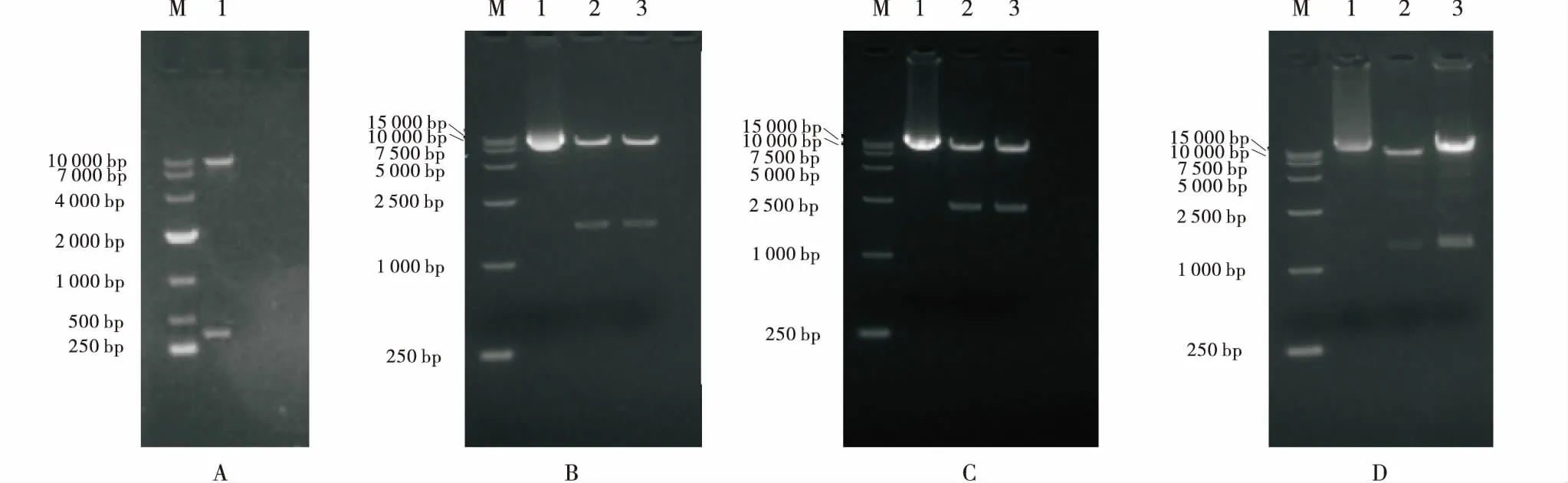
M:DNA Marker;A-1:酶切产物;B-1/C-1/D-1:载体质粒;B-2、3/C-2、3/D-2、3:酶切产物.M:DNA Marker;A-1:digested product;B-1/C-1/D-1:vector plasmid;B-2,3/C-2,3/D-2,3:digested product.图4 表达载体酶切验证Figure 4 Expression vector digested verification
2.4 农杆菌工程菌的制备及鉴定
将表达载体pC-NTLA转入农杆菌菌株LBA4404感受态细胞.提取质粒并用引物P1/P2、C1/E2和A1/A2进行PCR鉴定,目标条带大小与预期一致,证明目标载体已成功转入农杆菌.
2.5 甘蓝型油菜转化再生苗的获得
用农杆菌介导法对3个甘蓝型油菜品种进行遗传转化(图5),经草甘膦筛选,共获得了共45株再生苗(‘1831R’ 20株;‘新疆21109’14株;‘陇上东’11株).提取再生植株的叶片DNA,以E1/E2引物对进行PCR扩增检测,其中共有5株(‘1831R’2株;‘新疆21109’2株;‘陇上东’1株)能得到大小分别约为1 300 bp的特异片段,野生型植株则未出现(图6),说明外源基因已重组到转化植株的DNA中.
2.6 转基因植株靶标基因转录水平检测
2.6.1 转基因植株EPSPS基因转录水平检测 在转化植株中(图7),与对照(CK)相比,EPSPS基因的相对表达水平有显著性差异,其相对表达量均呈显著上调趋势,在不同的株系中,上调水平有所不同,在‘1831R’中,EPSPS基因的表达水平分别为对照的2.0和2.1倍左右.‘陇上东’中,EPSPS基因的相对表达量为对照的1.9倍左右.‘新疆21109’中,EPSPS基因的相对表达量分别为对照的2.1和2.2倍左右.由此说明,外源EPSPS基因已经在转化植株中成功表达.

A:预培养;B:农杆菌侵染及共培养;C:诱导的愈伤组织及草甘膦筛选;D:分化芽;E:生根诱导.A:pre-cultivation;B:agrobacterium infection and co-culture;C:induced callus and glyphosate screening;D:shoot regeneration;E:rootage induction.图5 甘蓝型油菜遗传转化过程Figure 5 Genetic transformation of Brassica napus
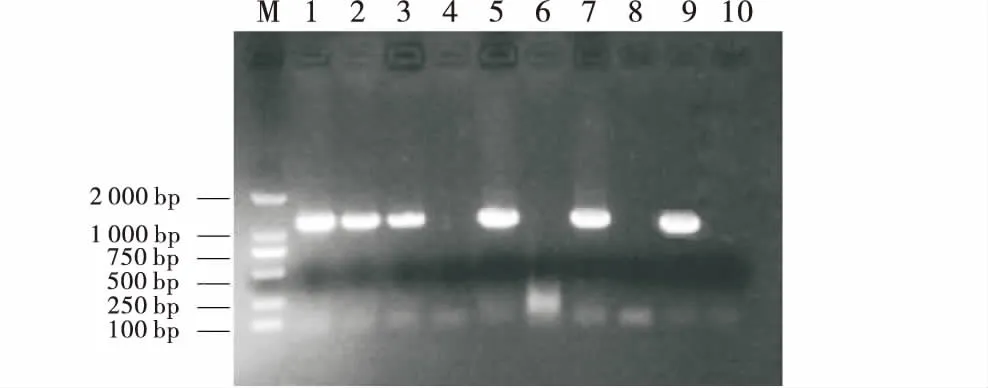
M:DNA Marker;1、2、3、4、5、6、7:转基因阳性植株DNA的PCR检测(EPSPS基因);8:非转基因植株DNA的PCR检测;9:阳性对照(质粒pTOPO-EPSPS);10:空白对照(水).M:DNA Marker;1,2,3,4,5,6,7:PCR detection of transgenic positive plant DNA (EPSPS gene);8:PCR detection of non-transgenic plant DNA;9:positive control (plasmid pTOPO-EPSPS);10:Blank control (water).图6 转基因阳性植株的PCR鉴定Figure 6 PCR identification of transgenic positive plants
2.6.2 转基因植株phyA基因转录水平检测 在转化植株中(图8),与对照(CK)相比,phyA基因的相对表达量均呈显著上调趋势,在不同的株系中,上调水平有所不同,在‘1831R’中,phyA基因的表达水平分别为对照的1.67和1.49倍左右.‘陇上东’中,phyA基因的相对表达量为对照的1.76倍左右.‘新疆21109’中,phyA基因的相对表达量分别为对照的1.69和1.75倍左右.由此说明,外源phyA基因已经在转化植株中成功表达.
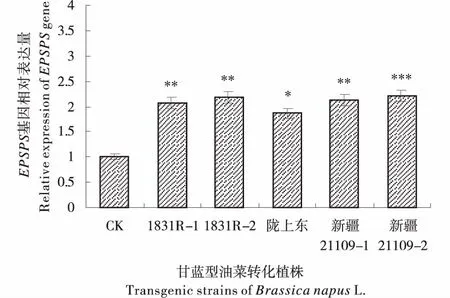
*代表差异显著或极显著(*P<0.05、**P<0.01或***P<0.001).Asterisks indicate significent difference or extreme significent difference(*P<0.05、**P<0.01或***P<0.001),Error bars indicate SD of three biological replicates eachwith three technical replicates.图7 EPSPS基因在甘蓝型油菜转基因株系中的相对表达量Figure 7 Relative expression of EPSPS gene in transgenic strains of Brassica napus L.
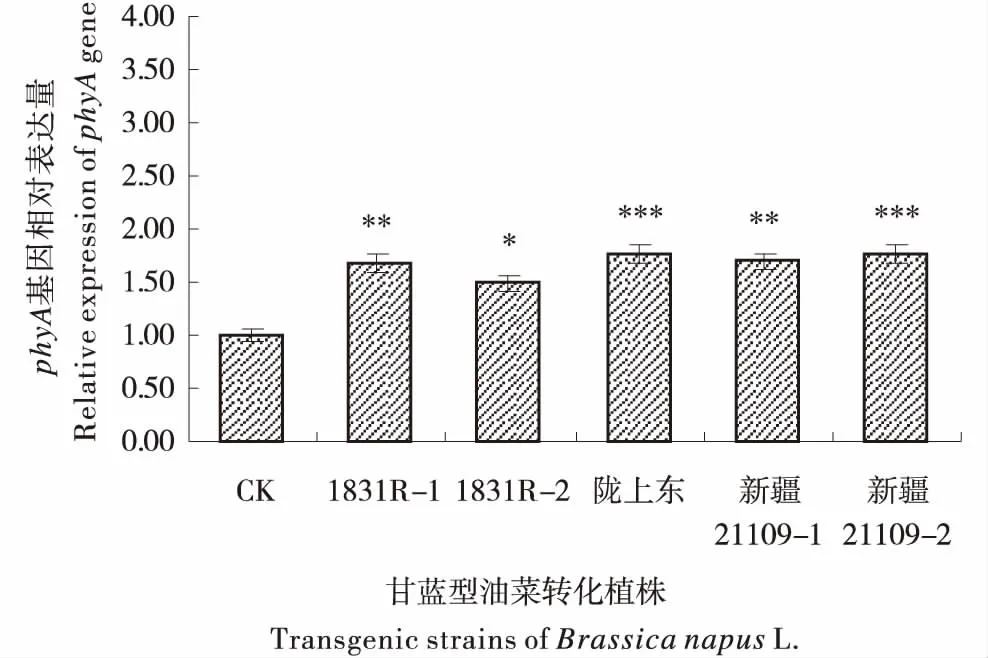
*代表差异显著或极显著(*P<0.05、**P<0.01或***P<0.001).Asterisks indicate significent difference or extreme significent difference(*P<0.05、**P<0.01或***P<0.001),Error bars indicate SD of three biological replicates eachwith three technical replicates.图8 phyA基因在甘蓝型油菜转基因株系中的相对表达量Figure 8 Relative expression of phyA gene in transgenic strains of Brassica napus L.
3 讨论
Klein等[14]在研究拟南芥和矮牵牛花EPSPS的叶绿体转运肽时发现,它们都能将异源的EPSPS蛋白定位到叶绿体中.随着基因工程技术发展突飞猛进,现在已经可以将叶绿体转运肽与抗草甘膦的EPSPS基因融合,使其在植物中表达草甘膦抗性[15].鉴于转运肽对EPSP合成酶前体进入叶绿体至关重要,所以本试验运用生物学信息软件分析并克隆了油菜叶绿体转运肽eCTP,使之与来自CP4菌株的EPSPS基因融合,构建了含有融合基因的植物表达载体并转化甘蓝型油菜,以期获得草甘膦抗性基因超表达的甘蓝型油菜品种.而qRT-PCR结果显示,EPSPS基因均在阳性植株中表达并较CK显著上调了1.9~2.2倍.但是转基因植株对草甘膦浓度的适应能力还需在后续试验中进行验证,检验阳性植株是否具有较高的草甘膦抗性.
为了提高作物对土壤中有机态磷的吸收利用,促进磷素资源的可持续利用,本试验构建了由植物PHT1磷转运蛋白家族中的AtPht1;2启动子来驱动植酸酶基因表达的植物表达载体,通过农杆菌介导法来转化甘蓝型油菜,获得转基因阳性植株.qRT-PCR结果显示,阳性植株与对照(CK)相比,phyA基因的相对表达量显著上调了1.49~1.76倍.初步证明phyA基因已在转基因阳性植株中表达,Richardson等[16]构建了由根毛特异性启动子来驱动融合有信号肽的黑曲霉植酸酶基因phyA的表达载体,并将其转入拟南芥中,结果发现转基因植株中植酸酶会在信号肽的引导下被分泌到根外.在仅有植酸盐为磷源的条件下,植株分泌的植酸酶会分解植酸盐,释放无机态磷(Pi),供植株吸收利用.方小平等[17]将植酸酶基因转入油菜品种‘中双6号’中,结果发现转基因植株能有效表达植酸酶基因,并且其能以植酸为唯一磷源正常生长,而非转基因植株则不能.前人这些研究都与本试验结果一致,但由于植酸酶活性受温度、土壤pH等外界因素影响较大,仍需通过后续检验以确定植酸酶对于作物磷素高效吸收利用的影响.
本试验中存在一定的不足之处,主要体现在假阳性较高和转化效率较低两方面,这导致后续试验不能如期进行.油菜转基因过程中,筛选剂的浓度至关重要,它影响着油菓转化效率,过高的筛选剂浓度得不到足够的转化体个数,过低的筛选剂浓度会产生大量假阳性植株而起不到应有的筛选效果,后期工作量很大[18].本试验假阳性较高可能是由于筛选剂(草甘膦)浓度较低或者筛选时间较短引起.后续实验中可以通过增加筛选剂浓度或延长筛选时间来降低假阳性高的问题.关于转化效率低的问题,回顾试验,发现问题可能存在于预培养及侵染液浓度和侵染时间.关于预培养的问题,许本波等[19]在研究中发现甘蓝型黄籽油菜下胚轴的再生频率,受预培养激素浓度的影响较大,下胚轴在转入分化培养之前先进行一段时间的预培养,有利于提高分化效率,预培养最佳培养基为MS+0.1 mg/L 6-BA+1.5 mg/L 2,4-D.而本试验所用预培养培养基为MS+2.0 mg/L 6-BA+1.0 mg/L 2,4-D,这可能影响到下胚轴的分化效率.王景雪等[20]也认为同一品种,在不同的激素组合培养基上,油菜下胚轴分化频率会有很大差异.农杆菌的侵染浓度以及时间对于转化过程也是十分重要的,刘品等[21]在‘中油821’外植体分化研究中发现农杆菌浓度D600=0.4时,侵染5 min的外植体分化率最高.而本试验采用的农杆菌工程菌浓度D600=0.5,侵染时间为10 min,这可能导致外植体愈伤效率下降,影响最终的转化率.后续试验中为达到高转化率,需进行相应调整,筛选出适应于本试验的高效转化体系.
4 结论
综上所述,本研究通过构建双价基因表达载体并成功转化甘蓝型油菜,使其同时具有草甘膦抗性和高效磷素吸收利用的能力,为今后培育磷高效吸收利用兼具有草甘膦抗性的优良甘蓝型油菜新品种奠定基础.

