热激对大花蕙兰褐变总酚及相关酶活性的影响
葛 坤,方 岩,王智慧,杨 旭,薛 斌
(太原学院园林科研所,山西太原030024)
大花蕙兰因植株挺拔,花姿秀美,花色艳丽而备受人们喜爱。植物组培技术作为大花蕙兰一种主要的繁殖方式,已日渐成熟,但褐变问题在大花蕙兰组培过程中普遍存在,这不仅制约了原球茎诱导愈伤组织分化,严重时会导致外植体死亡,大大降低了大花蕙兰组培的增殖率[1]。郑迎冬等[2]以大花蕙兰幼嫩茎段为外植体,原球茎的诱导率很低,仅为30%。陈建科等[3]用幼嫩叶片作为组培外植体,并在培养基中增加了无机盐浓度来抑制褐变。
最新研究表明,对叶片外植体进行热激处理、水杨酸处理等可降低褐变程度[4]。大多数研究人员将热激处理可降低组培褐变归因于热激处理抑制了PAL活性,PAL是酚类物质合成的关键酶,故热激处理使得酚类物质大大减少[5]。杨谷良等[6]通过对宝华甜柿叶片外植体进行热激处理,降低了褐变率。杨玲等[7]分析了热激处理对蝴蝶兰组培褐变的影响,并通过正交试验筛选了适宜的热激处理条件。
本研究以大花蕙兰组培瓶苗为试材,比较热激处理与未热激处理的叶片外植体褐变程度,通过分析热激处理对总酚合成及PAL、PPO、POD活性的影响,以揭示热激处理对大花蕙兰组培褐变有效抑制的生理机制,为大花蕙兰组培繁殖的生产提供依据。
1 材料和方法
1.1 试验材料
试验材料为北京园林科研所培养的大花蕙兰瓶苗,该瓶苗已进行生根培养6个月,培养基为1/2 MS+IBA0.5 mg/L+活性炭1.0 g/L,pH值为5.7。
1.2 试验方法
将部分已生根未褐变的瓶苗进行45℃热激处理,即在电热恒温鼓风干燥箱中加热至瓶内温度达到45℃时停止,处理时间因各实验室温度不同而有差异。选择已热激处理及未经处理(CK)的瓶苗各100瓶,叶片切割为0.8 cm×0.8 cm,接种于MS+6-BA 5.0 mg/L(pH值5.6~5.8)培养基上进行增殖继代培养,接种前经热激处理的瓶苗于自然光照培养架上恢复5~6 h。每瓶接种3个外植体,温度25℃,光照2 000~3 000 lx,光照时间12 h/d。接种后第0,3,6,9天进行取样,用蒸馏水将样品培养基冲洗干净后用滤纸擦干,放入干燥预冷研钵中,并迅速倒入液氮冷冻,研磨成粉末封袋,保存于-80℃低温冰箱内,待测生理指标,取样需重复3次。
1.3 测定指标及方法
1.3.1 总酚含量测定 采用Folin-Ciocalteu法,参考文献[8]的测试法。称取样品2.0 g,置于圆底烧瓶,用甲醇定容至50mL。超声振荡30min后静置24h。用50 mL 50%甲醇加热回流1 h,抽滤,将滤渣加入50 mL 50%甲醇再次回流1 h,抽滤,将2次滤液合并定容至50 mL。移液管吸取没食子酸0.2 mL,加入1.0 mL磷钼酸试剂,后加入15 mL5%碳酸钠溶液,搅拌30 min后,在波长765 nm处比色测定OD值。以没食子酸浓度为横坐标、吸光度为纵坐标,建立标准曲线。将样品替代没食子酸,按以上步骤测定OD值,平行3次,将平均值代入线性回归方程,计算样品中总酚含量(mg/g)。
1.3.2 PAL活性测定 参照SOLECKA等[9]的方法。底物酚类物质合成时,经历苯丙烷代谢途径,催化L-苯丙氨酸发生脱氨反应形成反式肉桂酸,同时释放NH3。称取样品0.1g,加入0.01gPVP,0.1 mol/L硼酸缓冲液1 mL(pH值8.8),5 mol/L疏基乙醇,于预先干燥的研钵中研磨成匀浆,离心15 min,转速为10 000 r/min,取上清液作为酶提取液。反应液总体积4 mL,吸取0.2 mL酶液(另0.2 mL缓冲液作为对照),加入0.02 mol/L苯丙氨酸1 mL,蒸馏水2.8 mL,恒温30℃,水浴搅拌30 min。采用紫外可见分光光度计测吸光度,波长为290 nm,吸光度值每变化0.01,表示生成1 μg反式肉桂酸,即为一个酶活性单位,用U/g来表示。
1.3.3 PPO活性测定 PPO是一种含有铜离子的氧化还原酶,催化酚类物质生成褐色醌类物质,故此种酶是引起植物褐变的关键酶。当植物受到机械损伤时,它存在于植物线粒体、叶绿体等细胞器、细胞壁和细胞膜上[10]。称取2.0 g样品,加入10 mL 0.1 mol/L的 PPS缓冲液(pH 值 6.0),0.5 g PVPP,于干燥研钵中研磨成匀浆,低温下离心15 min,转速为1 100 r/min,制得酶提取液。吸取3 mL0.05 mol/L PPS缓冲液(pH值6.0),加入1 mL 0.1 mol/L邻苯二酚,后再加入0.1 mL酶提取液,于525 nm处比色测定OD值,以蒸馏水作参比对照。OD值每分钟变化0.01为一个PPO酶活单位(μmol/(mg·min))。
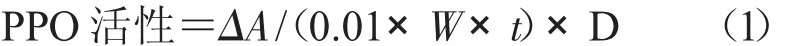
式中,ΔA为吸光值在反应时间内的变化,W为样品质量,t为反应时间,D为稀释倍数。
1.3.4 POD活性测定 参考王学魁等[11]的愈创木酚法。取50mL100mmol/L的磷酸二氢钠(NaH2PO4)和磷酸氢二钠(Na2HPO4)缓冲液,加入 28 μL愈创木酚溶液,振荡使其混合均匀,加入30%的H2O2溶液作为反应混合液。称取样品1.0 g至干燥研钵中,分别加入1 mL NaH2PO4和Na2HPO4缓冲液研磨。将研磨后的匀浆于4 000 r/min离心15 min,取上清液加入NaH2PO4和Na2HPO4缓冲液定容至100 mL。分别取1mL上述溶液,即1 mLNaH2PO4和Na2HPO4缓冲液,并分别加入3 mL预先配制好的反应混合液,紫外分光光度计中比色,波长为470nm。每1min读数一次,共读数5次,以每分钟ΔA470变化0.01作为一个酶活性单位(nmol/(mg·min))。

式中,ΔA470为波长在470 nm下,每1 min所读取的OD值;VT为酶液总体积;W为样品质量;VS为比色时吸取酶液体积;t为反应时间。
1.4 数据分析
数据相关性分析采用SAS8.0软件,图中标准误来自样本的3个重复。用Word process system of fice软件进行误差分析,作图采用Orihin 8.5软件。
2 结果与分析
2.1 热激处理对大花蕙兰组培褐变的影响
从图1可以看出,大花蕙兰外植体增殖继代培养期间,未经热激对照处理的外植体全部变成深褐色,且面积很大,经过热激处理的外植体略微变色,即未经热激对照处理的外植体褐变程度远高于热激处理的外植体,由此判断,热激处理对大花蕙兰组培褐变有抑制作用。

2.2 热激处理对大花蕙兰组培褐变过程中总酚含量及酶活性的影响
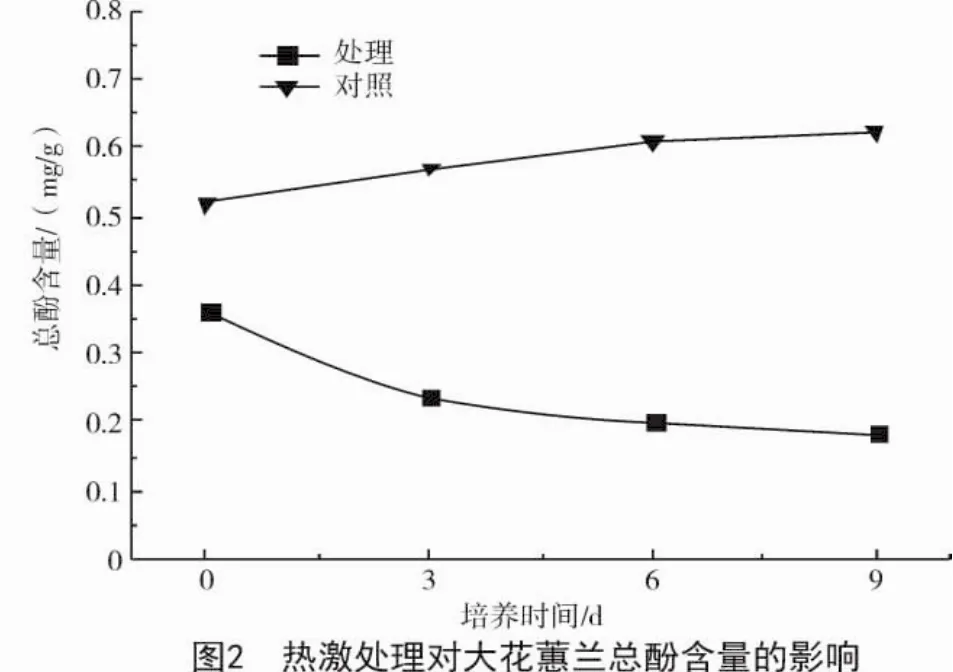
2.2.1 总酚含量 酶、底物、氧是导致外植体褐变的主要因素,酚类物质即是引起褐变的酶促底物。由图2可知,未经热激对照处理组总酚含量变化相对平缓,热激处理后使大花蕙兰外植体的总酚含量逐渐降低。在第3,6,9天的外植体总酚含量比未经热激对照处理分别降低58.42%,67.21%,70.16%。
2.2.2 PAL活性 PAL活性变化情况如图3所示。

从图3可以看出,第3,6,9天抽取的样品经热激处理的外植体PAL活性比未经热激对照处理低,其中,第3天抽取的降低了18.58%,降低幅度最大,第6,9天经热激处理的PAL活性比未经热激对照处理分别降低13.3%,10.47%。
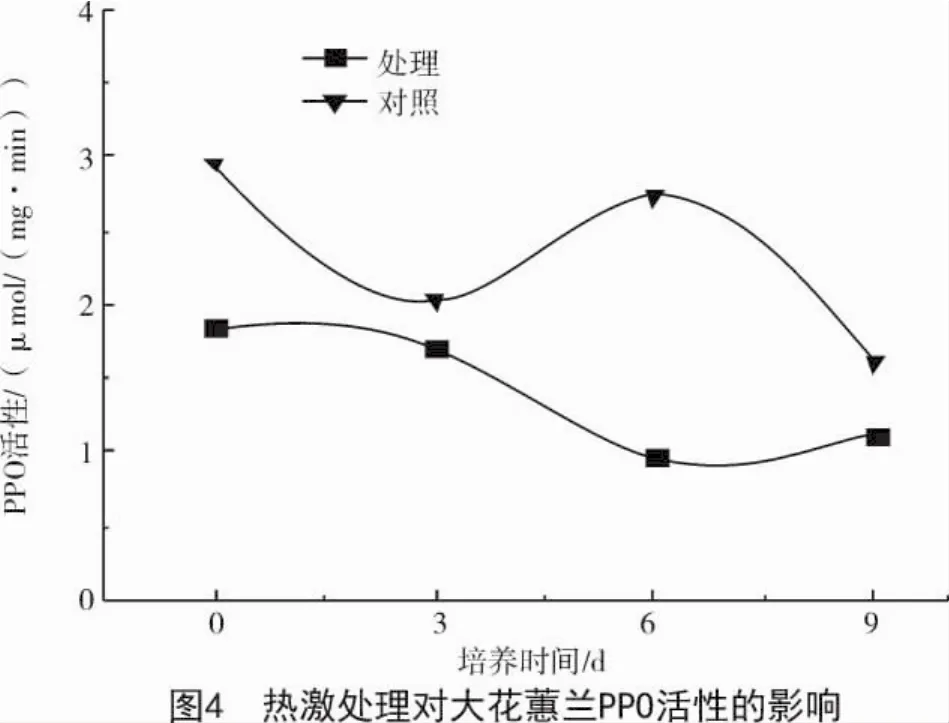
2.2.3 PPO活性 由图4可知,经热激处理的外植体PPO活性始终低于未经热激对照处理,由此得出,热激处理对外植体PPO的活性有显著抑制作用,第6天抽取的样品中经热激处理的外植体PPO活性比未经热激对照处理低64.47%,第0,3,9天分别降低了36.94%,14.85%,29.38%。
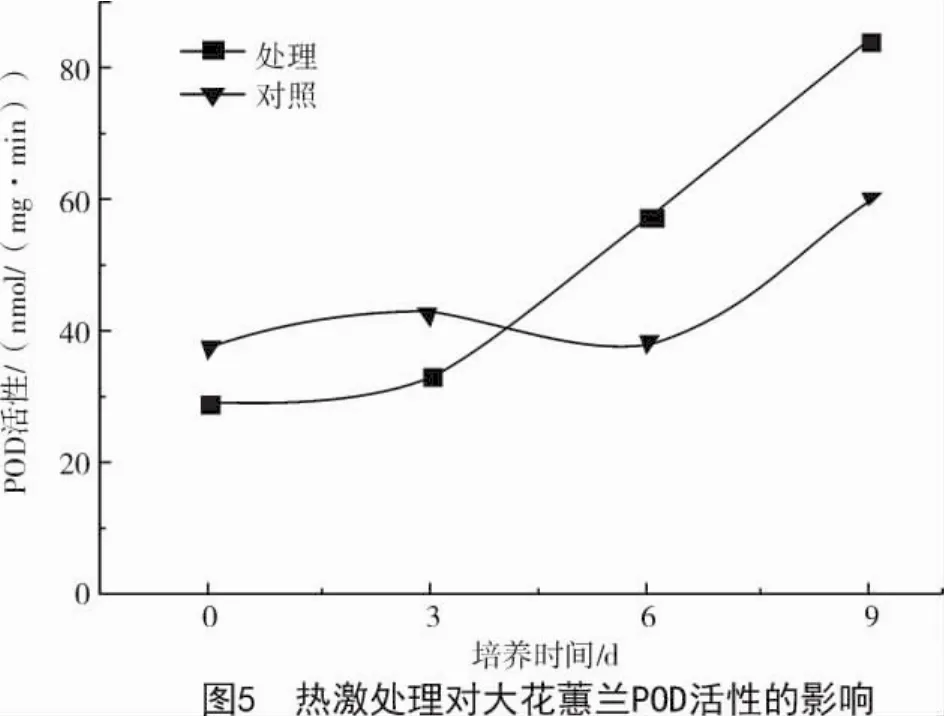
2.2.4 POD活性 从图5可以看出,热激处理对外植体POD活性虽然有一定的抑制作用,但是不显著。前3 d抽取的样品经热激处理的外植体POD活性比未经热激对照处理略有下降,第6,9天抽取的样品经热激处理的外植体POD活性比未经热激对照处理显著升高。第0,3天抽取的样品经热激处理的外植体POD活性比未经热激对照处理分别降低22.85%,21.14%,第6,9天POD活性分别升高51.85%,38.7%。
2.2.5 总酚含量与PAL、PPO和POD活性的相关性分析 大花蕙兰叶片外植体总酚含量与3种酶活性相关性如表1所示,与PAL的相关系数为0.529 37,与PPO的相关系数为0.622 94,与POD的相关系数为-0.530 01。即PAL活性与总酚含量呈正相关,PPO活性与总酚含量也呈正相关,且相关性最大,POD活性与总酚含量呈负相关。
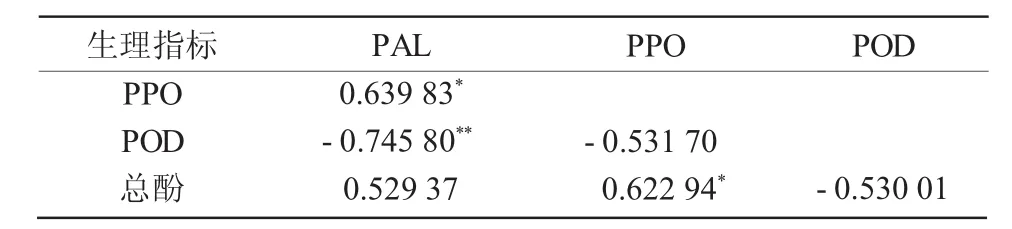
表1 总酚含量与PAL、PPO和POD活性的相关性分析
3 讨论
兰科植物组培过程中,外植体从原球茎诱导到继代增殖,极易发生褐变[12]。褐变是植物细胞液泡内的酚类物质与细胞质内的酚氧化酶在外植体受到机械损伤,而使二者经氧催化发生酶促氧化反应,形成褐色的醌类物质和水,而醌类物质经酪氨酸酶催化,导致外植体蛋白质发生聚合反应,最终使培养基变成褐色,外植体组织死亡[13]。在控制植物组培褐变的多种途径中,热激处理因安全、简便已被多数研究中心应用。热激处理是将植物外植体在超过其正常生长温度范围内,处理一段时间后,诱导产生热激蛋白(Heat shot protein,HSP),此蛋白可以保护植物体免受伤害[14]。KANABUS等[15]将马铃薯细胞经过热激处理(42℃)后,大量HSP合成,而使细胞内其他蛋白的合成受到抑制。总酚含量及PAL、PPO、POD活性是确定褐变程度的重要指标[16]。PAL是酚类物质合成的关键酶,植物细胞中,葡萄糖经莽草酸途径生成L-苯丙氨酸,后经过苯丙烷代谢途径生成酚类物质。故PAL活性与酚类物质的合成有着密切的联系[17]。本研究显示,热激处理明显减轻了大花蕙兰叶片外植体的褐变程度。培养初期0~6 d,经过热激处理的外植体PAL活性及总酚含量低于未经热激对照处理。由此表明,热激处理可抑制由机械损伤引起的大花蕙兰叶片外植体的PAL活性。因热激处理诱导产生热激蛋白在细胞总蛋白合成一定的情况下,降低了PAL合成的诱导蛋白,PAL的代谢速率加快,PAL活性受到抑制,进而降低了总酚的合成,减少醌类物质产生,减轻了褐变。
酚类物质由PAL合成后经PPO催化降解引起褐变[18]。FUKUMOTO等[19]将鲜莴苣经热激处理(50℃)后,测得PPO和POD合成受到抑制,降低了其活性。PPO属于末端氧化酶,在植物中广泛存在[20]。POD属于氧化还原酶,在外植体褐变过程中,POD还原H2O2,为PPO降解酚类物质提供了所需氧气[21]。本试验中,经热激处理的大花蕙兰叶片外植体PPO活性低于未经处理的,而POD活性未得到持久抑制。这表明,在大花蕙兰组培中,PPO是催化酚类物质形成醌类物质的主要酶。
综上所述,热激处理可抑制组培期间叶片外植体PPO与PAL的活性,抑制了酚类物质的氧化合成,进而减少了褐化物醌类物质的产生,从而降低了大花蕙兰叶片外植体褐变的发生。在总酚合成与3种酶相关性分析中可看出,总酚含量与PPO活性呈显著正相关,与POD活性呈负相关。

