小麦类受体蛋白激酶基因TaPK3A的克隆与抗纹枯病功能初步分析
苏 强 荣 玮 张增艳
小麦类受体蛋白激酶基因的克隆与抗纹枯病功能初步分析
苏 强 荣 玮 张增艳*
中国农业科学院作物科学研究所 / 农作物基因资源与基因改良国家重大科学工程 / 农业部麦类生物学与遗传育种重点实验室, 北京 100081
小麦纹枯病已成为我国小麦生产的重要限制因素。研究小麦防御反应分子基础, 发掘有效的抗病基因是小麦抗纹枯病育种突破的前提。本研究从抗纹枯病小麦品系CI12633中克隆出一个类受体蛋白激酶(receptor-like protein kinase, RLK)基因, 并对其表达特性及抗纹枯病功能进行了分析和验证。基因的开放阅读框长度为1983 bp, 编码660个氨基酸组成的类受体蛋白激酶。在抗纹枯病小麦品系CI12633中的表达受禾谷丝核菌的诱导而显著上调;在根、茎、叶、穗中都有表达, 以叶中的表达量最高;的表达受植物激素水杨酸诱导最为显著。利用大麦条形花叶病毒(barley stripe mosaic virus, BSMV)诱导的基因沉默(virus-induced gene silencing, VIGS)技术, 降低抗纹枯病小麦CI12633中的转录水平, 再接种禾谷丝核菌WK207进行纹枯病抗性鉴定。结果显示, 与对照植株相比,转录量下降的CI12633植株对纹枯病的抗性显著降低, 说明是小麦防御纹枯病反应所需的。
类受体蛋白激酶; 小麦纹枯病; 抗病反应; 病毒诱导的基因沉默
小麦纹枯病是由禾谷丝核菌()侵染引起的一种土传真菌病害, 在世界范围内皆有发生, 近年在我国发病区域和危害程度呈上升趋势, 已成为我国小麦生产中的主要病害之一。2012—2018年间我国病虫害测报处(中国农业信息网, http://www.agri.cn/)的数据显示, 小麦纹枯病发病面积为我国总病害发病面积的23.0%~32.5%, 一般可减产10%左右, 严重时可减产40%以上[1]。虽然已报道过一些小麦抗病资源[2-3], 但是它们农艺性状差难以被直接应用, 加之有效抗病基因与分子标记的匮乏, 严重制约了小麦抗纹枯病品种改良的进展。因此,从小麦基因组中筛选有效的抗纹枯病基因对小麦抗纹枯病分子育种和传统育种具有重要意义。
蛋白激酶识别病原效应因子或传递下游信号参与防御反应[4]。植物类受体蛋白激酶是跨膜蛋白, 由胞外的受体识别结构域、跨膜结构域和位于细胞质的激酶结构域三部分组成。类受体蛋白激酶(receptor-like protein kinase, RLK)通过胞外结构域感知刺激, 并通过其胞质激酶结构域传递信号[5-7]。根据胞外结构域的不同, 植物RLK可分为富含亮氨酸重复序列的受体激酶(leucine-rich repeat, LRR)、细胞壁相关的类受体激酶(wall-associated kinase, WAK/WAK-like kinase, WAKL)、含赖氨酸基序的受体激酶(lysine motif, Lys M)、类凝集素结合域的受体激酶(lectin-binding domain, LB)、具有S-结构域的受体激酶(self-incompatibility locus, S-locus)等[7-8]。植物RLK数量众多, 属于超大家族。如在拟南芥()中已鉴定出600多个受体蛋白激酶[6,10]。类受体蛋白激酶广泛存在于植物中[9-11]。RLK功能包括激素响应[12]、发育控制[13]、生殖调节[14]、结瘤作用[15-16]和抗病反应[17-18]。例如, 水稻基因编码一个RLK蛋白, 具有抗白叶枯病作用[19]。在拟南芥中, SA处理提高的转录丰度, 过表达增强了拟南芥对灰霉病的抗性[20]。当稻瘟病菌()侵染后,的转录水平受到显著诱导, 且过表达的转基因水稻对稻瘟病小种P007的抗性显著增强[21]。玉米基因可以感知丝黑穗病菌()的入侵, 触发宿主防御反应, 进而抑制病原菌的生长[22]。外源凝集素受体激酶基因可提高拟南芥对丁香假单胞菌()的抵御能力[23]。水稻中,赋予寄主植株对稻瘟菌生理小种ZB15的抗性[24]。当水稻携带3个凝集素受体激酶基因时, 具有对褐飞虱的广谱抗性[25]。具有S-结构域受体激酶基因在小麦抗叶锈病反应中起重要作用[26]。是小麦3个同源RLK基因, 不仅响应胁迫, 而且正向参与小麦抗条锈病的超敏反应[27]。
本研究利用小麦转录组数据发掘出一个类受体激酶类基因, 并从抗纹枯病小麦品系CI12633中克隆了基因。对在抗纹枯病小麦、感纹枯病小麦中的表达谱以及小麦不同组织的表达特性进行了分析, 也进行了响应激素的研究。重要的是利用BSMV-VIGS沉默技术分析对小麦纹枯病的防御功能, 旨在进一步了解小麦抗纹枯病反应的分子基础, 为小麦抗纹枯病分子育种提供候选基因。
1 材料与方法
1.1 试验材料
小麦品种温麦6号和品系CI12633, 分别由中国农业科学院作物科学研究所李立会研究员和江苏省农业科学院粮食作物研究所蔡士宾研究员惠赠。由山红麦和温麦6号衍生的RIL (recombinant inbred line)群体由中国农业科学院作物科学研究所贾继增研究员惠赠。禾谷丝核菌()北方强毒力菌株WK207由山东农业大学于金凤教授惠赠。
1.2 TaPK3A基因的分离及序列分析
对RIL系植株(F11)进行抗纹枯病鉴定, 从中选出抗、感纯合株系各3个, 于苗期接种禾谷丝核菌WK207。于接种前(0 h)、接种后4 d和10 d分别取样, 抗病系样品分别记为R0、R4和R10, 感病系样品分别记为S0、S4和S10, 首先用TRIzol Reagent提取试剂(北京百奥科利科技有限公司)提取小麦总RNA, 然后用FastKing RT Kit (含gDNase, KR116, 天根生化科技有限公司)合成第1链cDNA。
分别以R0/S0、R4/S4和R10/S10的转录组数据分析小麦抗、感株系间的表达差异基因, 根据注释信息在Ensembl Plants数据库(http://plants.ensembl.org/ index.html)中得到候选基因的EST序列。使用Primer Premier 5.0软件设计2对引物, 其序列为TaPK3A-F1: 5′-TACCAGCTTCTATGCCT G-3′, TaPK3A-R1: 5′-ACACTCTCAAACCTTCCA-3′; TaPK3A-F2: 5′-GCATCTGTAAAGCTCTCATG-3′, Ta PK3A-R2: 5′-CACCTGAGGTGGGTAGAG-3′。利用TaKaRa LA酶(DRR002A), 对该基因进行巢式PCR扩增。第1轮扩增程序为94°C 3 min; 30×(94°C 30 s, 50°C 30 s, 72°C 140 s); 72°C 10 min; 4°C保存。将第1轮扩增产物稀释50倍作为第2轮扩增的模板。第2轮扩增程序为94°C 3 min; 35×(94°C 30 s, 50°C 30 s, 72°C 120 s); 72°C 10 min; 4°C保存。扩增产物经1.0%琼脂糖凝胶电泳分离, 切胶回收, 并连接到pMD-18T(D101A)载体进行测序, 获得小麦基因序列。用Protparam (http://web.expasy.org/ protparam)分析编码氨基酸的理化性质, 用SignalP-4.1 Server在线工具(http://www.cbs.dtu.dk/ services/SignalP/)分析其氨基酸序列中的信号肽信息, 用SMART (http://smart.embl-heidelberg.de/)预测蛋白结构域, 使用MEGA7软件对及其同源序列进行进化树分析。
1.3 TaPK3A基因表达分析
1.3.2组织表达分析 于CI12633抽穗期, 采用牙签法接种禾谷丝核菌WK207。取接种前(0 d)和接种后(4 d)的根、茎、叶、穗样品分别提取RNA, 进行RT-qPCR分析。
1.3.3对不同激素处理响应的定量表达分析 使用0.7% H2O2过夜浸泡CI12633种子, 在22°C、16 h光照/8 h黑暗条件下生长至三叶一心期, 喷施外源水杨酸(SA, 1 mmol L–1)、脱落酸(ABA, 0.2 mmol L–1)、茉莉酸甲酯(MeJA, 0.1 mmol L–1)、乙烯合成前体(ACC, 0.1 mmol L–1), 在处理前(0 h)和处理后0.5、1、6和24 h取样, 取3个植株的叶片混样后提取总RNA, 进行RT-qPCR分析。
1.4 BSMV-VIGS载体的构建和实施
BSMV病毒载体α、β和γ:由本实验室保存。参照Holzberg等[29]描述的方法, 根据的cDNA序列, 设计特异序列区段引物(TaPK3A- VIGS-F: 5¢-GCAAGCTGTGCGTCGTTGC G-3¢; TaPK3A-VIGS-1145R: 5¢-GCCACCT GAGGTGGGTAGAGGA-3¢, 下画线表示I酶切位点)。利用PCR方法获得含3¢端的特异片段126 bp, 构建重组载体γ:。用限制性内切酶I (TaKaRa)对α、γ:、γ:载体质粒线性化, 用限制性内切酶I (TaKaRa)对β质粒线性化。以线性化的质粒为模板, 按Zhu等[30]描述的方法, 使用RiboMA Large Scale RNA Production System-T7试剂盒(Promega, USA)体外转录。对三叶一心期的CI12633摩擦接种BSMV, 接种病毒10 d后提取小麦叶片总RNA, 反转录成单链cDNA作为分析的模板。利用半定量PCR对BSMV基因的转录表达进行分析, 反应体系为2× PCR StarMix (北京康润诚业有限公司)12.5 µL,正、反引物(10 µmol L–1)各1.0 µL, 不同材料的cDNA模板量不同, 用RNase-free ddH2O补至25 µL。扩增程序为94°C 3 min; 16´(94°C 30 s, 57°C 30 s, 72°C 30 s); 72°C 10 min。以电泳亮度调整加入模板的量, BSMV:植株1.0 μL, BSMV:植株分别为0.75、1.5和2.0 μL。利用BSMV-CP引物(F: 5′-TGACTGCTAAGGGTGGAGG A-3′; R: 5′-CGGTTGAACATCACGAAGAGT-3′)进行PCR扩增, 26个循环, 120 V琼脂糖凝胶电泳20 min。
以为内标, 对不同样品模板进行均一化处理, 然后利用特异引物TaPK3A-RT-F/ TaPK3A-RT-R, 对成功接种BSMV重组病毒的小麦进行RT-qPCR分析, 检测基因转录物的积累水平。
1.5 BSMV-VIGS小麦植株的纹枯病鉴定
在小麦拔节期, 采用牙签法对沉默植株和对照植株接种禾谷丝核菌WK207。用湿润的脱脂棉将接种部位包住保湿, 每天喷水3次, 保持相对湿度不低于100%, 持续1周。于接种纹枯病后30 d调查病情, 按5级标准[30-31]划分小麦纹枯病的病级(infection type, IT)和病情指数(disease index, DI), 以评价小麦纹枯病抗性。
2 结果与分析
2.1 TaPK3A基因的发掘克隆与序列分析
分析小麦转录组数据, 发现一个响应纹枯病侵染的基因。通过巢式PCR方法从小麦CI12633的cDNA中克隆得到全长编码序列(GenBank登录号为MG882067)。序列与的cDNA序列具有93.44%的相似性。在0、4和10 d 时间点,的表达量在抗病株系中比感病株系中上调96.7、120.8和156.6倍(图1-A)。当小麦纹枯病菌侵染时,的表达量上调, 并且与转录组数据趋势一致(图1-B)。
序列分析显示,有一个长度为1983 bp的开放阅读框, 编码660个氨基酸组成的类受体蛋白激酶TaPK3A。预测TaPK3A的分子量为73.95 kDa, 等电点是5.95。SMART软件分析表明, TaPK3A具有一个信号肽(第1~第31位氨基酸), 一个跨膜区(第287~第309位氨基酸)和丝氨酸/苏氨酸结构域(第363~第623位氨基酸)。进一步分析了的进化关系, 与抗病相关S-Locus RLK类的OnN25-1、ZmPK3、TaLRK10; LB RLK类的Sbds1、OsXa26、AtPSKR1; LRR RLK类的NbLRK1、AtLecRK-VI.2、AtLPK1; WAK/WAKL RLK类的AtWAK1、AtWAKL10、OsWAK1; LysM RLK类的AtCERK1、SiBti9、OsCERK1, 使用ClustalW比对, 以MEGA7软件构建系统发生树。结果显示, TaPK3A与-locus RLK类基因在同一分支, 并且与小麦抗锈病蛋白TaLRK10亲缘关系最近(图2)。TaPK3A与TaLRK10蛋白全长氨基酸序列间一致性为32.32%。
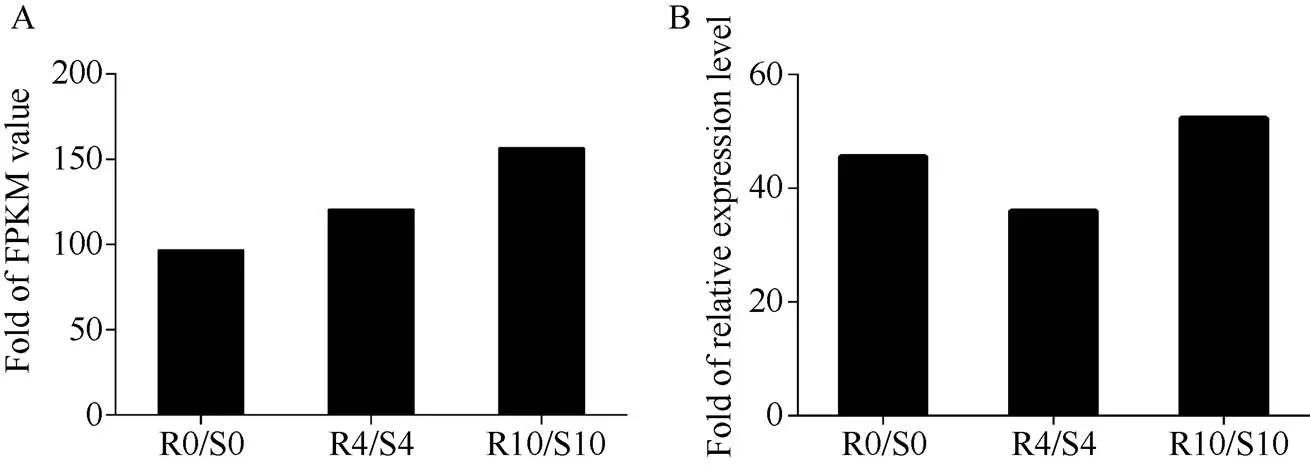
图1 RIL中TaPK3A的表达分析
A: 抗感材料RNA-Seq 数据中的表达量; B: RT-qPCR验证的表达量; R代表RIL中抗纹枯病小麦株系, S代表RIL中感纹枯病株系; R0/S0表示在0 h时R中和S中的表达量的比值; R4/S4表示在4 d时R中和S中的表达量的比值; R10/S10表示在10 d时R中和S中的表达量的比值。
A: expression ofin RNA-Seq data of resistant and susceptible materials. B: RT-qPCR verification of the transcription of. R stands for sharp eyespot resistant wheat lines in RIL. S stands for sharp eyespot susceptible wheat lines in RIL. R0/S0 stands for the ratio ofexpression in R and S at 0 h. R4/S4 stands for the ratio ofexpression in R and S at 4 d. R10/S10 stands for the ratio ofexpression in R and S at 10 d.
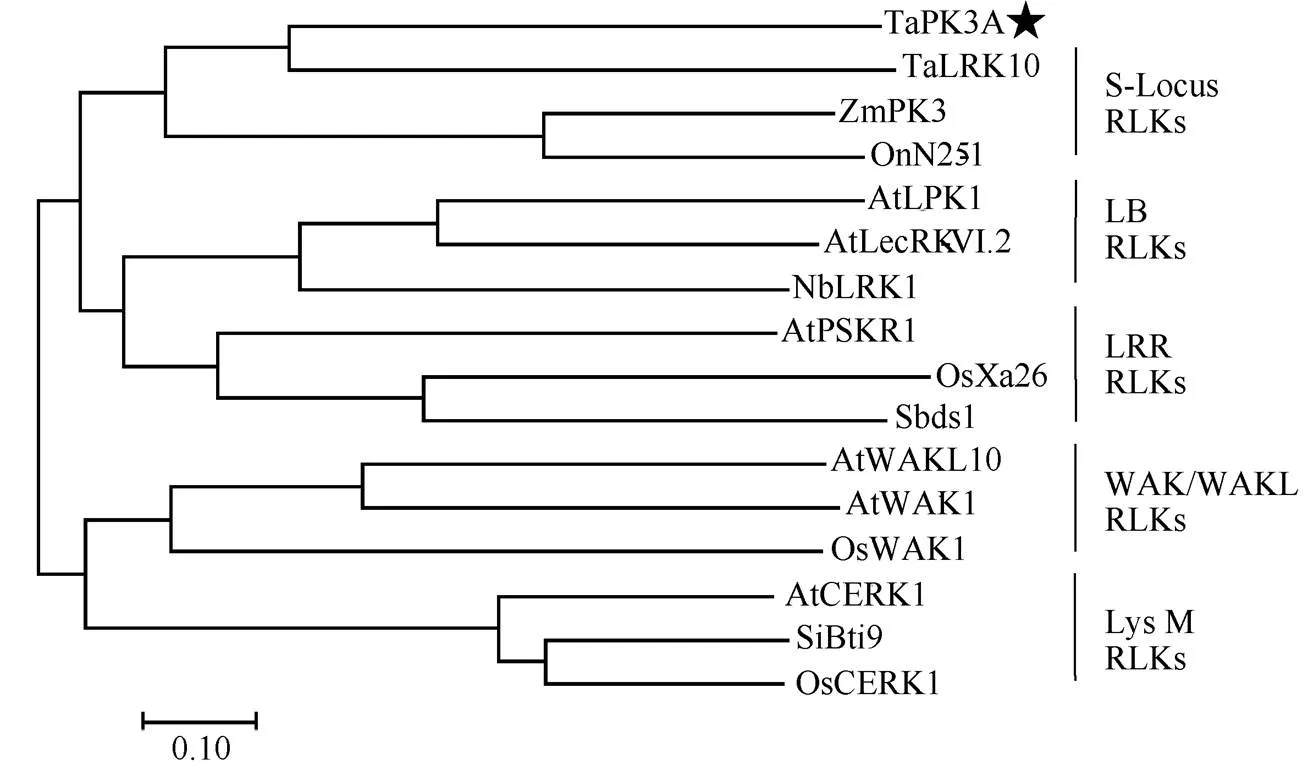
图2 TaPK3A蛋白的系统进化树分析
用MEGA7对TaPK3A进化树分析, 五角星标注的是TaPK3A蛋白, 竖线内为同一亚家族蛋白。AtCERK1 (NP_566689.2)、AtLecRK-VI.2 (Q9M021.1)、AtLPK1 (NP_567233.1)、AtPSKR1 (OAP07882.1)、AtWAK1 (OAP13193.1)、AtWAKL10 (NP_178086.1)来自拟南芥; OnN25-1 (AHW98543.1)来自野生稻; NbLRK1 (BAG68210.1)来自本氏烟; OsWAK1 (BAG89532.1)、OsCERK1 (A0A0P0XII1.1)、OsXa26 (AAR08150.1)来自水稻; Sbds1 (BAM45642.1)来自高粱; SiBti9 (ADL16642.1)来自谷子; TaLRK10 (AAC49629.1)来自小麦; ZmPK3 (CAA09029.1)来自玉米。
The phylogenetic tree of TaPK3A was analyzed by MEGA7. TaPK3A protein was tagged with star. The protein in the vertical lines belongs to the same subfamily. AtCERK1 (NP_566689.2), AtLecRK-VI.2 (Q9M021.1), AtLPK1 (NP_567233.1), AtPSKR1 (OAP07882.1), AtWAK1 (OAP13193.1), AtWAKL10 (NP_178086.1) are from; OnN25-1 (AHW98543.1) is from; NbLRK1 (BAG68210.1) is from; OsWAK1 (BAG89532.1), OsCERK1 (A0A0P0XII1.1), OsXa26 (AAR08150.1) are from; Sbds1 (BAM45642.1) is from; SiBti9 (ADL16642.1) is from; TaLRK10 (AAC49629.1) is fromL.; ZmPK3 (CAA09029.1) is fromL.
2.2 TaPK3A基因的表达特性分析
以未接种为对照, 连续检测接种禾谷丝核菌后2~21 d抗性小麦CI12633中的相对表达水平, 发现该基因受到病菌的强烈诱导, 在接种后14 d表达量达到最大值(图3-A), 说明可能在病原菌侵染过程中起作用。
中国水利:2013年,在大规模水利建设全面展开、安全生产任务繁重的情况下,水利安全生产形势继续保持总体稳定。在这方面,采取了哪些措施?
取未受禾谷丝核菌侵染的小麦和受禾谷丝核菌侵染4 d后的小麦的不同组织, 以未接菌植株根中的表达量为基准, 进行表达模式的分析, 结果显示在小麦的不同组织都有一定程度的表达。在未接种禾谷丝核菌的情况下, 叶中的表达量最高。在接种禾谷丝核菌4 d后, 受病原菌的诱导,在根、茎、叶和穗中的表达量均显著升高, 且叶中的表达量最高(图3-B)。
为了研究基因对不同植物激素的响应, 在三叶一心期对小麦喷施SA、MeJA、ABA和ET, 分析基因在激素处理前(0 h)和处理后0.5~24 h的转录水平。结果显示, 激素处理后,最先受SA诱导表达; 处理6 h后,开始受JA和ABA诱导表达(图3-C)。
2.3 BSMV-VIGS分析TaPK3A基因在小麦抗纹枯病反应中的功能
将BSMV:和BSMV:病毒RNAs分别转染小麦品系CI12633叶片。转染病毒后6 d, 在新生叶片能观察到病毒斑, 第10天观察到明显的病毒斑(图4-C)。使用半定量PCR可以检测到编码BSMV外壳蛋白基因的转录表达, 说明BSMV病毒成功转染到小麦植株(图4-A)。
为了检测基因的沉默情况, 以接种BSMV:植株为对照, 对接种BSMV:的植株使用RT-qPCR分析的表达量。接种BSMV:的CI12633植株中的表达量显著降低(图4-B), 表明在小麦植株中被沉默。
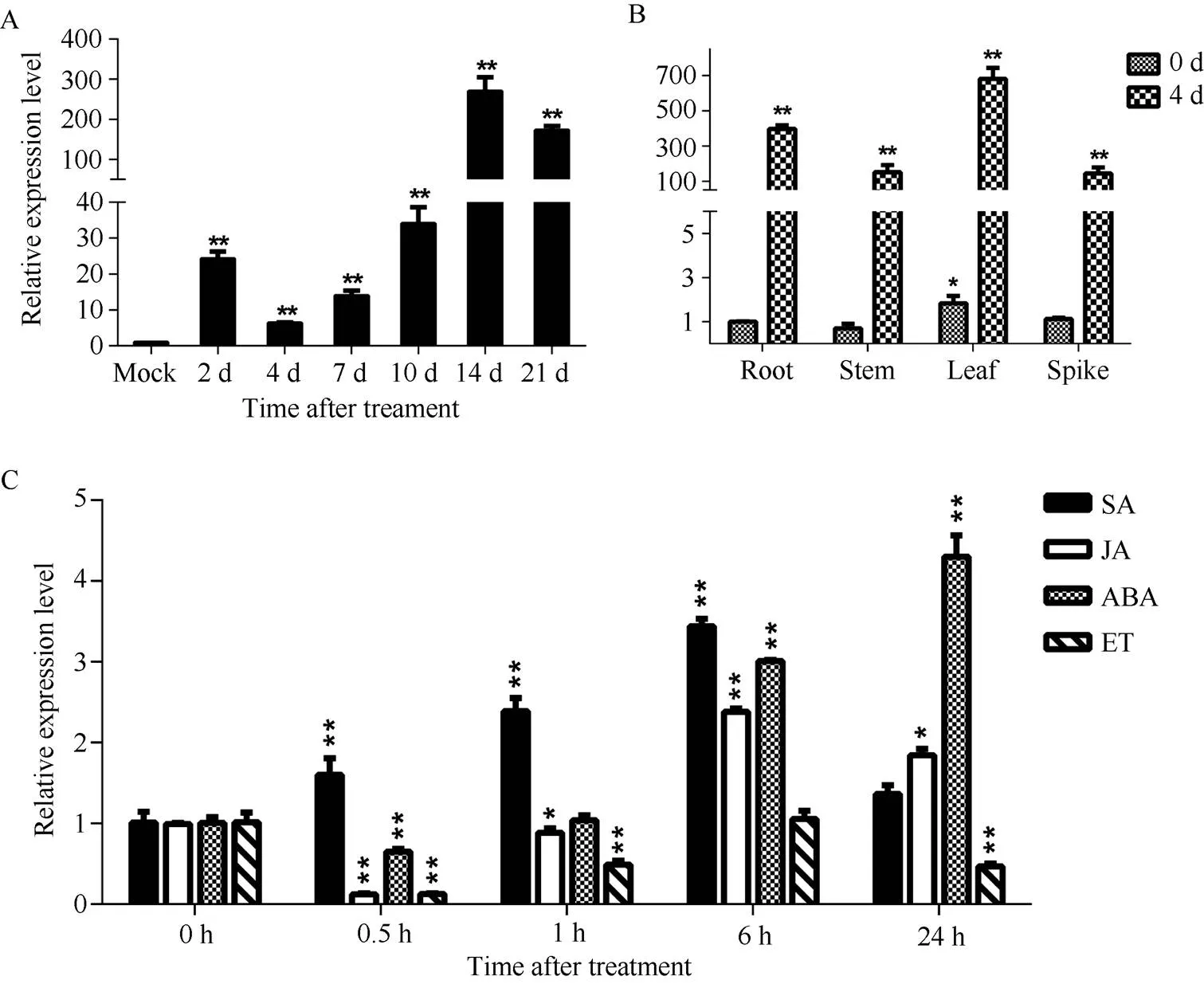
图3 小麦品系CI12633中TaPK3A基因的表达分析
A:基因在抗纹枯病小麦CI12633中的表达分析, 横坐标表示禾谷丝核菌侵染小麦CI12633后0 h、2 d、4 d、7 d、10 d、14 d和21 d时的样品。B: CI12633小麦不同组织中受禾谷丝核菌的诱导表达分析。C:基因响应 SA、JA、ABA和 ET的表达分析, 横坐标表示不同植物激素处理小麦CI12633后0 h、0.5 h、1 h、6 h和24 h时的样品。检验分析表达量的差异显著性, *< 0.05; **< 0.01。
A: expression analysis ofin resistant wheat line CI12633. 0 h, 2 d, 4 d, 7 d, 10 d, 14 d, and 21 d stand for the samples of wheat line CI12633 after inoculation of. B: expression analysis ofinduced byin the organs of wheat line CI12633. C: expression analysis ofafter SA, JA, ABA, and ET treatment. 0 h, 0.5 h, 1 h, 6 h, and 24 h stand for the samples of wheat line CI12633 after different phytohormones treatments,-test was used to statistically analyze the significant difference ofexpression. *< 0.05; **< 0.01.

图4 BSMV CP、TaPK3A基因的检测及小麦花叶和纹枯病表型
A: 半定量PCR检测的转录表达, 扩增26个循环; B: 对接种BSMV:和BSMV:10 d后的植株RT-qPCR检测的表达, **< 0.01 (检验); C: 接种BSMV后10 d, 小麦叶片呈现出BSMV病毒斑; D: 接种禾谷丝核菌后30 d小麦茎秆上纹枯病斑, IT: 病级
A: transcriptional expression ofby semi-quantitative PCR, and the amplification was 26 cycles. B: RT-qPCR analysis of the relative transcript levels ofin the wheat plants infected by BSMV:or BSMV:at 10 dpi. **< 0.01 (-test). C: BSMV virus spots on wheat leaves 10 days later after inoculation. D: sharp eyespot symptoms on wheat stems 30 days after inoculation with. IT: infection type.
在转染BSMV:和BSMV:小麦CI12633拔节期, 采用牙签法接种禾谷丝核菌WK207, 分析沉默对小麦纹枯病抗性的影响。接种10 d后, 对照植株和BSMV:转染的CI12633植株的叶鞘出现明显的纹枯病症状; 接种30 d后, 所有CI12633植株茎上都有典型的纹枯病症状, 大多数转染BSMV:的CI12633植株的纹枯病更严重(图4-D)。转染BSMV:的CI12633植株纹枯病平均病级和病情指数分别为1.27和25.40; 转染BSMV:的CI12633植株纹枯病平均病级和病情指数分别为2.31和46.20, 纹枯病平均病级和病情指数均达到极显著差异(表1)。沉默显著减弱了抗纹枯病小麦CI12633抑制禾谷丝核菌侵染的能力, 说明是小麦抗纹枯病反应所需的。
3 讨论
本研究根据转录组数据分离克隆了小麦蛋白激酶全长编码序列。在叶中表达量最高, 且其表达受到禾谷丝核菌的诱导而上调。TaPK3A是由660个氨基酸组成的类受体蛋白激酶, 具有信号肽、跨膜域和丝氨酸/苏氨酸结构域。进化树的分析结果表明, TaPK3A蛋白与小麦的TaLRK10、玉米的ZmPK3及野生稻的OnN25-1形成一个独立的-Locus RLK分支。已有研究表明, 小麦TaLRK10具有抗叶锈病的作用[26], 且TaPK3A与其亲缘关系最近, 但是TaPK3A与TaLRK10的全长氨基酸序列间一致性为32.32%, 说明TaPK3A是一个新的RLK功能成员。

表1 TaPK3A沉默及对照小麦的纹枯病鉴定
**表示沉默植株(BSMV:)和对照植株(BSMV:)之间极差异显著(< 0.01,检验)。
**Significant difference betweensilenced (BSMV:) and control (BSMV:) plants at< 0.01 (-test).
植物类受体蛋白激酶在抗病虫方面发挥着重要的作用[22-27,32-33]。S结构域RLK能引起自交不亲和性, 部分S结构域RLK能识别病原菌、病原相关分子模式和损伤[32]。Feuillet等[26]、Zhou等[27]和Brueggeman等[33]研究表明, RLK参与小麦及大麦的抗锈病反应。本研究表明,受禾谷丝核菌的强烈诱导, 且在接种纹枯病菌后14 d达到高峰, 暗示参与小麦抗纹枯病全过程。利用BSMV病毒介导的VIGS技术, 可以在大麦和小麦植物中实施高度同源的内源基因沉默, 是快速分析大麦和小麦基因功能的一种有效方法[27,29-30,34-36]。利用BSMV-VIGS沉默技术也已证明,和负调控小麦抗白粉病反应[37], 小麦RAR1和SGT1在小麦抗叶锈病基因介导的免疫反应中发挥作用[38],和正向调控小麦对禾谷丝核菌的抗性反应[30,39]。本研究中, 沉默显著减弱了小麦品系CI12633对纹枯病的抗性, 表明是小麦抗纹枯病反应所需的1个基因。目前, 关于S结构域RLK在植物抗病中作用的研究相对较少, 本研究丰富了植物RLK在防御病原菌中的理解。
植物激素不仅影响植物的生长发育, 同时也在植物对病原的防御过程中起重要的作用, 植物防御激素水杨酸(SA)、茉莉酸(JA)和乙烯(ET)介导的信号途径, 是植物抗病反应的重要信号传导通路[40]。不同的植物激素在防御不同营养型的病原菌过程中起到不同的作用, SA主要在植物对活体营养型或者半活体营养型的病原菌的抗性中起主要作用, 而JA和ET主要在抗腐生营养型病原菌和虫害过程中起作用[41]。Chen等[42]发现抗白粉病相关基因和通过SA和ROS进行信号传导。本研究中, 在施加激素的前期,快速响应外源SA刺激而上调表达, 推测主要通过SA信号途径传导。在施加激素6 h后,同样受到JA和ABA的诱导表达, 表明在传递病原菌侵入信号的过程较为复杂, 需要后续的研究。值得一提的是,被认为是一种腐生营养型病原菌, 而本研究表明可能通过SA途径传递信号参与小麦对纹枯病的防御反应, 这丰富了对抗病信号传递的理解。
4 结论
克隆出一个小麦RLK基因, 其编码660个氨基酸组成的类受体蛋白激酶TaPK3A;在小麦中表达受禾谷丝核菌和外源SA的诱导而上调; 沉默降低了小麦对纹枯病的抗性, 表明是小麦防御纹枯病菌反应所需的基因。
[1] 王敏霞, 祝秀亮, 罗美英, 张增艳. 小麦防御素基因的克隆与功能分析.植物遗传资源学报, 2017, 18: 925−932. Wang M X, Zhu X L, Luo M Y, Zhang Z Y. Cloning and defensive functional analysis of a wheat defensin gene., 2017, 18: 925−932 (in Chinese with English abstract).
[2] 史建荣, 王裕中, 陈怀谷, 沈素文. 小麦纹枯病品种抗性鉴定技术及抗病资源的筛选与分析. 植物保护学报, 2000, 27: 107−112. Shi J R, Wang Y Z, Chen H G, Shen S W. Screening techniques and evaluation of wheat resistance to sharp eyespot caused by., 2000, 27: 107−112 (in Chinese with English abstract).
[3] 梁邦平, 郝冬冬, 刁慧珊, 李家创, 袁凤平, 李毛, 武军, 赵继新, 陈新宏. 小麦–黑麦1BL/1RS易位系7-1抗纹枯病的分子细胞学鉴定. 农业生物技术学报, 2018, 26: 711−718. Liang B P, Hao D D, Diao H S, Li, J C, Yuan, F P, Li M, Wu J, Zhao J X, Chen X H. Molecular cytogenetic identification of wheat–rye (–) 1BL/1R translocation line 7-1 with sharp eyespot resistance., 2018, 26: 711−718 (in Chinese with English abstract).
[4] Jones J D, Dangl J L. The plant immune system., 2006, 444: 323−329.
[5] Morris E R, Walker J C. Receptor-like protein kinases: the keys to response., 2003, 6: 339−342.
[6] Shiu S H, Bleecker A B. Receptor-like kinases fromform a monophyletic gene family related to animal receptor kinases., 2001, 98: 10763−10768.
[7] Walker J C. Structure and function of the receptor-like protein kinases of higher plants., 1994, 26: 1599−1609.
[8] Tor M, Lotze M T, Holton N. Receptor-mediated signalling in plants: molecular patterns and programmes., 2009, 60: 3645−3654.
[9] Ma C L, Guo J, Kang Y, Doman K, Bryan A C, Tax F E, Yamaguchi Y, Qi Z. AtPEPTIDE RECEPTOR2 mediates the AtPEPTIDE1-induced cytosolic Ca2+rise, which is required for the suppression ofgene expression inroots., 2014, 56: 684−694.
[10] Shiu S H, Karlowski W M, Pan R S, Tzeng Y H, Mayer K F X, Li W H. Comparative analysis of the receptor-like kinase family inand rice., 2004, 16: 1220−1234.
[11] Verica J A, He Z H. The cell wall-associated kinase (WAK) and WAK-like kinase gene family., 2002, 129: 455−459.
[12] Chang C, Kwok S F, Bleecker A B, Meyerowitz E M.ethylene-response gene: similarity of product to two-component regulators., 1993, 262: 539−544.
[13] Becraft P W, Stinard P S, McCarty D R. CRINKLY4: A TNFR-like receptor kinase involved in maize epidermal differentiation., 1996, 273: 1406−1409.
[14] Takasaki T, Hatakeyama K, Suzuki G, Watanabe M, Isogai A, Hinata K. Thereceptor kinase determines self-incompatibility instigma., 2000, 403: 913−916.
[15] Endre G, Kereszt A, Kevei Z, Mihacea S, Kalo P, Kiss G B. A receptor kinase gene regulating symbiotic nodule development., 2002, 417: 962−926.
[16] Nishimura R, Hayashi M, Wu G J, Kouchi H, Imaizumi-Anraku H, Murakami Y, Kawasaki S, Akao S, Ohmori M, Nagasawa M, Harada K, Kawaguchi M. HAR1 mediates systemic regulation of symbiotic organ development., 2002, 420: 426−429.
[17] Loh Y T, Martin G B. Thebacterial resistance gene and theinsecticide sensitivity gene encode functional protein kinases with serine/threonine specificity., 1995, 108: 1735− 1739.
[18] Song W Y, Wang G L, Chen L L, Kim H S, Pi L Y, Holsten T, Gardner J, Wang B, Zhai W X, Zhu L H, Fauquet C, Ronald P. A receptor kinase-like protein encoded by the rice disease resistance gene,., 1995, 270: 1804−1806.
[19] Sun X, Cao Y, Yang Z, Xu C, Li X, Wang S, Zhang Q., a gene conferring resistance topv.in rice, encodes an LRR receptor kinase-like protein., 2004, 37: 517−527.
[20] Brutus A, Sicilia F, Macone A, Cervone F, De Lorenzo G. A domain swap approach reveals a role of the plant wall-associated kinase 1 (WAK1) as a receptor of oligogalacturonides., 2010, 107: 9452−9457.
[21] Kohorn B D, Johansen S, Shishido A, Todorova T, Martinez R, Defeo E, Obregon P. Pectin activation of MAP kinase and gene expression is WAK2 dependent., 2009, 60: 974−982.
[22] Zuo W, Chao Q, Zhang N, Ye J, Tan G, Li B, Xing Y, Zhang B, Liu H, Fengler K A, Zhao J, Zhao X, Chen Y, Lai J, Yan J, Xu M. A maize wall-associated kinase confers quantitative resistance to head smut., 2015, 47: 151−157.
[23] Singh P, Kuo Y C, Mishra S, Tsai C H, Chien C C, Chen C W, Desclos-Theveniau M, Chu P W, Schulze B, Chinchilla D, Boller T, Zimmerli L. The lectin receptor kinase-VI.2 is required for priming and positively regulatespattern-triggered immunity., 2012, 24: 1256−1270.
[24] Chen X, Shang J, Chen D, Lei C, Zou Y, Zhai W, Liu G, Xu J, Ling Z, Cao G, Ma B, Wang Y, Zhao X, Li S, Zhu L. A B-lectin receptor kinase gene conferring rice blast resistance., 2006, 46: 794−804.
[25] Liu Y, Wu H, Chen H, Liu Y, He J, Kang H, Sun Z, Pan G, Wang Q, Hu J, Zhou F, Zhou K, Zheng X, Ren Y, Chen L, Wang Y, Zhao Z, Lin Q, Wu F, Zhang X, Guo X, Cheng X, Jiang L, Wu C, Wang H, Wan J. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice., 2015, 33: 301−305.
[26] Feuillet C, Schachermayr G, Keller B. Molecular cloning of a new receptor-like kinase gene encoded at thedisease resistance locus of wheat., 2010, 11: 45−52.
[27] Zhou H B, Li S F, Deng Z Y, Wang X P, Chen T, Zhang J S, Chen S Y, Ling H Q, Zhang A M, Wang D W, Zhang X Q. Molecular analysis of three new receptor-like kinase genes from hexaploid wheat and evidence for their participation in the wheat hypersensitive response to stripe rust fungus infection., 2007, 52: 420−434.
[28] Livak K J, Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.,2001, 25: 402–408
[29] Holzberg S, Brosio P, Gross C, Pogue G P.-induced gene silencing in a monocot plant., 2002, 30: 315−327.
[30] Zhu X L, Yang K, Wei X N, Zhang Q F, Rong W, Du L P, Ye X G, Qi L, Zhang Z Y. The wheat AGC kinase TaAGC1 is a positive contributor to host resistance to the necrotrophic pathogen., 2015, 66: 6591−6603.
[31] 周淼平, 杨学明, 姚金保, 任丽娟, 张增艳, 马鸿翔. 转基因提高小麦赤霉病和纹枯病的抗性. 作物学报, 2012, 38: 1617−1624. Zhou M P, Yang X M, Yao J B, Ren L J, Zhang Z Y, Ma H X. Enhancement of resistance tohead blight and sharp eyespot intransgenic wheat., 2012, 38: 1617−1624 (in Chinese with English abstract).
[32] Sanabria N, Goring D, Nurnberger T, Dubery I. Self/nonself perception and recognition mechanisms in plants: a comparison of self-incompatibility and innate immunity., 2008, 178: 503−513.
[33] Brueggeman R, Rostoks N, Kudrna D, Kilian A, Han F, Chen J, Druka A, Steffenson B, Kleinhofs A. The barley stem rust- resistance geneis a novel disease-resistance gene with homology to receptor kinases., 2002, 99: 9328−9333.
[34] Ahmed S M, Liu P, Xue Q, Ji C, Qi T, Guo J, Guo J, Kang Z. TaDIR1-2, a wheat ortholog of lipid transfer protein AtDIR1 contributes to negative regulation of wheat resistance againstf. sp.., 2017, 8: 521.
[35] Kage U, Karre S, Kushalappa A C, McCartney C. Identification and characterization of a fusarium head blight resistance genein wheat QTL-2DL., 2017, 15: 447−457.
[36] Liu J, Zhang T, Jia J, Sun J. The wheat mediator subunit TaMED25 interacts with the transcription factor TaEIL1 to negatively regulate disease resistance against powdery mildew., 2016, 170: 1799−1816.
[37] Zou B, Ding Y, Liu H, Hua J. Silencing of copine genes confers common wheat enhanced resistance to powdery mildew., 2017, 19: 1343−1352.
[38] Scofield S R, Huang L, Brandt A S, Gill B S. Development of a virus-induced gene-silencing system for hexaploid wheat and its use in functional analysis of the-mediated leaf rust resistance pathway., 2005, 138: 2165−2173.
[39] Zhu X, Lu C, Du L, Ye X, Liu X, Coules A, Zhang Z. The wheat NB-LRR geneis required for host defence response to the necrotrophic fungal pathogen., 2017, 15: 674−687.
[40] Dong X. SA, JA, ethylene, and disease resistance in plants., 1998, 1: 316−323.
[41] Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens., 2005, 43: 205−227
[42] Chen T, Xiao J, Xu J, Wan W, Qin B, Cao A, Chen W, Xing L, Du C, Gao X, Zhang S, Zhang R, Shen W, Wang H, Wang X. Two members offamily confer powdery mildew resistance in common wheat., 2016, 16: 27.
Cloning and functional analysis of wheat receptor-like kinasegene
SU Qiang, RONG Wei, and ZHANG Zeng-Yan*
National Key Facility for Crop Gene Resources and Genetic Improvement / Key Laboratory of Crop Genetic and Breeding, Ministry of Agriculture / Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
Wheatsharp eyespot has become an important limiting factor of wheat production in China. The precondition for wheat sharp eyespot resistant breeding is to study the molecular basis of wheat defense response and to identify effective resistance genes. In this study, a wheat receptor-like kinase (RLK) gene, named, was cloned from sharp eyespot-resistant wheat line CI12633, and the expression and function of thegene were analyzed.contains an open reading frame with 1983 bp length. It encodes a protein kinase that is consisted of 660 amino acids. RT-qPCR analysis showed that the expression ofin sharp eyespot-resistant wheat line CI12633 was significantly induced by the pathogen of sharp eyespot (). Thegene was expressed in all the tissues, with the highest expression level in the leaves. The expression ofwas significantly up-regulated by salicylic acid. By means of barley stripe mosaic virus (BSMV) based virus-induced gene-silencing (VIGS),was silenced in CI12633 plantsAfter(WK207) inoculation,-silenced CI12633 plants displayed a significant decrease in resistance toinfection compared with BSMV:infected CI12633 plants (control). These results suggested thatis required for wheat defense response to sharp eyespot.
receptor-like kinase; wheat sharp eyespot; resistance response; virus-induced gene silencing
2018-09-30;
2019-01-19;
2019-05-09.
10.3724/SP.J.1006.2019.81017
张增艳, E-mail: zhangzengyan@caas.cn
E-mail: 243939427@qq.com
本研究由国家自然科学基金项目(31771789)资助。
This study was support by the National Natural Science Foundation of China (31771789).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20190507.1331.002.html

