蔓茎堇菜和柔毛堇菜多糖的抑菌抗氧化活性
林雄平,姚小芳,彭 彪,周逢芳
(1.宁德师范学院生命科学学院,福建 宁德 352100;2.福建省特色药用植物工程技术中心,福建 宁德 352100)
蔓茎堇菜Viola diffusa别名有黄瓜香、匍伏堇、七星莲、七瓜香等,是堇菜科堇菜属一年生草本植物[1]。主要分布在浙江、云南、西藏等省区。蔓茎堇菜微苦、性凉,全草入药,具有清热解毒、消肿、消炎等功效[2]。蔓茎堇菜在民间有着悠久的药用历史,主治毒蛇咬伤、肺热引起的咳嗽,黄疸型肝炎,水火烫伤,软组织损伤等[3]。林晓菁等[4]研究表明蔓茎堇菜生药学特征明显,其含有的主要化学组分为糖类、萜类、黄酮等。蔓茎堇菜具有抑菌抗氧化、消除炎症、调节人体免疫等药理活性[5—11]。Dai 等[12]通过体外活性实验发现蔓茎堇菜分离的三萜具有较好的抗HBV 活性。临床使用蔓茎堇菜合剂治疗急性黄疸型肝炎效果显著。蔓茎堇菜提取物治疗再生障碍性贫血有一定效果,对疾病引起的血细胞降低有对抗作用[1]。
柔毛堇菜Viola principis 是堇菜科堇菜属多年生草本植物。主要产于江苏、安徽、福建等地的山地林下、草地、溪谷及沟边路旁等处[13]。Lei 等[14]利用X 射线荧光光谱法研究了重金属铅砷在柔毛堇菜体内的分布发现,这两种重金属都富集于维管束鞘和栅栏组织内。
目前对于蔓茎堇菜的研究主要集中在总三萜的提取、总黄酮的测定提取、药理作用、药用成分以及栽培技术等方面[15—20]。有关蔓茎堇菜提取物的抗氧化活性和抑菌作用研究较少。对于柔毛堇菜的相关研究几乎没有。本文以蔓茎堇菜和柔毛堇菜提取的多糖为试材,以大肠杆菌Escherichia coli、枯草芽孢杆菌Bacillus subtilis、啤酒酵母Saccharomyces carlsbergensis、黑曲霉菌Aspergillus niger等常见细菌和真菌为供试菌,研究蔓茎堇菜和柔毛堇菜多糖的体外抑菌活性和抗氧化活性,为食药两用植物资源开发与利用提供资料。
1 材料与方法
1.1 材料
1.1.1植物材料蔓茎堇菜和柔毛堇菜采于2017 年6 月,分别采自福建省宁德市蕉城区金涵乡金溪自然村林下和高乾村公路的崖壁上。由宁德师范学院陈勇教授鉴定。
1.1.2菌种真菌菌种:黑曲霉菌、啤酒酵母;细菌菌种:大肠杆菌、枯草芽孢杆菌。以上菌种由宁德师范学院微生物实验室提供。
1.1.3主要仪器与设备微型植物粉碎机(天津泰斯特仪器有限公司,型号FZ102)、HX-105温水循环箱(北京长流科学仪器有限公司)、SHZ-D循环水式真空泵(巩义市予华仪器责任有限公司)、SB-1100 EYELA水浴锅(上海艾蓝仪器有限公司)、N-1100 EYELA旋转蒸发仪(上海艾蓝仪器有限公司)、EYELA FDLL-Z110冷冻干燥机(上海艾蓝仪器有限公司)、DK-8D电热恒温水箱(上海—恒科技有限公司)、SiGmR-3-16高速离心冷冻机、SQP电子天平(赛多利斯化学仪器有限公司)、DHP-9272A电热恒温培养箱(上海飞越实验仪器有限公司)、SW-CJ-2D型(实用垂直新颖)双人单面净化工作台(苏州净化设备有限公司)、ARZ-1331游标卡尺、LHP-300人工气候培养箱(上海飞越实验仪器有限公司)、T6新世纪紫外可见分光光度计(北京普希通用仪器有限责任公司)、YXQ-SG46-280S手提式压力蒸汽灭菌锅(上海博迅实业有限公司)。
1.2 方法
1.2.1材料处理将两种堇菜整株包含花和种子分别洗净后在电风扇下风干,用粉碎机粉碎,过60 筛目,制成堇菜干粉备用。
1.2.2多糖提取称取蔓茎堇菜干粉,按照料液比1∶40(W/V)加蒸馏水浸泡30 min,再在60 ℃水浴箱中加热提取70 min,用纱布抽滤,同样的方法提取两次,将提取液合并后在80 ℃条件下蒸干、浓缩直至提取液与浓缩液比为12.5∶1。把所获得的浓缩液六等分,第一份加入1倍无水乙醇,第二份加入2倍无水乙醇,第三份加入3倍无水乙醇,以此类推,第六份加入6倍无水乙醇,6份浓缩液分别记为1、2、3、4、5、6,静置5 h,进行4500 r·min-1离心10 min后取沉淀,加入等体积3%三氯乙酸静置12 h,再离心(4500 r·min-1) 10 min后取上清液,在放入冰箱冷冻结冰前用旋转蒸发仪将浓缩液浓缩至恒重,最后用冷冻干燥机将多糖冻干。柔毛堇菜多糖的提取方法与蔓茎堇菜相同。称量多糖的质量并计算提取得率,计算公式如下:

1.2.3抑菌活性测定将马铃薯葡萄糖琼脂培养基、牛肉蛋白胨培养基、无菌水等高压灭菌20 min(121 ℃)。将接种环、培养皿、无菌水等放入无菌操作台紫外灭菌60 min,无菌操作将直径6 mm 滤纸片分别浸在蔓茎堇菜和柔毛堇菜不同的多糖提取液中(样品浓度为0.1 g·mL-1),几分钟后取出晾干。将4 种待测菌种用无菌水分别配制成浓度为10-6cfu·mL-1菌悬液。在每个培养皿中倒入适量培养基,待培养基静置冷却后取0.1 mL 菌悬液加入培养皿中,用涂布器涂均匀。再将晾干沾有样品和空白对照的滤纸片分别贴在不同培养皿中并做好标签,设两个重复组。把培养枯草芽孢杆菌、大肠杆菌的培养皿倒置在37 ℃培养箱培养;啤酒酵母、黑曲霉的培养皿倒置在28 ℃培养箱培养;24 h 后观察菌的生长情况,用游标卡尺测量抑菌圈直径。每个样品做3 个平行,数据用平均值±标准差表示。
1.2.4多糖抗氧化检测将柔毛堇菜和蔓茎堇菜不同方式提取的多糖分别配制成10 mg·mL-1溶液,并取0.2 mL 进行检测,具体操作步骤参照过氧化氢测定试剂盒说明书。先配制各种应用液,并在37 ℃水浴中预温10 min,每个管加液时要求在37 ℃中进行,混匀。分光光度仪波长和光径分别设置为405 nm 和1 cm,蒸馏水调零,测定各管的吸光度值。抗氧化能力按以下公式计算(抗氧化能力:U·mL-1;标准品浓度163 mmol·L-1):
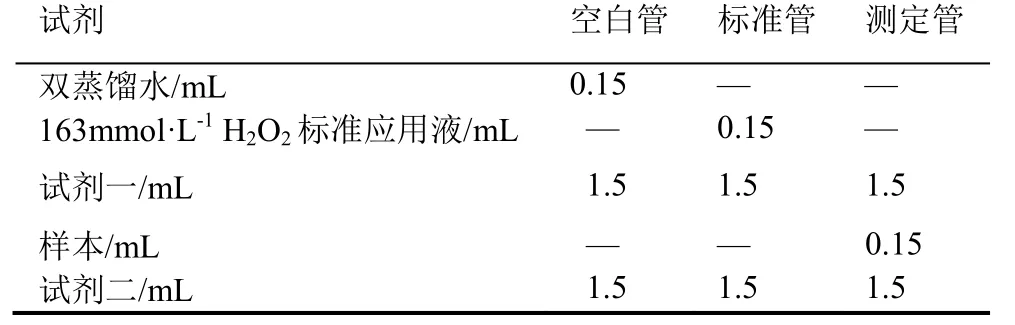
表1 抗氧化试验不同管的加液量Table 1 The amount of liquid added to different tubes in antioxidant test

2 结果与分析
2.1 多糖提取率
由图1可知,蔓茎堇菜多糖的提取率最高为7.0%,最低为4.9%,柔毛堇菜多糖的提取率最高最低分别为9.3%和7.8%,蔓茎堇菜多糖提取率极显著低于柔毛堇菜多糖提取率(P=0.0000 <0.01)。这两种堇菜多糖的提取率会受提取时无水乙醇用量的影响,其中蔓茎堇菜多糖的提取率随着乙醇用量的增加而递减,而柔毛堇菜则没有这个规律。
2.2 两种堇菜多糖抗菌活性
2.2.1蔓茎堇菜浓缩液中加入不同体积的无水乙醇,所提取的多糖对大肠杆菌和枯草芽孢杆菌的抑菌作用亦不同。加入与浓缩液等体积的无水乙醇所提取的多糖抗菌作用最强,抑菌圈分别可达8.46 mm和8.59 mm,而加入6倍浓缩液体积的无水乙醇所提取的多糖抗菌能力最弱,抑菌圈分别为7.26 mm和7.45 mm。这可能与无水乙醇的用量会影响多糖中某些抑菌物质的沉淀有关,或与多糖浓度有关。

图1 蔓茎堇菜和柔毛堇菜多糖提取率Fig.1 Extraction rate of polysaccharides from Viola diffusa and V.principis
从4种受试菌的敏感性分析,大肠杆菌和枯草芽孢杆菌对蔓茎堇菜多糖较敏感,而其他2种受试菌的敏感性差,且枯草芽孢杆菌对6种乙醇用量提取的多糖敏感性都强于其他3种受试菌。说明蔓茎堇菜多糖的抗菌活性具有针对性。
比较抗真菌与细菌的抑菌圈发现,蔓茎堇菜多糖对枯草芽孢杆菌和大肠杆菌都有抑制能力,蔓茎堇菜多糖对黑曲霉和啤酒酵母无抗菌活性。由此可见,蔓茎堇菜多糖对细菌的抗菌活性强于真菌。

表2 蔓茎堇菜多糖抑菌圈直径(mm)Table 2 Diameter of inhibition zone of polysaccharide from Viola diffusa(mm)
2.2.2柔毛堇菜由表3可知,柔毛堇菜多糖抗菌活性不强,它仅对枯草芽孢杆菌和大肠杆菌有抑制能力,对其他2种受试菌并没有抗菌活性。
分析不同体积乙醇提取的多糖抗菌活性,发现3倍浓缩液体积乙醇提取的柔毛堇菜多糖对大肠杆菌抑制作用最强,抑菌圈可达9.13 mm,与浓缩液等体积乙醇提取的多糖抑制作用最弱,抑菌圈为7.39 mm;而对枯草芽孢杆菌抑制作用最强和最弱的分别是加入1倍和6倍浓缩液体积无水乙醇提取的多糖,抑菌圈分别为9.13 mm和8.75 mm。说明浓缩液中加入不同体积无水乙醇提取的多糖对大肠杆菌和枯草芽孢杆菌的抗菌能力不同。
从4种受试菌的敏感性分析发现,大肠杆菌和枯草芽孢杆菌对柔毛堇菜6种多糖都表现出较好的敏感性,其他2种受试菌则不敏感。
比较真菌和细菌的抑菌圈发现,柔毛堇菜多糖对黑曲霉和啤酒酵母均无抑菌活性,但对枯草芽孢杆菌和大肠杆菌具有一定的抑制能力。由此可知,柔毛堇菜多糖的抗细菌活性较强,抗真菌活性较差。

表3 柔毛堇菜多糖抑菌圈直径(mm)Table 3 Diameter of inhibition zone of polysaccharide from Viola principis (mm)
2.2.3两种堇菜多糖抑菌活性比较由表2、表3 可知,柔毛堇菜多糖对枯草芽孢杆菌的抗菌能力显著强于蔓茎堇菜(P=0.0280<0.05)。当无水乙醇与浓缩液的体积比大于3 时,柔毛堇菜多糖对大肠杆菌抗菌能力也比蔓茎堇菜强。对这两种堇菜多糖的抗菌活性的均值比较发现,柔毛堇菜多糖的抗菌活性强于蔓茎堇菜,且差异极显著(P=0.0042<0.01)。由此可见,柔毛堇菜多糖的抑制细菌能力强于蔓茎堇菜。从大肠杆菌和枯草芽孢杆菌对堇菜多糖的敏感性分析,枯草芽孢杆菌对两种堇菜多糖比大肠杆菌敏感。无水乙醇与浓缩液的体积比对蔓茎堇菜多糖的抗细菌能力的影响较小。柔毛堇菜在无水乙醇与浓缩液的体积比为3 时抗大肠杆菌活性最强,蔓茎堇菜和柔毛堇菜多糖的抗细菌能力都在无水乙醇与浓缩液等体积时最强。由此可见,蔓茎堇菜和柔毛堇菜多糖的抗细菌能力相对比较稳定。
2.3 两种堇菜多糖抗氧化活性
2.3.1蔓茎堇菜由表4 可知,蔓茎堇菜多糖的抗氧化活性与无水乙醇的体积倍数存在一定关系。当比值为2 时抗氧化活性最强,为243.64 U·mL-1,当比值为6 时抗氧化活性最弱为172.99 U·mL-1。与上述抗菌能力结合分析,发现在蔓茎堇菜多糖中并不是所有物质都具有抗菌抗氧化活性。
2.3.2柔毛堇菜不同无水乙醇与浓缩液比值所提取的柔毛堇菜多糖抗氧化活性由强至弱顺序为:1 倍>2 倍>6 倍>4 倍>5 倍>3 倍。可见柔毛堇菜多糖的抗氧化活性与提取时所用的无水乙醇的量规律性不明显。结合其抑菌能力分析,认为柔毛堇菜多糖中可能只有某些物质具有较强的抑菌抗氧化活性。
2.3.3两种堇菜多糖的抗氧化活性比较柔毛堇菜多糖的抗氧化活性总体上极显著高于蔓茎堇菜多糖提取物的抗氧化活性(P=0.0015<0.01)(表4)。当无水乙醇与浓缩液等体积时相差最大,当两者体积比为3 时活性相近,进一步说明蔓茎堇菜和柔毛堇菜多糖中仅某些物质具有较强的抗氧化活性。柔毛堇菜多糖的抗细菌活性和抗氧化活性几乎都是无水乙醇与浓缩液等体积时最强,蔓茎堇菜多糖抗细菌活性在无水乙醇与浓缩液等体积时最强,而抗氧化活性以2 倍浓缩液体积时最强。这可能与柔毛堇菜和蔓茎堇菜的多糖物质在乙醇中的沉淀不同有关。
柔毛堇菜多糖抗细菌活性与抗氧化活性多数比蔓茎堇菜多糖强,且差异显著(P = 0.0315<0.05)。但在无水乙醇与浓缩液体积比为1~2 时柔毛堇菜多糖抗大肠杆菌能力比蔓茎堇菜多糖低,说明用水醇法提取的蔓茎堇菜和柔毛堇菜多糖的抗细菌活性与醇和浓缩液比例有关。在无水乙醇体积倍数相同的情况下,柔毛堇菜多糖的抗细菌跟抗氧化活性几乎都高于蔓茎堇菜。这说明从柔毛堇菜和蔓茎堇菜提取出相同的多糖物质,柔毛堇菜的该种物质的抗细菌抗氧化活性一般情况下都会高于蔓茎堇菜,由此可见柔毛堇菜所含多糖的抗菌抗氧化活性高于蔓茎堇菜。

表4 两种堇菜多糖的抗氧化活性(U·mL-1)Table 4 Antioxidant activity of polysaccharides from two kinds of Viola (U·mL-1)
3 讨论
多糖提取方法有多种,如溶剂提取法、超声波辅助提取法、微波法、酶提取法、超临界流体萃取法等[21],其中溶剂提取法的水醇沉淀法是应用最广泛、最普遍的一种。根据任国平等[22]对葡萄多糖的研究可知,乙醇用量对多糖的提取率有影响。而多糖的溶解度对其生物活性有一定的影响[23]。本研究证实无水乙醇的用量会影响蔓茎堇菜和柔毛堇菜多糖的提取率,但对两种堇菜多糖的抗氧化活性和抑菌作用是否有影响还有待后续研究。
中草药所含多糖类物质有多方面活性,比如抗病毒、降血糖、抗炎、抗肿瘤等[24]。由抑菌实验可知,柔毛堇菜和蔓茎堇菜多糖都具一定的抑菌能力。与滕蓉[25]的研究比较发现,柔毛堇菜和蔓茎堇菜多糖对枯草芽孢杆菌的抑制活性接近鬼针草,但对大肠杆菌的抑制活性高于鬼针草。由此说明,蔓茎堇菜和柔毛堇菜在民间作药用可能与其抑菌能力有关。
此外,大量研究表明,中草药的药理作用与其抗氧化活性密切相关[26]。蔓茎堇菜水提物的黄酮类物质对羟自由基具有良好清除效果,且浓度越高清除率越高[8]。本实验也表明,蔓茎堇菜也具有一定的抗氧化能力。比较杨晓杰等[27]的研究,柔毛堇菜和蔓茎堇菜对羟基自由基的清除率强于桔梗Platycodon grandiflorus微波提取物。进一步说明在民间蔓茎堇菜和柔毛堇菜作为药用也可能与其抗氧化活性有关。
比较两种堇菜多糖的抗菌抗氧化活性,柔毛堇菜总体上优于蔓茎堇菜,且王贝[28]的研究发现,同属不同种的贯众抗菌抗氧化活性差异不显著。但本实验的结果却表明同属不同种的堇菜其抗菌抗氧化活性存在显著差异。根据徐鸿涛[29]对长鄂堇菜V.inconspicua多糖的研究表明多糖的浓度也会影响其抗氧化和抑制细胞增殖能力,故具体的影响因素还需进一步研究。