滇黄精不定芽增殖与生根诱导条件的优化
张 铁,杨永超,孔 鑫
(1.文山学院 科研与成果转化中心,云南 文山 663099;2.文山州生物资源开发研究中心,云南 文山 663099;3.文山州农业科学院,云南 文山 663099;4.文山学院 环境与资源学院,云南 文山 663099)
滇黄精(Polygonatum kingianumColl.et Hemsl.)为百合科黄精属多年生草本植物,又名节节高、仙人饭,主要分布在云南、广西等地[1]。滇黄精以根茎入药,除含有黄精多糖、甾体皂苷、类黄酮等活性物质外,还含有生物碱、木脂素类化合物、蒽醌类化合物及多种人体必需的氨基酸和微量元素[2],具有免疫激发、免疫促进、抗辐射、抗肿瘤、抗衰老、降血糖、降血脂、抗疲劳、耐缺氧等作用,在临床上用于治疗糖尿病、冠心病、高脂血症、肺结核、淋巴结核、白细胞减少、腹泻、便秘、失眠等多种症病[3],具有较高的保健及药用价值。近年来,随着市场需求增加,对野生黄精资源产生了巨大压力,故黄精人工栽培对满足市场需求,缓解野生黄精生存压力及保持野生黄精种质资源的多样性具有重大意义。
黄精可用种子和营养器官进行繁殖,但种子繁殖时出苗率低、苗期长,而用块茎繁殖则繁殖系数低[4],长期使用块茎无性繁殖还会面临种性退化的风险,故这两种方法均不利于黄精规模化种植。组织培养技术能高效地提供优质种苗,可有效解决滇黄精规模种植中种苗的问题。滇黄精的根状茎、叶、花药[5]、根茎嫩芽[6]、种子[7]均可作为外植体,而对增殖培养和生根培养的研究报道较少,增殖系数及生根系数均不甚理想。
本研究以愈伤组织诱导的不定芽为材料,采用正交试验的方法对增殖培养基和生根培养基进行优化,以提高增殖及生根效率,为滇黄精种苗快速繁育提供依据。
1 材料与方法
1.1 试验材料
试验用滇黄精愈伤组织诱导的不定芽由文山学院生物资源开发研究中心实验室提供。选用同一批次、长势良好、大小近似的滇黄精不定芽为材料。
1.2 试验方法
1.2.1 增殖培养基优化
以MS为基本培养基,6-BA、KT、多效唑的质量浓度设置见表1,试验采用L9(34)正交设计。选取优质的丛生芽,在超净工作台中切为大小相仿的丛生芽块接种在不同激素浓度配比的MS培养基上进行增殖,每瓶接种3个茎段,每处理接种10瓶,50 d后统计不定芽的增殖情况。增殖系数=芽的平均数/接种数×100%,平均增殖数=增殖芽数/接种芽数。
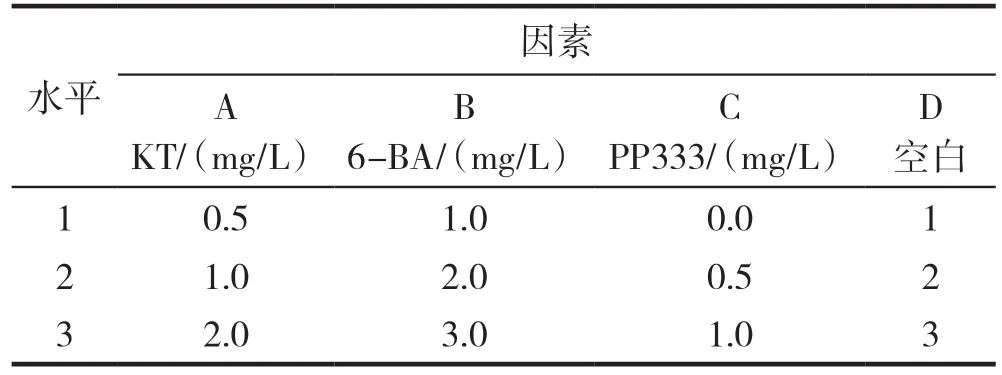
表1 增殖培养基优化正交试验因素水平表
1.2.2 生根培养基优化
生根培养基以MS、NAA和IBA浓度为因素,试验采用L9(34)正交设计,其浓度设置见表2,每个处理接种10瓶,每瓶3个茎段。40 d后取出组培苗,洗净培养基测量每瓶中每丛的生根数及根长。生根系数=生根总数/接种数×100%,生根率=生根苗数/接种苗数×100%。
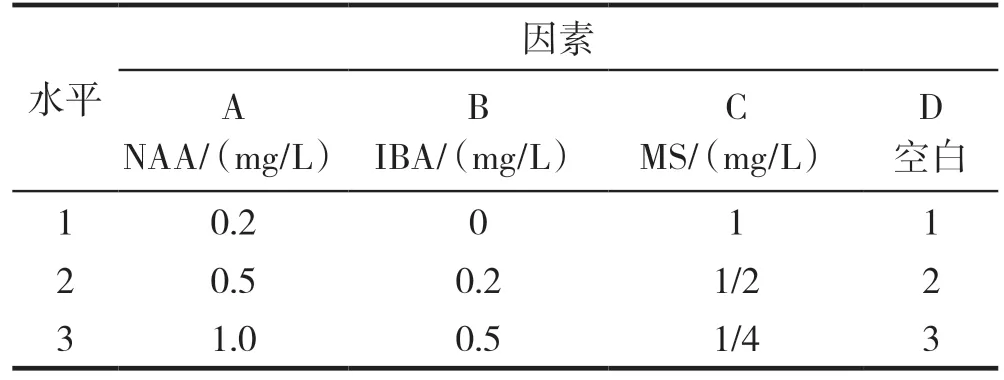
表2 生根培养基优化正交试验因素水平表
1.2.3 培养条件
不同处理的培养基蔗糖浓度为30 g/L,琼脂粉5.8 g/L,PH调至5.8。培养温度为(25±1)℃,光照强度2 500 Lx,光照时间12 h/d。
1.2.3 统计分析
采用SPSS10.0进行相关数据处理及方差分析。
2 结果
2.1 增殖培养基优化
培养10 d左右,滇黄精开始有芽出现,随后芽的数量进一步增多,并逐渐伸长,50 d后统计各处理的增殖情况,其结果见图1和表3。
直观分析表明,影响滇黄精增殖系数的因素主次顺序为 B(6-BA)>C(PP333)>A(KT),培养基最佳配方为A3B2C3,即KT 1.0 mg/L,6-BA 2.0 mg/L,PP3331.0 mg/L。经方差分析,A2B2C3与A1B2C2、A3B2C1在0.05和0.01水平上差异均不显著,但A2B2C3、A1B2C2和A3B2C1与其它6个处理在0.05水平上差异显著。由于最佳条件的培养基不在正交试验中,在后续验证试验中,我们比较了A3B2C3培养条件与A2B2C3培养条件,A3B2C3的增殖系数达6.91,而A2B2C3为6.57,并且在0.05水平上差异显著。
图1 滇黄精不定芽继代增殖
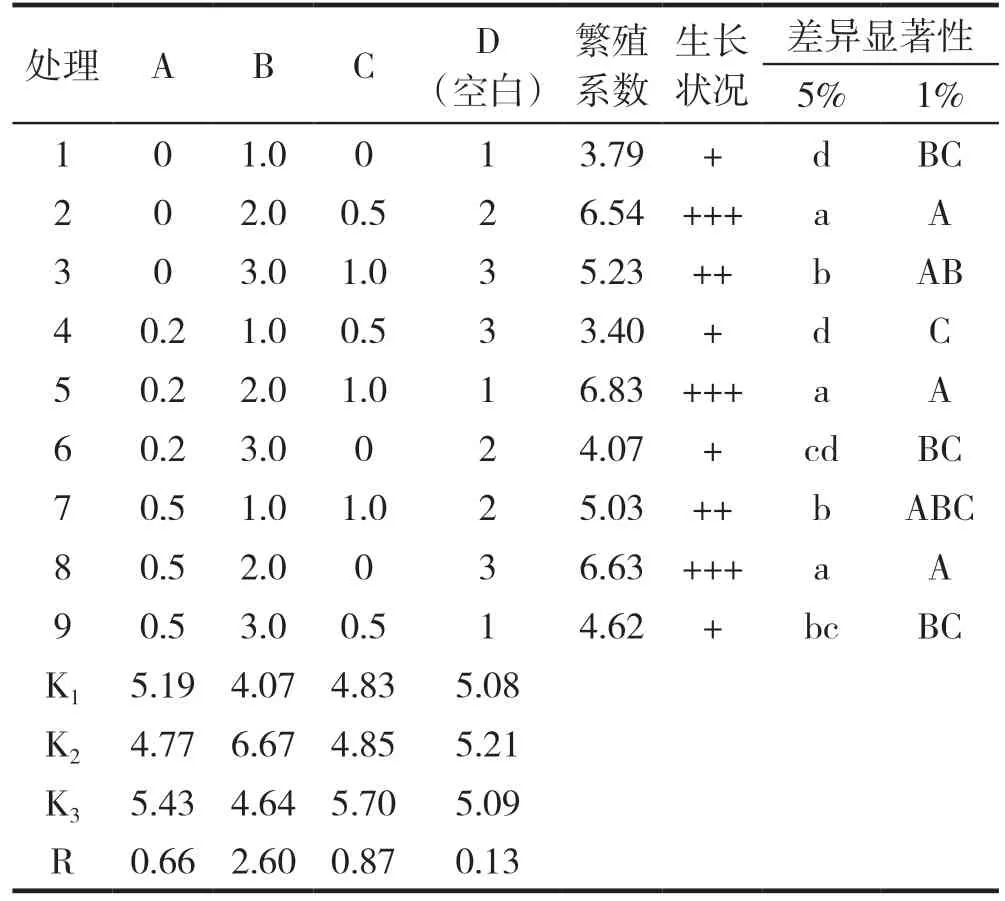
表3 增殖培养基正交试验优化结果
2.2 生根培养基优化
经过15 d左右的培养,滇黄精茎段出现根系,随后根的数量进一步增多。50 d后统计各处理的生根情况并对根系生长情况进行评价,其结果见图2和表4。直观分析显示,影响滇黄精生根的因素主次顺序为 A(IBA)>C(MS)>B(NAA),A2B2C3表现最佳,即IBA 0.2 mg/L+NAA 0.2 mg/L+1/4 MS,生根系数达7.83,并且生根率为100%,根系粗壮,根量多,苗健壮。同时,A2B2C3与其它8个处理在5%水平上差异显著。
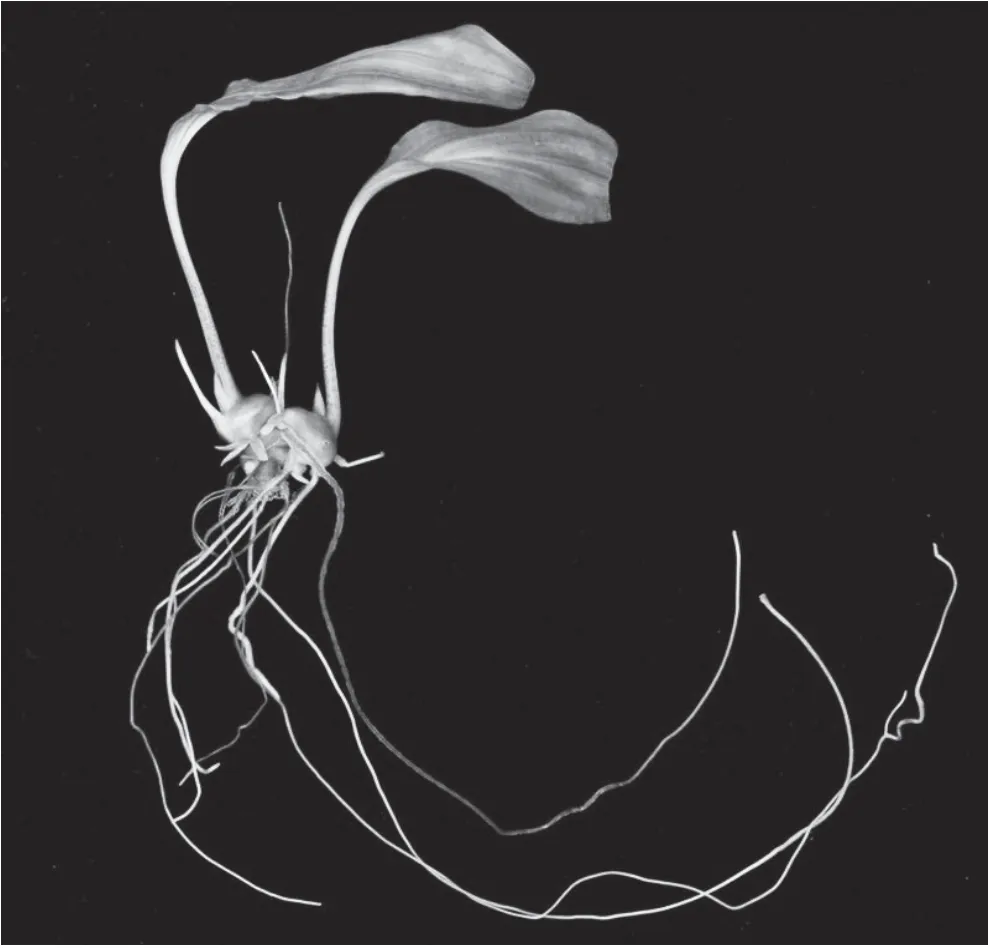
图2 滇黄精壮苗生根
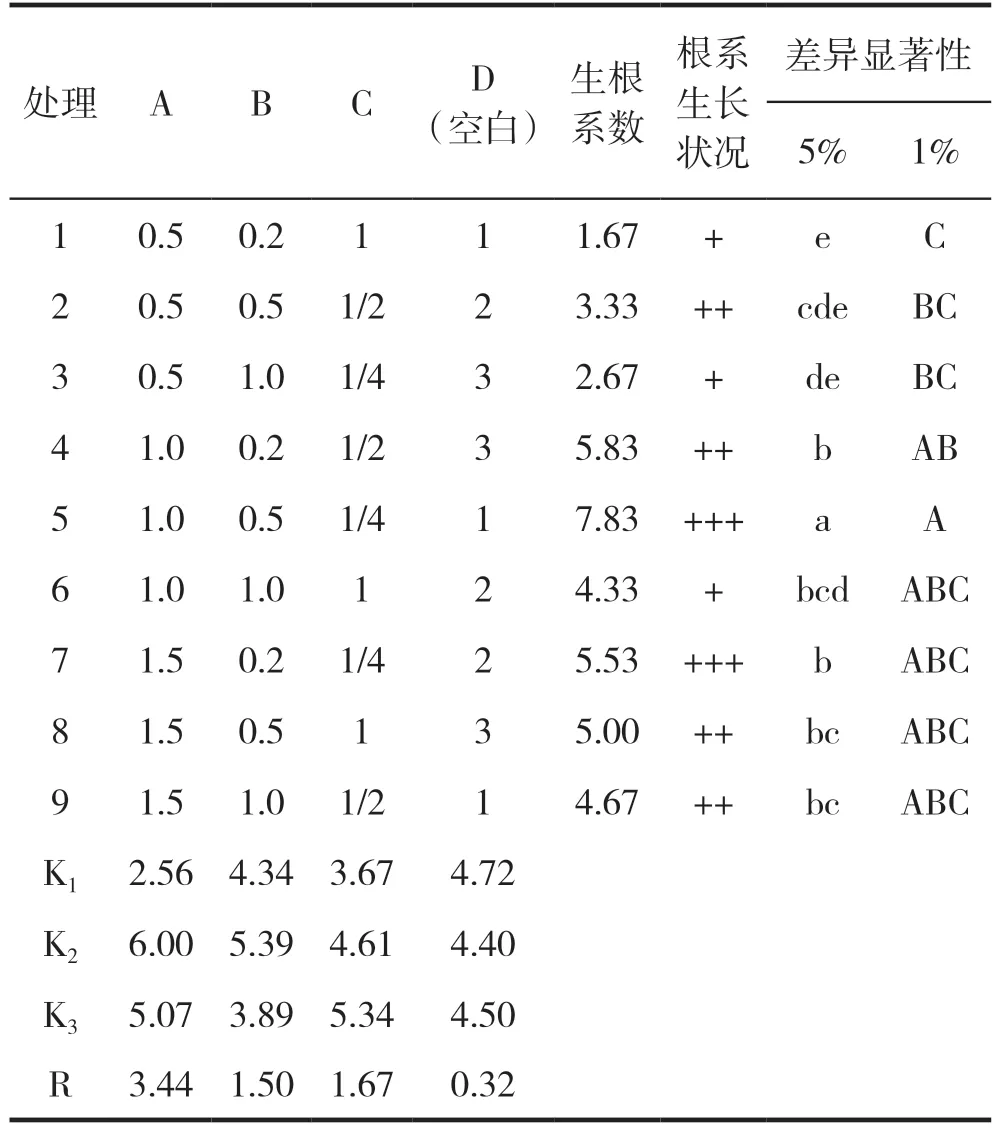
表4 生根培养基正交试验优化结果
3 讨论
本研究采用正交试验的方法对滇黄精继代增殖与生根培养条件进行了优化,对于滇黄精继代增殖培养基,KT 1.0 mg/L+6-BA 2.0 mg/L+多效唑1.0 mg/L组合表现最佳,并且在验证试验中验证了其效果,其增殖系数达6.91。许丽萍等[6]以1/2MS+KT 2 mg/L作为滇黄精增殖培养基,增殖系数为4.12,但芽较细小。张智慧等[7]研究了BA和NAA对滇黄精增殖的影响,培养基MS+BA 4.0 mg/L+NAA 0.2 mg/L表现较好,增殖系数为3.85,芽长势较好。可以看出,以KT、BA和多效唑的组合较单用KT或BA+NAA的增殖效率要高。PP333通过调节植物体内的激素平衡,在植物的生长过程中可发挥促进分枝及分蘖,控长矮化,提高叶绿素含量,它对于提高植物抗逆性和壮苗生根等有重要的作用[8],目前PP333已用于小麦、水稻、玉米、猕猴桃、香蕉、油梨、葡萄等植物的花粉愈伤诱导及分化、试管苗保存、壮苗培养、胚挽救方面,并取得了较好的效果[9]。我们首次报道了多效唑用于滇黄精芽的增殖,并且增殖效果较为理想,这为PP333用于滇黄精工厂化育苗提供了试验依据。
在本研究中,以IBA 0.2 mg/L+NAA 0.2 mg/L+1/4 MS为生根培养基,生根系数达7.83,并且生根率为100%,根系粗壮,根量多。张智慧等[7]以MS+NAA 0.5 mg/L和MS+IBA 0.5 mg/L为滇黄精生根培养基,生根率达100%,前者不定根生长较多,根系较长而细,后者不定根较短而粗,但并未给出生根系数。许丽萍等[6]报道了1/2MS+IBA1.0 mg/L+NAA 0.5 mg/L+CA 0.5 g/L为生根培养基,其生根率为67%,生根系数为1.77,该报道与本研究都使用了NAA和IBA,但生根率及生根系数差异较大,这可能跟激素浓度、所选材料及材料的基因型不同有关。根据我们的研究结果及前人研究结果,滇黄精生根选用IBA和NAA激素为佳。

