Lactobacillus brevis对发酵风干肠理化品质的影响
赵茉楠,韩齐,俞龙浩,程天赋,邓洁,赵家园
(黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319)
哈尔滨风干肠作为一类传统北方发酵肉制品,目前仍以自然发酵为主,不足之处是生产周期长和不利微生物的生长,导致产品变色、产生异味、腐败变质和有毒化合物的积累等问题,带来极大的安全隐患[1]。将微生物经过纯培养获得的发酵剂直接投入到发酵当中,避免了自然发酵过程中存在的不可控性,使产品的安全性和稳定性均得到提高[2],改善了组织和风味[3]。其中乳酸菌作为发酵肉制品中最常见的微生物,产生的细菌素类物质可对腐败菌和致病菌的生长繁殖起到有效的抑制作用[4];在发酵过程中,内源性蛋白酶和乳酸菌的水解作用影响着肌肉蛋白质的降解,乳酸菌产酸代谢作用可进一步促进风干肠中蛋白质的降解,增加产品的风味和提高消化吸收速率[5];肌肉蛋白发生不可逆变性,肉制品的组织结构改变[6]。
早在1940年Jessen和Peddock就研究得出乳酸杆菌发酵剂可有效缩短发酵香肠的生产周期,提高产品的风味。国外将乳酸菌应用于发酵肉制品的人工发酵工业化生产加工中,工艺及技术也已趋于成熟化[7,8]。Andreja等人[9]研究表明清酒乳杆菌和木糖葡萄球菌可显著提高干发酵香肠中油酸和亚油酸等游离脂肪酸的含量,从而改善了产品的营养和风味。我国发酵剂的研究起步较晚,还未将其应用于大规模工业化生产中[10]。目前国内关于哈尔滨风干肠的研究集中在以下几个方面:对风干香肠中乳酸菌的分离鉴定及益生特性研究[11];乳酸菌发酵剂对风干肠风味品质的影响[12,13];弯曲乳杆菌对风干肠发酵过程中亚硝胺降解及其理化性质的研究等[14]。而将乳酸菌应用于风干肠中对其品质进行研究报道的却较少,本实验采用前期从自然发酵风干肠中分离获得的1株短乳杆菌,作为发酵剂应用于风干肠中,研究其对风干肠理化品质方面的影响情况,为发酵肉制品的生产加工过程提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊肉和猪背部脂肪:购于当地超市;肠衣:猪小肠衣;风干肠加工用辅料:食盐、葡萄糖、味精、亚硝酸钠、曲酒(玉泉大曲)、混合调料(包括桂皮、花椒、大料、丁香等)等:购于当地食品添加剂商店。
短乳杆菌(L.brevis):分离并保存于东北农业大学肉制品实验室。通过前期的分离鉴定以及发酵性能的测定,获得了1株性能优良的乳酸菌。
1.2 仪器与设备
Specord 210 Plus紫外-可见分光光度计 德国耶拿分析仪器有限公司;Seven Multi pH S40测试仪 瑞士梅特勒-托利多仪器有限公司;CR-410色差仪 日本Konica Minolta公司;NMI20-15 核磁共振食品成像分析仪 苏州纽迈分析仪器股份有限公司;TA-XT2i 质构仪 英国SMSTA公司;HWS-250恒温恒湿培养箱 上海森信实验仪器有限公司;LD2X-50KBS高压灭菌锅 上海申安医疗器械厂;FA25 乳化均质机 德国Fluko公司;5417R离心机 德国Eppendorf公司。
1.3 风干肠的制作方法
制作流程:原料肉(猪里脊)→切丁(1 cm3的肉丁)→辅料混合处理→拌馅(加入乳酸菌)→灌肠→风干(12 h)→发酵(9 d)。
灌制好的风干肠在相对湿度为30%~50%、发酵温度为(25±2) ℃的条件下风干12 h,然后放置在发酵室进行发酵,发酵湿度为75%~80%,发酵温度为(25±2) ℃,分别在发酵期的第0,3,6,9天取样并测定相关指标(核磁为9 d的测定结果)。
处理组为添加短乳杆菌发酵剂生产的风干肠,并采用平板计数法测量菌数,在拌馅过程中添加乳酸菌(乳酸菌的终浓度约为107CFU/g肉馅),对照组为没有人工添加发酵剂的天然发酵风干肠。
1.4 指标的测定
1.4.1 pH值的测定
称取5.0 g样品,剥去外表面肠衣,放入200 mL的锥形瓶中,同时加入45 mL蒸馏水进行均质过滤处理,最后取滤液测定pH值。
1.4.2 色差的测定
使用色差仪进行测定,检测前用标准白板校准标准S-CAL,光源采用D65/2°,检测模式为反射模式。风干肠剥去肠衣,切碎,样品均匀铺满比色杯的底部,保证样品和比色杯底部没有空隙,测定样品的红度值a*和亮度值L*。
1.4.3 水分含量的测定
根据GB/T 5009.3-2003的恒温干燥法进行测定[15]。
1.4.4 水分分布的测定
参照Gao Tian等[16]的方法,剥去风干肠的肠衣,切碎,准确称取2 g风干肠肉样,放入核磁管底部进行水分分布的测定。采用低场核磁共振(low field nuclear magnetic resonance,LF-NMR)成像分析仪的Q-CPMG队列对横向弛豫时间(T2)进行测定,测定参数:测试温度28 ℃,共振频率24 MHz,时间常数(τ)0.15 ms,重复间隔时间3000 ms,模拟增益20。
1.4.5 质构的测定
将样品切成约50 mm长,每个样品做5个平行,采用质构剖面分析方法(texture profile analysis,TPA)对硬度、胶黏性、弹性、粘结性、黏性和咀嚼性进行测定,使用P/50探头及配套台面,测定参数:测前速度5.0 mm/s、测中速度2.0 mm/s、测后速度2.0 mm/s、时间间隔5 s。
1.4.6 感官评价
将风干肠蒸煮20 min后切成约为0.5 cm的厚度,评定小组由随机邀请的10位专业人员组成,采用双盲法对风干肠的颜色、气味、滋味、酸味、口感和总体可接受性进行综合评价(1~7分)。
1.5 统计分析
采用Statistix 8.1软件进行数据统计分析和差异显著性分析(P<0.05);采用SigmaPlot 12.5作图软件绘图。所有实验均重复5次,每个处理组做5个平行,数据表示为平均值±标准差。
2 结果与分析
2.1 风干肠pH值测定结果
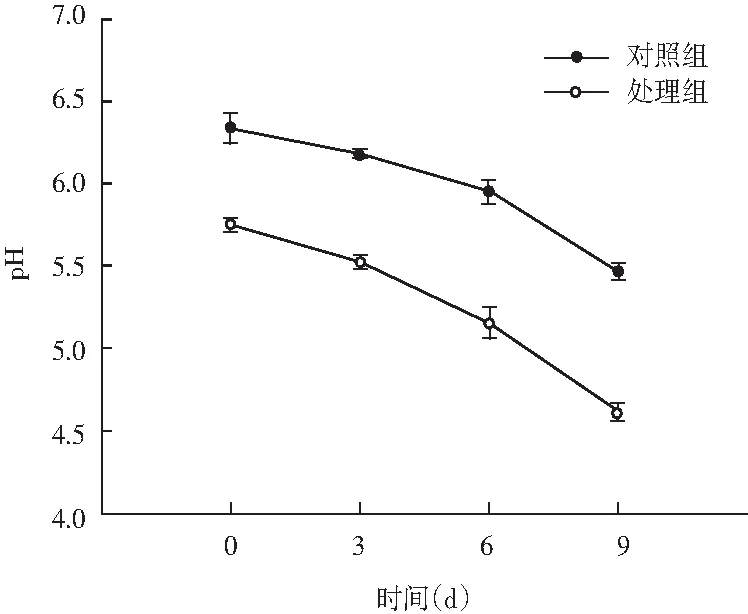
图1 风干肠在发酵过程中pH值变化Fig.1 Changes of pH value of the air-dried sausage in fermentation process
pH值是监测肉类发酵过程的一个重要参数。由图1可知,随着发酵时间的延长,对照组和处理组二者之间差异显著(P<0.05)。发酵前期对照组的乳酸菌处于相对竞争阶段,产酸缓慢,在第3天时pH值才逐渐下降,在第9天时pH下降至5.4左右。处理组中短乳杆菌的添加,使其迅速成为风干肠中的优势菌群,大量产酸,pH值快速降低,pH值在第3天时就达到了5.20左右,发酵后期pH下降至4.5左右,显著低于对照组(P<0.05)。通常发酵香肠pH降至4左右即可完成发酵过程,由此可见风干肠的生产条件适合短乳杆菌更好地生长繁殖,通过快速产酸来使发酵周期缩短,同时pH值的快速降低可有效地抑制致病菌和腐败菌,将有利于提高产品的安全性。Lee等人[17]报道,乳酸菌通过产生大量乳酸,使发酵肉制品中的pH值降低,同时产品的风味、颜色和质地得到很大的提高。Chen等人[18]研究表明pH值低于4.5利于肌原纤维蛋白的降解。
2.2 风干肠水分含量测定结果
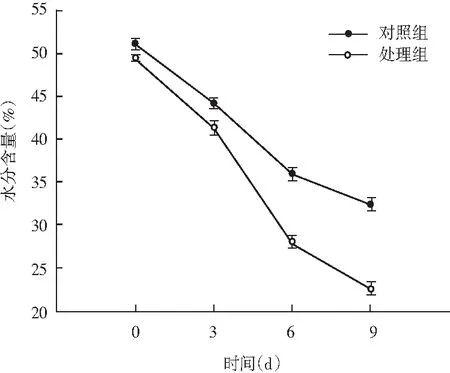
图2 风干肠在发酵过程中水分含量变化Fig.2 Changes of moisture content of the air-dried sausage in fermentation process
由图2可知,水分含量变化整体呈现下降趋势,发酵初期第0天时水分含量均在50%左右,第3天处理组水分含量为42%,对照组水分含量为44%,二者之间变化差异不显著(P>0.05);随着发酵时间的延长,第9天时处理组和对照组水分含量分别是21%和32%,变化差异显著(P<0.05)。处理组中的随着短乳杆菌大量生长繁殖,形成较低的pH值,风干肠内部蛋白质发生凝胶化作用,导致持水能力下降,结合水逐步转化为自由水,水分向外部环境扩散的速率随之加快,水分严重损失。同时风干肠中较低的水分含量可有效抑制腐败菌和病原菌,对发酵风干肠生产有利。
2.3 LF-NMR T2分析风干肠中水分分布情况测定结果

图3 风干肠在发酵结束后横向弛豫时间T2变化情况Fig.3 Changes of transverse relaxation time T2 after the end of fermentation of air-dried sausage
利用低场核磁共振(LF-NMR)T2弛豫研究水分分布和水分在肉中的流动性,反映出蛋白质内部结构变化对水分分布的影响[19]。由图3可知,T2弛豫时间曲线上出现了4个峰,分别为:强结合水T20(弛豫时间0~1 ms)、结合水T21(弛豫时间1~10 ms)、不易流动水T22(弛豫时间10~100 ms)和自由水T23(弛豫时间100~1000 ms)。实验结果显示,处理组的T21和T22均低于对照组,可能是由于酸性条件下,乳酸菌和风干环境的共同作用最终导致蛋白质变性,肌原纤维遭到破坏,水分大量流失。Bertram等[20]发现发酵肉制品的脱水与肌动蛋白变性有关,水分流动性与特定的蛋白质变性有关。

表1 风干肠发酵结束后(第9天)横向弛豫时间T2变化情况Table 1 Changes of transverse relaxation time T2 after the end of fermentation of air-dried sausage (the 9th day)
注:同行大写字母不同,表示不同处理组相同发酵时间风干肠弛豫时间T2差异显著(P<0.05)。
肉样的NMR T2谱4个峰中T20、T21、T22、T23分别包含2个指标(见表1),即峰顶点时间、峰面积。结果显示处理组中T20峰顶点时间与对照组相比显著增加(P<0.05),而T21、T22、T23峰顶点时间均无统计学影响,对T20、T21、T22、T23峰面积也无显著影响。与对照组相比,处理组中结合水含量较低,不易流动水含量较高,自由水未检出,这可能与加入短乳杆菌后,较低的pH值环境下风干肠内部蛋白质变性,组织结构发生变化相关[21],结合水流出转化为不易流动水,同时吸附在香肠表面的水分蒸发到空气中[22],自由水大量流失。
2.4 风干肠颜色测定结果
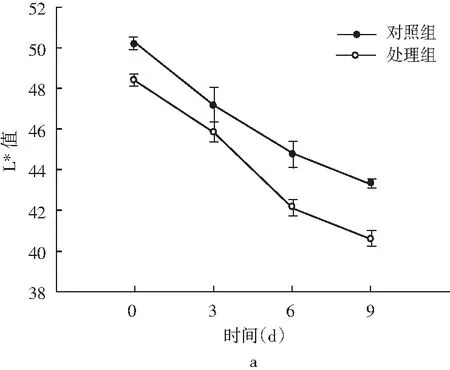
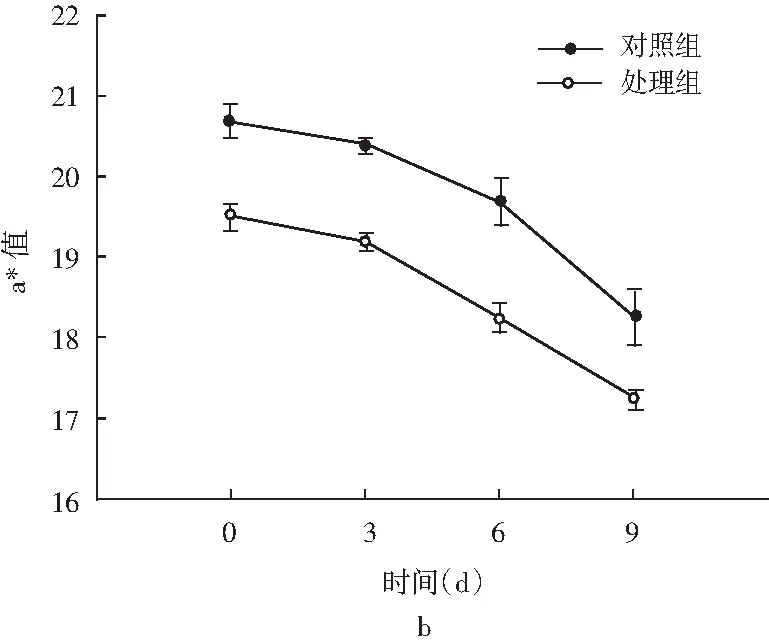
图4 风干肠在发酵过程中L*和a*的颜色变化Fig.4 Color changes of L* and a* in the fermentation process of air-dried sausage
色泽是评价发酵肉制品的重要感官指标,对引起消费者的购买欲望起着尤为重要的作用。一般将亮度值(L*值)和红度值(a*值)作为进一步的评定指标。由图4可知,发酵初期对照组和处理组的L*值表现出差异不显著(P>0.05),发酵后期处理组的L*值显著低于对照组(P<0.05),分析这主要与水分含量相关,水分含量越少,L*值越低[23];发酵过程中a*值呈下降趋势,且显著低于对照组(P<0.05)。分析可能是乳酸菌对还原类细菌(如葡萄球菌)产生一定的抑制作用[24],在色泽形成过程中阻碍了NO3-进一步还原分解为NO,发酵肉制品红度值降低[25]。薛冰等人[26]研究将植物乳杆菌和地衣芽孢杆菌复配加入牛肉火腿中,在25 ℃发酵时的L*值(56.29)和a*值(21.77)均显著高于商业发酵剂组,表明乳酸菌对色泽的影响可能还与发酵温度有关,同时还需考虑和其他菌株复配使用,需要进一步研究。
2.5 风干肠中质构测定结果
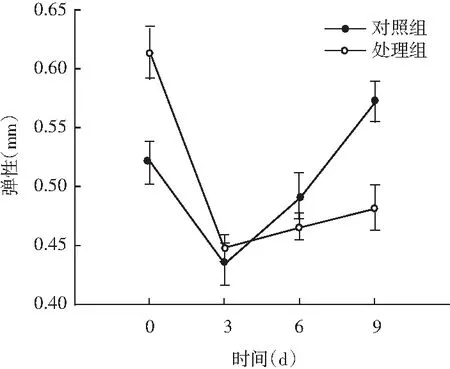


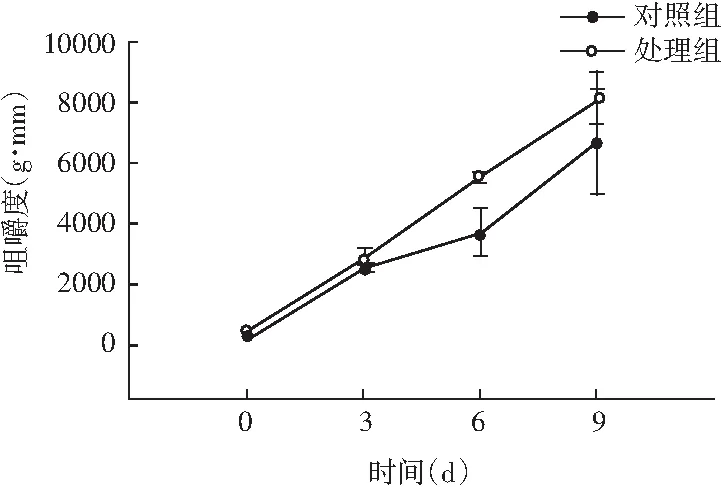
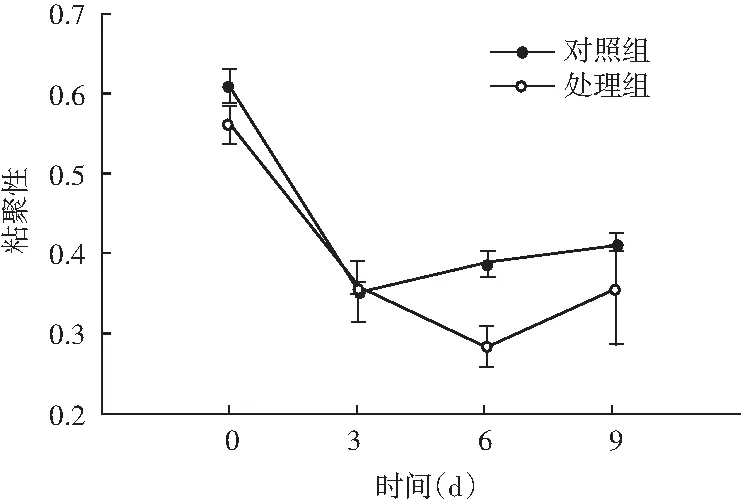
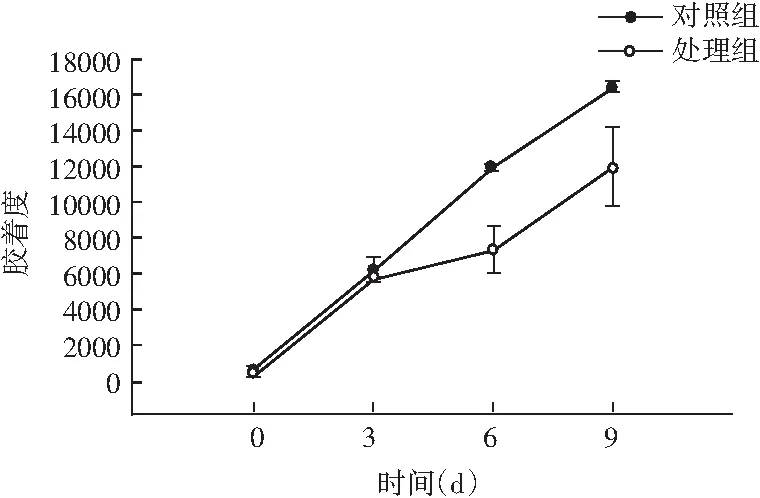
图5 风干肠在发酵过程中弹性、硬度、回复性、咀嚼度、粘聚性、胶着度的变化情况Fig.5 Changes in elasticity, hardness, resilience, chewiness, cohesiveness, adhesiveness of the air-dried sausage during fermentation
随着理化性质的改变,物性学特征也发生变化。由图5可知,发酵前期处理组弹性值显著高于对照组(P<0.05),随着发酵时间的延长,弹性值显著低于对照组(P<0.05);同时风干肠的硬度和咀嚼度在发酵过程中整体呈现上升趋势,处理组与对照组相比,均表现出发酵前3 d差异不显著(P>0.05),3 d后显著高于对照组(P<0.05);回复性整体呈现下降趋势,发酵后期处理组回复性显著高于对照组(P<0.05);分析原因可能是发酵中期乳酸菌大量繁殖,产生乳酸,pH迅速降低,肌肉蛋白质的保水性不断下降,水分流失越严重,硬度越大,同时伴随着产品本身咀嚼性增大、弹性降低。处理组粘聚性和胶着度值显著低于对照组(P<0.05),主要是由于发酵后期乳酸菌作用,导致肌肉蛋白质变性结构松散。
2.6 感官评价
由图6可知,在蒸煮20 min之后,处理组酸度值显著高于对照组(P<0.05),但处理组具有风干肠特有的浓郁气味,酸味柔和,未发现因乳酸菌加入而形成厚重的酸味。处理组滋味、口感和总体可接受性的评分结果均略高于对照组,但差异不显著(P>0.05)。可知加入短乳杆菌的风干肠并没有影响产品的气味和口感,易于接受,可能是由于乳酸菌水解蛋白质和脂质,产生的游离氨基酸类、醛酮类风味物质以及发生酯化反应[27],促进了发酵过程中风味更好地形成。

图6 感官评价Fig.6 Sensory evaluation
3 结论
将短乳杆菌作为发酵剂运用于发酵风干肠的生产中,发酵后期pH下降至4.5左右,显著低于对照组(P<0.05),可快速促进发酵风干肠的成熟,使得发酵周期缩短3 d,有利于提高产品的安全性。处理组第9天的水分含量为21%,显著低于对照组(P<0.05)。对风干肠进行水分分布的测定得出处理组中结合水含量较低,不易流动水含量较高,自由水未检出;在发酵后期,加入乳酸菌的风干肠的硬度、咀嚼度和回复性显著高于对照组(P<0.05),弹性、粘聚性和胶着度显著低于对照组(P<0.05),总体可接受性更高,但由于其对产品的色泽会产生不良影响,应考虑与其他发酵剂进行复配使用,来弥补单一发酵剂的不足。

