丹酚酸A与泼尼松联合治疗大鼠微小病变型肾病的协同增效作用
王学凯,李 新,冀 凯,刘 悦,杜世豪,岳 光,齐 栋,范华英
(1.烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005;2.烟台市毓璜顶医院肾内科,山东 烟台 264000)
微小病变型肾病(minimal change disease, MCD)是临床中最为常见的肾病综合征的一种病理类型,是导致肾小球疾病的常见病因之一[1].MCD临床特征以大量蛋白尿、低白蛋白血症以及高脂血症为主[2],目前主要以糖皮质激素类药物治疗,但大剂量或长时间使用糖皮质激素类药物常常伴有严重的不良反应[2].因此,寻找新的策略以改善现有治疗的疗效并减少其不良反应具有重要的临床价值.
目前,MCD的具体发病机制仍然不清楚.研究表明,MCD是多系统参与的疾病.近年来,炎症和氧化应激已经被证明在MCD的发生和发展中发挥重要作用[3-6].研究发现,MCD发病时,循环血液中促炎性细胞因子如血清白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)等急性时相反应蛋白水平增高[7],这些炎症介质可能参与或加重肾脏的损害,也可诱导其他细胞因子如白介素-1(IL-1)、白介素-2(IL-2)的产生和释放,进一步促进炎症的发生和发展,加重病情[8].此外,氧化应激也是MCD肾脏损伤的发生和发展中的重要因素.机体产生的过量活性氧簇(reactive oxygen species, ROS)破坏肾小球基底膜的完整性或减少足细胞粘蛋白的合成,导致肾小球滤过屏障的破坏[9].因此,调节炎症反应,改善氧化应激状态对于改善MCD的病变有着积极的作用.
基于MCD的复杂发病机制,多药联合在MCD的治疗中可能有着重要的优势.丹酚酸A(图1)是临床广泛用于肾病治疗的中药丹参的提取物[10],是丹参水溶物中含量最多的多酚类之一,也是丹参提取物中抗氧化能力最强的一种化合物[11],有着很好的成药性[12].经研究,丹酚酸A有很多药理活性,如抗炎[13]、抗氧化[14]、抗血小板聚集[15]等,且研究发现,丹酚酸A在多种肾脏疾病中都具有保护作用[11,16-17].因此,基于丹酚酸A的药理活性与MCD病理生理的联系,本研究利用阿霉素诱导的MCD模型评价丹酚酸A联合低剂量泼尼松对实验性MCD大鼠模型的保护作用,为丹酚酸A在临床MCD治疗中的开发和应用提供基础.
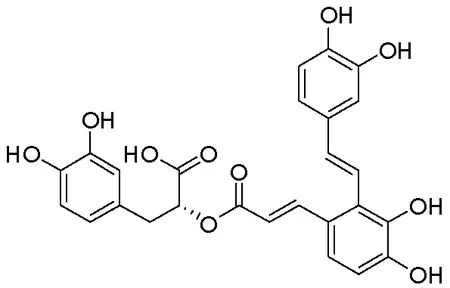
图1 丹酚酸A结构式
1 实验部分
1.1 实验材料
1.1.1 实验动物 雄性成年SD(Sprague-Dawley)大鼠(体重175±5 g)48只,购自山东省济南朋悦实验动物繁育有限公司,实验动物合格证No.0003609,许可证号:SCXK(鲁)2014007.所有实验用大鼠均在温度为24±1 ℃和湿度为55%±5%的条件下适应性饲养7 d,并给予自由饮食和饮水.本研究经过烟台大学动物伦理委员会批准,实验方案符合烟台大学动物伦理委员会的规定.
1.1.2 实验仪器与设备 透射电子显微镜(日本电子株式会社),全自动生化分析仪(上海安亭科学仪器厂),TGL-16G台式高速冷冻离心机(上海安亭科学仪器厂),-80 ℃超低温冰箱(青岛海尔股份有限公司),多功能酶标仪(美国Molecular Devices公司).
1.1.3 药品与试剂 丹酚酸A(纯度≥98%)由山东靶点药物研究有限公司提供;泼尼松来源于浙江仙琚制药股份有限公司;阿霉素购自深圳万乐药业有限公司;IL-1β测试盒、IL-6测试盒、TNF-α测试盒、CRP测试盒来自于厦门慧嘉生物科技有限公司;大鼠血清超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒来自于南京建成科技有限公司;大鼠血清丙二醛(malonaldehyde, MDA)检测试剂盒、BCA蛋白定量试剂盒来源于碧云天生物技术有限公司.
1.2 试验方法
1.2.1 实验动物分组 健康雄性成年SD大鼠48只,随机分为6组:空白对照组、模型组、高剂量泼尼松组、低剂量泼尼松组、丹酚酸A组、丹酚酸A+低剂量泼尼松组,每组8只.
1.2.2 实验造模及给药 参考相关文献[18],通过单次尾静脉注射阿霉素(7.5 mg/kg,溶于0.9%氯化钠溶液)制备MCD大鼠模型,空白对照组大鼠注射等容量的0.9%氯化钠水溶液,造模当日记为第 1天.第7天开始给予药物干预:(1)空白对照组:给予等剂量的0.9%氯化钠溶液灌胃及5%葡萄糖溶液尾静脉注射;(2)模型组:给予等剂量的0.9%氯化钠溶液灌胃及5%葡萄糖溶液尾静脉注射;(3)高剂量泼尼松组:以0.9%氯化钠溶液为溶媒配制泼尼松溶液,按照10 mg/kg的给药剂量通过灌胃给药,同时给予等剂量5%葡萄糖溶液尾静脉注射;(4)低剂量泼尼松组:以0.9%氯化钠溶液为溶媒配制泼尼松溶液,按照5 mg/kg的给药剂量通过灌胃给药,同时给予等剂量5%葡萄糖溶液尾静脉注射;(5)丹酚酸A组:以5%葡萄糖溶液为溶媒配制丹酚酸A溶液,按照10 mg/kg的给药剂量通过尾静脉给药,同时给予等剂量0.9%氯化钠溶液灌胃;(6)丹酚酸A+低剂量泼尼松组:给予5 mg/kg的泼尼松灌胃给药以及10 mg/kg的丹酚酸A尾静脉给药.所有药物均为每日单次给药,连续给药21 d.
1.3 检测指标
1.3.1 24 h尿蛋白含量检测 实验期间,利用代谢笼收集大鼠第3、7、14、21、28天24 h尿液,收集尿液期间对大鼠禁食不禁水.收集的尿液在1 000×g的离心力下离心15 min,取上清液进行尿蛋白含量检测.尿蛋白含量利用BCA蛋白定量试剂盒检测,实验步骤严格按照试剂盒的说明书进行,最后,计算样本中蛋白含量.
1.3.2 血生化指标检测 实验结束时,从腹主动脉取血8 mL,室温下静置2 h后,在1 000×g的离心力下离心15 min,取上清液即为血清.利用全自动生化分析仪检测血清总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、甘油三酯(TG)、血肌酐(SCr)、血尿素氮(BUN).
1.3.3 电镜观察肾组织超微结构 实验结束时,取大约1 mm3体积的肾脏肾皮质组织,在2.5%戊二醛溶液、2%四氧化锇溶液中依次固定,然后在乙醇和丙酮中梯度脱水,最后进行环氧树脂包埋、切片.超薄切片经过柠檬酸铅和双氧铀染色后置于透射电镜下观察.
1.3.4 IL-1β和IL-6、TNF-α、CRP的含量测定 使用IL-1β、IL-6、TNF-α、CRP ELISA试剂盒检测血清中IL-1β、IL-6、TNF-α、CRP含量,实验步骤严格按照试剂盒说明书进行,最后计算血清样本中各蛋白含量.
1.3.5 肾组织SOD活性和MDA含量的测定 肾皮质组织置于冰浴中的PBS缓冲液中进行匀浆,随后在12 000×g的离心力下离心10 min并吸取上清液以备后续检测.使用SOD和MDA检测试剂盒进行检测,实验步骤严格按照试剂盒说明书进行,最后计算肾组织样本中SOD的活性和MDA的含量.
1.4 药物联合作用评价
丹酚酸A与低剂量泼尼松的联合作用分析采用Webb分数乘积法:
q=(fa)1,2/{1-[1-(fa)1][1-(fa)2]}.
其中,(fa)1,2为丹酚酸A和低剂量泼尼松联用时的效应,(fa)1和(fa)2分别为两药单用时的效应,其剂量分别为联用中的剂量.q=1为相加作用,q> 1为协同作用,q<1为拮抗作用.
1.5 统计方法
2 实验结果
2.1 丹酚酸A与低剂量泼尼松联合对大鼠24 h尿蛋白含量和血生化指标的影响
为了评估丹酚酸A与低剂量泼尼松联合对MCD的主要症状即蛋白尿、低白蛋白血症、高脂血症的影响,收集了大鼠的尿液和血液样本进行各项检测.阿霉素尾静脉注射造模后,与空白对照组相比,模型组大鼠24 h尿蛋白含量以时间依赖的方式持续上升,在第28天产生大量的尿蛋白,联合丹酚酸A与低剂量泼尼松可以显著降低第3周和第4周的尿蛋白和升高血清总蛋白含量,比丹酚酸A与低剂量泼尼松单用效果更加显著,Webb分数乘积q值分别为1.16(第3周)和1.22(第4周),显示两药对尿蛋白的缓解有协同作用(表1).
此外,与空白组大鼠相比,模型组大鼠的血清白蛋白明显降低,而甘油三酯水平和总胆固醇水平明显升高.联合治疗显著升高大鼠血清白蛋白水平,降低甘油三酯和总胆固醇含量,效果优于丹酚酸A和低剂量泼尼松单用(表2).这些数据表明丹酚酸A和低剂量泼尼松联合治疗对MCD的主要症状有着显著的治疗效果.

表1 丹酚酸A与低剂量泼尼松联合对不同时间点24 h尿蛋白含量的影响
注:与空白对照组相比,##P< 0.01;与模型组相比,*P< 0.05,**P< 0.01;括号中为联合用药的q值.

表2 丹酚酸A与低剂量泼尼松联合对血生化指标的影响
注:与空白对照组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01.
2.2 丹酚酸A与低剂量泼尼松联合对大鼠肾功能的影响
为了评估丹酚酸A与低剂量泼尼松联用对MCD大鼠肾功能的影响,检测了血清SCr和BUN含量.与空白对照组大鼠相比,模型组大鼠血清SCr和BUN的含量明显升高;与模型组相比,丹酚酸A与低剂量泼尼松联合治疗明显降低了血清SCr和BUN的水平(表2).这表明丹酚酸A与低剂量泼尼松联合具有一定的保护肾功能的作用.
2.3 丹酚酸A与低剂量泼尼松联合对肾组织超微结构的影响
为探究丹酚酸A与低剂量泼尼松联合对大鼠肾组织超微结构的影响,利用透射电镜观察肾皮质组织超薄切片.如图2A所示,空白对照组大鼠肾足细胞足突清晰可见,无肿胀和萎缩,与空白对照组相比,模型组大鼠肾组织超微结构的病理变化主要表现为足细胞足突的广泛融合、裂孔间隙消失(图2B中黑色三角处为典型足细胞融合区域),然而,丹酚酸A与低剂量泼尼松联合治疗能够显著地减少足突的融合范围(图2F),表明联合治疗能够减轻阿霉素诱导的足细胞损伤.
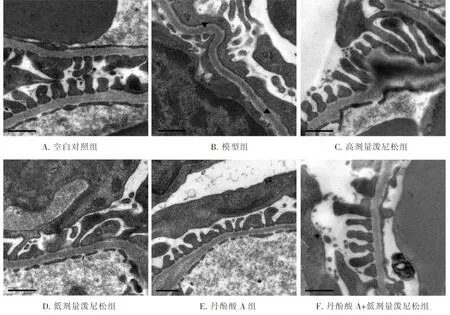
图2 丹酚酸A与低剂量泼尼松联合对肾组织超微结构的影响(标尺=0.5 μm)
2.4 丹酚酸A与低剂量泼尼松联合对血清IL-1β、IL-6、TNF-α、CRP含量的影响
为了探究联合治疗对于MCD大鼠炎症的影响,检测了血清中细胞因子IL-1β、IL-6、TNF-α、CRP的含量.与空白对照组相比,模型组大鼠血清中IL-1β、IL-6、TNF-α、CRP含量明显升高,提示有炎症的存在,联合治疗能够显著降低MCD大鼠血清中IL-1β、IL-6、TNF-α、CRP水平,效果优于丹酚酸A或低剂量泼尼松单用,表明联合治疗有更好的抗炎作用(表3).

表3 丹酚酸A与低剂量泼尼松联合对血清IL-1β、IL-6、TNF-α、CRP含量的影响
注:与空白对照组相比,##P< 0.01;与模型组相比,*P< 0.05,**P<0.01.
2.5 丹酚酸A与低剂量泼尼松联合对肾组织MDA含量和SOD活性的影响
为研究联合治疗对肾组织氧化应激的影响,检测了肾组织MDA含量和SOD活性.与空白对照组相比,模型组大鼠肾组织SOD的活性明显降低,而MDA的含量明显升高;给予丹酚酸A与低剂量泼尼松联合治疗后,肾组织SOD的活性明显升高,MDA的水平显著降低,效果优于两药单用,表明联合治疗拥有有效的抗氧化效果(表4).


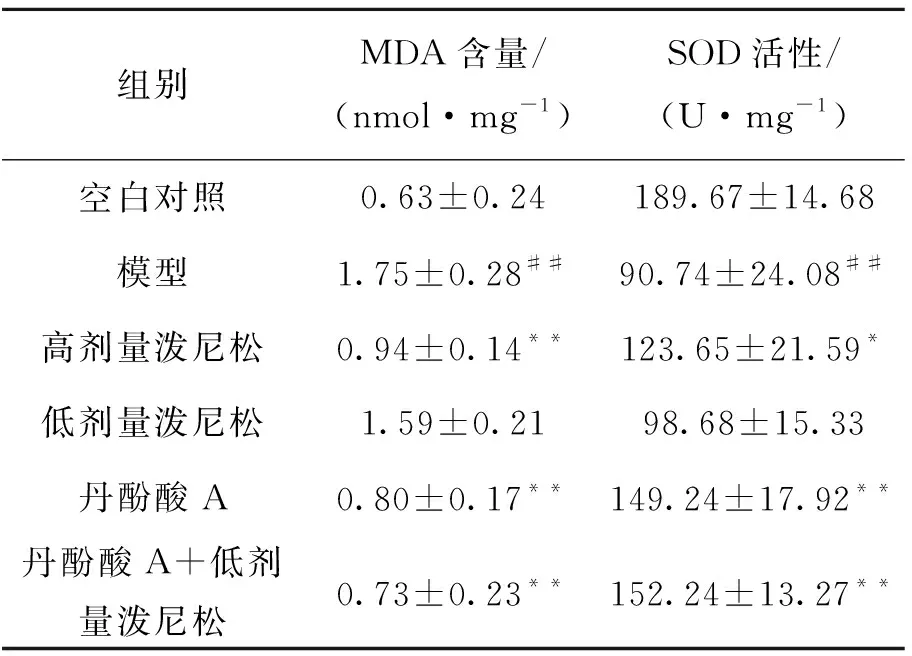
组别MDA含量/(nmol·mg-1)SOD活性/(U·mg-1) 空白对照0.63±0.24189.67±14.68 模型1.75±0.28##90.74±24.08## 高剂量泼尼松0.94±0.14**123.65±21.59* 低剂量泼尼松1.59±0.2198.68±15.33 丹酚酸A0.80±0.17**149.24±17.92** 丹酚酸A+低剂量泼尼松0.73±0.23**152.24±13.27**
注:与空白对照组相比,##P< 0.01;与模型组相比,*P< 0.05,**P<0.01.
3 讨 论
阿霉素诱导的大鼠肾病模型,是最为经典的微小病变型肾病动物模型之一[18-19].在本研究中,采用7.5 mg/kg的阿霉素通过尾静脉注射进行造模,在造模1周后大鼠24 h尿蛋白以时间依赖的方式持续稳定增加,到第4周时,相对正常组,模型组大鼠24 h尿蛋白、血清甘油三酯、总胆固醇含量显著升高,血清总蛋白、白蛋白含量显著降低,同时肾功能受到损伤,表现为大鼠血清BUN和SCr水平显著升高(2个反映肾功能的重要指标),进一步在电镜下发现肾足细胞足突的广泛融合.这些结果都符合阿霉素肾病模型的特点,也与临床MCD的主要病理表现相符合[1],说明在本次实验中所使用的MCD大鼠模型符合实验要求,可以进行后续的药物干预研究.
本研究数据表明,丹酚酸A或低剂量泼尼松单用虽然在一定程度上可以缓解MCD大鼠的肾脏损伤,但是联合给药对阿霉素带来的肾脏损伤有着更好的治疗效果.联合治疗可以有效减少蛋白尿,蛋白尿是促进MCD发展中的重要因素,尽管MCD中蛋白尿产生的机制仍然需要探究,但是目前蛋白尿的产生主要归功于肾小球滤过屏障(由肾小球内皮细胞、肾小球基底膜和肾小球足细胞构成的屏障)的改变[20].本研究观察到,阿霉素诱导的大鼠肾小球基底膜和内皮细胞基本正常,但肾足细胞足突呈现广泛的融合,给予药物后,这种病理改变被联合治疗显著改善.
MCD的病理生理过程极为复杂,过度的炎症反应已经被证明是MCD损伤的重要原因[7-8].MCD发病时IL-1β、IL-6、CRP等炎症介质增加并加重肾脏损伤,并诱导其他细胞因子如TNF-α的产生及释放,进一步加重炎症的破坏作用[7-8].在本研究中,与空白对照组相比,MCD大鼠血清中IL-1β、IL-6、CRP、TNF-α含量明显升高,提示MCD大鼠血清细胞因子分泌紊乱,处于炎症状态.与模型组相比,联合治疗能够显著降低大鼠血清中IL-1β、IL-6、CRP、TNF-α水平,表明丹酚酸A与低剂量泼尼松联合对于MCD大鼠的炎症具有有效的改善作用.
此外,有大量的临床及实验证据表明氧化应激是MCD的一个重要发病机制[9].氧化应激主要是由于ROS的过量产生或机体抗氧化防御能力下降所导致的[9].MDA和SOD是氧化应激及组织损伤的2个理想标志物,其中SOD是机体内一种普遍存在的抗氧化酶[21],而MDA是ROS破坏脂质的产物[11].在本研究中,与空白对照组相比,阿霉素诱导的MCD大鼠肾脏组织MDA含量明显升高,SOD活性显著下降,表明肾脏氧化应激状态的产生,给予丹酚酸A与低剂量泼尼松联合治疗后,可以明显改善SOD活性并减少肾组织MDA水平,表明联合治疗对于MCD大鼠肾脏氧化应激状态具有有效的保护作用.
Webb分数乘积法由Webb于1963年提出,被广泛应用于判断药物的联合作用性质[22].本研究实验设计符合Webb分数乘积法的要求,故通过此法进行判断丹酚酸A和低剂量泼尼松的联合作用.利用Webb分数乘积法计算联合作用对MCD大鼠主要指标尿蛋白影响的q值并判定,发现联合给药对于MCD大鼠的尿蛋白改善有协同作用,结合上述实验结果,其增效机制可能与联合给药的抗炎和抗氧化作用有关.
4 结 论
综上所述,丹酚酸A与低剂量泼尼松联合治疗对微小病变型肾病大鼠尿蛋白的治疗有协同作用,并呈现出显著的保护作用,并优于丹酚酸A或低剂量泼尼松单用,有着良好的应用前景,也为丹酚酸A用于临床MCD的治疗药物的开发和应用提供了实验基础.

