冬季不同类型猪舍内颗粒物与微生物气溶胶浓度分布规律研究
黄 凯,唐 倩,沈 丹,戴鹏远,刘俊泽,李延森,2,李春梅,2*
(1.南京农业大学动物科技学院,南京 210095;2.动物科学类国家级实验教学示范中心,南京 210095)
畜禽生产过程中可产生大量悬浮颗粒物、有害气体、氮氧化物以及微生物等空气污染物[1],这不仅严重危害舍内工作人员和动物的健康[2],还可污染周围大气环境。畜禽养殖场已成为大气环境中细颗粒物(PM2.5和 PM1,空气动力学直径分别≤2.5 μm 和≤1 μm)和可吸入颗粒物(PM10和PM4,空气动力学直径分别≤10 μm和≤4 μm)的重要贡献源之一[3]。悬浮在空气中的微生物气溶胶和细颗粒物,在空气中停留时间长、传播距离远,可随着空气的流动而扩散,这些悬浮的微生物气溶胶和细颗粒物易携带各种微生物细菌或者病毒,一旦被吸入动物体,将对动物健康产生极大的危害[4-5]。微生物气溶胶广泛存在于自然界中,其中包括细菌、病毒、支原体、衣原体、立克次氏体等微生物颗粒,全球每年由微生物气溶胶引起的呼吸道感染及相关并发症位居首位[6]。畜禽舍内微生物气溶胶的来源包括动物脱落的毛发、皮肤分泌物、饲料、垫料以及尘土等[7]。研究发现,鸡采用新城疫病毒气溶胶感染所需的病毒量仅是通过消化道感染所需量的1/200[8];只要1~2个结核杆菌进入猪肺部就足以引起肺结核[9]。病原微生物气溶胶粒径≥6 μm的粒子通常只停留在上呼吸道内,而粒径<2.5 μm的粒子可进入下呼吸道甚至进入肺泡并沉积[10],可导致畜禽发生气管炎、支气管炎或肺炎。封闭式猪舍环境中气载需氧菌含量高,每日约有4.0×105cfu和4.9×106cfu气载需氧菌可分别进入人和猪的小支气管或直接侵入肺泡,从而对人和猪的健康构成潜在威胁[11]。微生物气溶胶可引发动物传染病、过敏性疾病和中毒等至少三种类型的动物疾病[12-13]。有研究发现,空气中微生物气溶胶的浓度与大气中总悬浮颗粒物(TSP,空气动力学直径≤100 μm)浓度具有相关性[14-15]。但是,目前针对不同类型猪舍内颗粒物与微生物气溶胶浓度以及两者相关性的研究较少,因此,本文选取规模化养猪场中的三种主要类型猪舍(妊娠舍、分娩舍和保育舍)作为研究对象,探究不同类型猪舍内颗粒物和微生物气溶胶浓度以及两者之间的相关性。
1 材料与方法
1.1 监测猪舍基本情况
本研究于2018年1月17日—31日对江苏省淮安市某种猪场的保育舍、分娩舍和妊娠舍三种类型猪舍进行了监测。保育舍、分娩舍和妊娠舍均为半封闭式构造,机械通风与自然通风相结合,冬季供暖采用暖风炉加风带,暖风炉放置于室外,风带位于中间走道,南北两面墙上有窗户,西面墙上装有大风机,东面墙上装有湿帘。
保育舍呈东西走向,长24 m,宽9 m,高2.5 m,面积为216 m2,舍内纵向排列2个饲养区域,二列三个走道,共24个饲养单元,每单元饲养15~18头猪,共饲养400头4周龄左右的保育猪。
分娩舍长30 m,宽15 m,高2 m,面积为450 m2,舍内共有4个饲养区域,四列五个走道,共有40个饲养单元,每单元饲养1头分娩母猪和10~14头15日龄左右哺乳仔猪。
妊娠舍呈东西走向,长50 m,宽16 m,高2 m,面积为800 m2,舍内纵向排列4个饲养区域,四列五个走道,每列共有68个限位栏,共272个限位栏,舍内共饲养妊娠母猪250头左右。
1.2 猪舍日常饲养管理
妊娠舍内热风炉自动控温。饲养员每日7:00喂料1次并检查猪群状况,上午9:00清理1次粪便。妊娠舍内母猪饲喂采用自动料筒饲喂颗粒饲料。
分娩舍内保温灯全天开放,热风炉自动控温。饲养员每日7:00、15:00、17:30饲喂3次并检查猪群状况,上午9:00和下午17:00清理2次粪便,15:00进行疾病预防等工作。分娩舍内母猪饲喂粉状饲料,每日根据哺乳母猪饲喂情况人工适量添加。
保育舍内保温灯全天开放,热风炉自动控温。饲养员每日7:00、10:30、15:00、17:30喂料4次并检查猪群状况,每日上午9:00清理1次粪便,15:30进行疾病预防与注射治疗等工作。保育仔猪饲喂添加益生菌类的发酵饲料,每日人工适量添加。
监测试验期间妊娠舍、分娩舍和保育舍内平均温度分别为17.38、21.33℃和21.28℃,相对湿度分别为49.36%、68.45%和54.37%,风速分别为0.17、0.09 m·s-1和 0.1 m·s-1。
1.3 试验仪器和数据采集
试验采用美国特赛TSI DUSTTRAKTMDRX(8533EP型)粉尘监测仪监测不同粒径颗粒物(PM1、PM2.5、PM4、PM10和 TSP)浓度,监测时间设为1 min,仪器测量范围为0.001~10 mg·m-3,相对误差≤10%。采用ZYK-6型六级筛孔撞击式微生物采样器(常州普森)监测并采集微生物气溶胶,仪器采样时间设定3 min,流速设定28.3 L·min-1,六级采样器捕获粒子范围见表1。

表1 ZYK-6型六级筛孔撞击式微生物采样器捕获粒子范围Table 1 ZYK-6 six-stage sieve percussion microbial sampler particle range
采用BPN-40CRH微生物培养箱进行细菌和真菌培养,立式自动电热压力蒸汽灭菌器LDZX-40BI,温度和相对湿度使用TH101C型温湿度仪,测量误差分别为≤±1℃和≤±5%,风速测量使用Testo 425型风速仪(德图公司),测量误差≤±0.01 m·s-1。
1.4 监测试验方案
图1为三种类型猪舍采样及监测位置设置的平面图,1号位置点位于门口处,2号位置点位于舍内中间处,3号位置点位于风机处,4号位置点位于南面墙中间处,5号位置点位于北面墙中间处,高度均设为0.8 m。不同粒径颗粒物监测点为1、2、3、4和5共5个位置,微生物气溶胶采样点设置于2号处。每日分别于3:00、7:00、9:00、11:00、15:00、17:00和22:00监测不同粒径颗粒物(TSP、PM10、PM4、PM2.5、PM1)浓度,每日于3:00、9:00、15:00和22:00采集和监测不同粒径微生物气溶胶(细菌和真菌),连续进行3 d。细菌气溶胶采样使用普通琼脂(LB)培养基,37℃培养24 h后计数;真菌气溶胶采样使用虎红氯霉素琼脂(RBC)培养基,28℃培养48 h后进行计数分析。
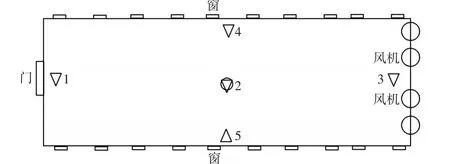
图1 猪舍内采样及监测位置设置平面图Figure 1 Plan of pig house and sampling position
1.5 数据处理与分析
空气中微生物浓度计算公式为空气中微生物数量(cfu·m-3)=平皿上菌落数/[采样时间(min)×28.3 L·min-1]×1000。所有试验原始数据用Excel进行初步整理,再使用GraphPad Prism 6.0以及SPSS 20进行统计分析。用单因素ANOVA统计分析差异显著性,P<0.05表示差异显著,相关性分析中P<0.05表示显著相关。试验数据均以平均值±标准误(Mean±SEM)表示。同一指标内相同字母差异不显著(P>0.05),不同字母代表差异显著(P<0.05)。猪舍采样平面图由Au⁃toCAD 2016软件绘制。
2 结果与讨论
2.1 三种不同类型猪舍内不同粒径颗粒物浓度分析
从表2可知,妊娠舍内TSP、PM10、PM4、PM2.5、PM1平均质量浓度分别为 1.734、0.760、0.313、0.270、0.249 mg·m-3。分娩舍内TSP、PM10、PM4、PM2.5、PM1平均质量浓度分别为 3.102、1.385、0.492、0.408、0.369 mg·m-3。保育舍内 TSP、PM10、PM4、PM2.5、PM1平均质量浓度分别为 1.284、0.572、0.271、0.245、0.230 mg·m-3。三个舍内的不同粒径颗粒物(TSP、PM10、PM4、PM2.5、PM1)浓度,分娩舍均显著高于妊娠舍和保育舍(P<0.05),妊娠舍内的TSP、PM10和PM4质量浓度分别显著高于保育舍(P<0.05),妊娠舍和保育舍两舍之间PM2.5和PM1质量浓度差异不显著(P>0.05)。由图2可知,不同舍内颗粒物质量浓度日变化趋势不一致。妊娠舍(图2A)大致呈现夜间高于白天的趋势;分娩舍(图2B)内9:00和17:00两个时间点浓度较高,夜间22:00最低;保育舍(图2C)内11:00点浓度最高,夜间22:00最低。

表2 三种不同类型猪舍内不同粒径颗粒物的质量浓度(mg·m-3)Table 2 The mass concentration of different particle sizes in three kinds of pigsty(mg·m-3)

图2 三种不同类型猪舍内不同粒径颗粒物质量浓度日变化Figure 2 Time variation of mass concentration of particulate matter in three pig houses in one day
猪舍内颗粒物浓度大小受很多因素影响,本研究发现,三种类型猪舍内颗粒物浓度分布不同,分娩舍浓度最高,其次是妊娠舍,保育舍最低,造成这种差异的原因可能与猪舍构造、饲养动物大小以及饲养管理方式不同有关。Van等[16]研究也发现猪舍内的颗粒物浓度与猪的日龄和状态、猪舍地板构造以及日常管理相关。本研究监测到的妊娠舍、分娩舍和保育舍内的TSP浓度均高于国家标准《规模猪场环境参数及环境管理》(GB/T 17824.3—2008)中规定的TSP浓度(妊娠舍 1.5 mg·m-3、分娩舍 1.2 mg·m-3、保育舍 1.2 mg·m-3),表明目前我国规模化猪舍内颗粒物浓度偏高,不利于动物健康,需要探究降低舍内颗粒物浓度的有效方法。在汪开英等[17]的研究中,保育猪舍内TSP、PM10、PM2.5浓度分别为 0.58~0.81、0.17~0.30、0.016~0.025 mg·m-3,低于本研究在保育舍内监测的结果(TSP、PM10、PM2.5平均质量浓度分别为 1.284、0.572、0.245 mg·m-3)。这可能与两个保育舍的大小、饲养管理模式以及饲养密度等不同有关。另外,喂料、清粪以及猪群状态等也会引起悬浮颗粒物浓度的变化。本研究中的妊娠舍喂料仅在上午7:00进行1次,妊娠母猪由于饥饿,易发生躁动不安,导致猪群活动增加,使舍内的颗粒物质量浓度增加。分娩舍喂料在上午9:00和下午15:00进行2次,此时间点猪群活动量明显增加,引起颗粒物质量浓度增加,达到当日的最高值。保育舍一般在上午10:00清粪,11:00和15:00喂料,故舍内颗粒物浓度在11:00和15:00有两个峰值,夜间22:00关掉照明,猪群睡觉处于安静状态,因此颗粒物浓度有所降低,刘杨等[18]的研究结果与本研究结果相似。猪舍内颗粒物主要来源于饲料和家畜活动,饲料形态不同也会引起舍内颗粒物浓度的改变,饲喂粉状饲料的猪舍TSP和PM10浓度比饲喂颗粒饲料高[19]。本试验中分娩舍饲喂粉状饲料,妊娠舍饲喂颗粒饲料,保育舍饲喂颗粒半湿状的发酵饲料,这也是导致三种类型猪舍内颗粒物浓度不同的原因之一。
2.2 三种不同类型猪舍内不同粒径细菌气溶胶浓度分析
由图3可知,不同猪舍内细菌气溶胶浓度基本呈现逐级降低的趋势。妊娠舍、分娩舍和保育舍内空气细菌分布在第 1级(粒径>7 μm)最高,分别为32.36%、33.06%和35.24%。不同猪舍内不同时间点的细菌气溶胶浓度不相同(图4)。妊娠舍、分娩舍和保育舍细菌气溶胶浓度分别为 1.56×104~2.19×104、7.9×103~1.56×104cfu·m-3和2.7×103~4.1×103cfu·m-3。妊娠舍、分娩舍和保育舍内出现细菌气溶胶浓度最高时间点分别是9:00、15:00和15:00。分娩舍内细菌气溶胶浓度3:00—15:00呈现出逐渐增加趋势,15:00—22:00有所下降。保育舍内细菌气溶胶浓度3:00—15:00呈现出逐渐增加,15:00—22:00逐渐降低趋势。妊娠舍内细菌气溶胶浓度在3:00—9:00逐渐增加,并达到最高值,从9:00以后开始有所下降,15:00开始又再次升高。

图3 三种不同类型猪舍ZYK-6型六级筛孔撞击式微生物采样器各级细菌气溶胶浓度比例Figure 3 Concentration ratio of bacterial aerosol at different levels in three pig houses ZYK-6 six-stage sieve percussion microbial sampler

图4 三种不同类型猪舍内细菌气溶胶浓度的日变化Figure 4 Time variation of bacterial aerosol concentration in three pig houses in one day
猪舍内空气环境微生物的含量与猪的生产性能和饲养人员的健康密切相关,研究表明舍内空气中细菌浓度过高不仅会降低动物的生产性能和对疾病的抵抗能力,还会增加工作人员呼吸道疾病的患病几率。世界卫生组织认为,空气中细菌浓度达到700~1800 cfu·m-3,是发生经空气感染的重要因素。本结果中妊娠舍、分娩舍与保育舍细菌气溶胶浓度均远超过1800 cfu·m-3,也高于现行国家农业行业标准《畜禽场环境质量标准》(NY/T388—1999)中规定的猪场环境中细菌标准1.7×104cfu·m-3,表明冬季猪舍内空气环境质量存在一定的安全隐患。然而Kim等[20]研究发现韩国15个猪场5种类型猪舍内细菌气溶胶平均浓度为1.35×104cfu·m-3,浓度范围14.5~1.82×1010cfu·m-3,与本研究结果相接近。不同猪舍内细菌气溶胶粒径分布基本呈现逐级降低的趋势,且浓度呈现出妊娠舍>分娩舍>保育舍规律。本研究发现,细菌气溶胶主要存在于粒径>2.1 μm级层上,这可能与细菌本身特性相关,大多数杆菌中等大小长2~5 μm,宽0.3~1 μm,螺旋菌一般长5~50 μm,宽0.5~5 μm,球菌直径为 0.5~1 μm。另外,猪舍内 TSP、PM10、PM4、PM2.5和PM1质量浓度依次递减,空气中的细菌易吸附于颗粒物上,所以细菌气溶胶浓度易呈现从1级到6级逐级减少的趋势。胡庆轩等[21]研究发现大气中细菌粒子的粒度分布从1级到6级所占百分比逐级减小,这与本试验结果相似。刘传德[22]研究表明饲养时间和粪便清理时间的长短会引起猪舍内细菌气溶胶浓度的改变。本研究中监测的三种不同类型的猪舍内猪群饲养时间不同,妊娠舍内的妊娠母猪饲养时间长达3个月,分娩舍的母猪饲养时间为1个月,保育舍内的猪饲养时间为0.5个月,因此细菌气溶胶浓度表现为妊娠舍>分娩舍>保育舍。另外,本试验中保育舍和分娩舍内细菌气溶胶浓度最高值均出现在15:00,可能是15:00时舍内温度相对较高,这有利于细菌微生物的繁殖与生长。这与黄藏宇[23]的结论不一致,其研究发现封闭猪舍内细菌浓度最低值出现在上午11:00,浓度高峰出现在下午17:00,造成这种差异的原因,可能是由于空气中的微生物变化多端,且当时的环境因素(如季节等)以及污染条件不同。
2.3 不同类型猪舍内不同粒径真菌气溶胶浓度分析
由图5可见,妊娠舍、分娩舍和保育舍内真菌气溶胶粒径最高比例出现于第4级(粒径范围2.1~3.3 μm)或者第5级(粒径范围1.1~2.1 μm)内,其中真菌气溶胶粒径小于3.3 μm所占比例分别为66%、53%和55%。由图6可知,妊娠舍、分娩舍和保育舍真菌气溶胶浓度分别为260~527、488~1562、421~802 cfu·m-3。妊娠舍内真菌气溶胶浓度最低点出现在15:00,15:00—9:00时间段呈现逐渐升高的趋势;分娩舍内,3:00—15:00呈现出升高的趋势,15:00—3:00呈下降的趋势;保育舍内,9:00—3:00呈现出逐渐降低的趋势。
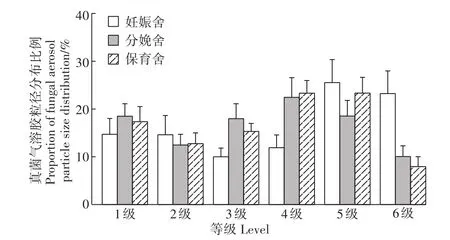
图5 三种不同猪舍的ZYK-6型六级筛孔撞击式微生物采样器各级真菌气溶胶浓度比例Figure 5 Concentration ratio of fungal aerosol at different levels in three pig houses ZYK-6 six-stage sieve percussion microbial sampler

图6 三种不同类型猪舍内真菌气溶胶浓度的日变化Figure 6 Diurnal variation of fungal aerosol concentrations in three types of pig houses
了解真菌气溶胶颗粒的空气动力学直径大小可以估计它们的传播距离和进入呼吸道的深度及其进入肺泡和在空气中的悬浮时间,可以间接地评价真菌气溶胶对人及动物的危害程度[24]。本研究发现,3个猪舍内的真菌气溶胶粒径小于3.3 μm所占比例均超过50%,说明不同类型猪舍内真菌气溶胶粒径均主要集中在3.3 μm以下,容易伴随呼吸进入到动物以及人体支气管以及肺泡内,进而可影响呼吸道健康,这与王雅玲[25]研究结果相似。另外,本研究结果显示,妊娠舍、分娩舍和保育舍内的真菌气溶胶浓度日变化规律不同,这可能与不同猪舍的饲养管理模式不同有关。妊娠舍里每日下午15:00增加通风换气量,这个时间点妊娠舍内的真菌气溶胶含量相对降低,而其他两舍均未进行通风换气处理,舍内的真菌气溶胶含量比妊娠舍高,表明通风换气是影响舍内真菌气溶胶浓度变化的重要因素之一。保育舍上午7:00和9:00的真菌气溶胶浓度最高,这个时间正好是保育舍喂料和清理粪便时间,说明喂料和清理粪便等养猪生产的日常管理都会影响舍内气溶胶浓度的改变。刘建伟等[26]研究结果显示,妊娠舍、保育舍和育肥舍真菌气溶胶浓度范围分别为690~28 000、6900~78 000 cfu·m-3和 80~12 000 cfu·m-3,这与本研究结果不一致。Kim等[20]对韩国15个猪场5种类型的猪舍进行真菌气溶胶监测,平均浓度为1380 cfu·m-3,这与本研究结果相近。导致研究结果不一致,可能与所监测猪舍的地理位置、气候条件、养殖方式、清粪方式以及猪舍内的卫生状况有关。
2.4 颗粒物与微生物相关性分析结果
由表3可见,不同粒径颗粒物之间显著相关(P<0.05),细菌气溶胶浓度与真菌气溶胶浓度之间没有相关性(P>0.05)。TSP与总细菌浓度以及不同粒径细菌气溶胶浓度均显著相关(P<0.05),PM10、PM4和PM2.5都分别与总细菌浓度以及粒径大于1.1 μm细菌气溶胶浓度显著相关(P<0.05),PM1与粒径小于2.1 μm细菌气溶胶浓度没有相关性(P>0.05)。不同粒径颗粒物质量浓度均与真菌气溶胶浓度没有相关性(P>0.05)。
PM1与粒径小于2.1 μm细菌气溶胶浓度没有相关性(P>0.05),说明细菌不易附着于PM1上。而不同粒径颗粒物质量浓度均与真菌气溶胶浓度没有相关性(P>0.05),说明真菌不易附着于颗粒物上。研究表明,空气颗粒物可能是空气细菌的载体,而真菌可能是以孢子的形式独立漂浮于空气中,故与颗粒物浓度没有相关性[27]。另外,本实验采用的颗粒物监测仪器的工作原理为动态光散射原理[28],测量粒子粒径具有准确、快速、可重复性好等优点,已经成为纳米科技中比较常规的一种表征方法。但是以独立形式存在的细菌和真菌气溶胶具有一定的消光系数,消光后散射比与颗粒物散射比有所偏差,因此可能不适合监测独立悬浮在空气中细菌和真菌的质量浓度[29]。
3 结论
(1)猪舍内颗粒物质量浓度分布情况为分娩舍>妊娠舍>保育舍,不同类型猪舍之间TSP和PM10质量浓度差异显著,PM4、PM2.5与PM1之间差异不显著。
(2)猪舍内细菌气溶胶粒径分布表现为逐级减少的趋势,不同类型猪舍内细菌气溶胶浓度存在差异,表现为妊娠舍>分娩舍>保育舍。
(3)猪舍内真菌气溶胶粒径分布主要在粒径小于3.3 μm以下,不同类型猪舍内真菌气溶胶浓度大小表现为分娩舍>妊娠舍>保育舍。
(4)粒径小于1.1 μm的细菌气溶胶和真菌气溶胶的浓度与不同粒径的颗粒物质量浓度均无显著相关,细菌气溶胶浓度与真菌气溶胶浓度之间也没有相关性。

表3 颗粒物浓度与微生物相关分析Table 3 Particles and microorganisms related analysis table

